Журнал "Гастроэнтерология" Том 55, №1, 2021
Вернуться к номеру
Ефективність урсодезоксихолевої кислоти в лікуванні постковідного й медикаментозного ураження печінки
Авторы: Степанов Ю.М., Ягмур В.Б., Меланіч С.Л., Попок Д.В.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
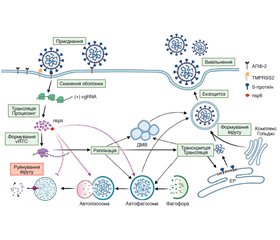
Актуальність. За даними світових досліджень вірусної інфекції COVID-19, у 14–76 % пацієнтів спостерігаються біохімічні ознаки ураження печінки. Вони є як наслідком прямої дії вірусу, так і результатом загальної запальної реакції і пошкодження, індукованого ліками, що використовуються при лікуванні інфекції. Мета: вивчити вплив перенесеної коронавірусної інфекції на функціональний стан печінки й ефективність корекції виявлених порушень. Матеріали та методи. Обстежено 16 хворих (6 жінок і 10 чоловіків) віком (48,5 ± 10,2) року, які мали коронавірусну інфекцію в анамнезі й приймали азитроміцин. Усім пацієнтам проводилось біохімічне дослідження сироватки крові з визначенням аланінамінотрансферази, аспартатамінотрансферази, лужної фосфатази, загального білірубіну й міжнародного нормалізованого співвідношення, ультразвукове дослідження органів черевної порожнини з наступною статистичною обробкою даних. Визначали тип ураження печінки (гепатоцелюлярний, холестатичний і змішаний) і його ступінь (мінімальний, помірний і виражений). Результати. Пошкодження печінки, індуковане азитроміцином при лікуванні COVID-19, характеризувались скаргами на біль і відчуття тяжкості в правому підребер’ї в усіх пацієнтів і диспептичними проявами у вигляді нудоти, здуття живота — у більшості з них. Ураження печінки характеризувалось переважно холестатичним і змішаним типом пошкодження. Хворим призначався препарат урсодезоксихолевої кислоти в добовій дозі 10–15 мг/кг упродовж 4–6 тижнів. У динаміці лікування встановлено зниження частоти й інтенсивності больового синдрому, вираженості диспептичних та астенічних проявів, покращання показників цитолізу й холестазу. Висновки. Урсодезоксихолева кислота в лікуванні постковідного й медикаментозного ураження печінки є ефективним і безпечним засобом, що дозволяє як покращити суб’єктивний стан пацієнтів, так і нормалізувати біохімічні показники крові.
Актуальность. По данным мировых исследований вирусной инфекции COVID-19, у 14–76 % пациентов наблюдаются биохимические признаки поражения печени. Они являются как следствием прямого действия вируса, так и результатом общей воспалительной реакции и повреждения, индуцированного лекарствами, использующимися при лечении инфекции. Цель: изучить влияние перенесенной коронавирусной инфекции на функциональное состояние печени и эффективность коррекции выявленных нарушений. Материалы и методы. Обследовано 16 больных (6 женщин и 10 мужчин) в возрасте (48,5 ± 10,2) года, имеющих коронавирусную инфекцию в анамнезе и получавших азитромицин. Всем пациентам проводилось биохимическое исследование сыворотки крови с определением аланинаминотрансферазы, аспартатаминотрансферазы, щелочной фосфатазы, общего билирубина и международного нормализованного соотношения, ультразвуковое исследование органов брюшной полости с последующей статистической обработкой данных. Определяли тип поражения печени (гепатоцеллюлярный, холестатический и смешанный) и его степень (минимальная, умеренная и выраженная). Результаты. Повреждения печени, индуцированные азитромицином при лечении COVID-19, характеризовались жалобами на боль и чувство тяжести в правом подреберье у всех пациентов и диспептическими проявлениями в виде тошноты, вздутия живота — у большинства. Поражение печени характеризовалось преимущественно холестатическим и смешанным типом повреждения. Больным назначался препарат урсодезоксихолевой кислоты в дозе 10–15 мг/кг в течение 4–6 недель. В динамике лечения установлено снижение частоты и интенсивности болевого синдрома, выраженности диспептических и астенических проявлений, улучшение показателей цитолиза и холестаза. Выводы. Использование урсодезоксихолевой кислоты в лечении постковидного и медикаментозного поражения печени является эффективным и безопасным средством, позволяющим как улучшить субъективное состояние пациентов, так и нормализовать биохимические показатели крови.
Background. According to the global studies of viral infection COVID-19, 14–76 % of patients have biochemical signs of liver damage. They are the result of both the direct action of the virus and a general inflammatory reaction and damage induced by the drugs used to treat the infection. The purpose was to study the effect of coronavirus infection on the functional state of the liver and the effectiveness of correction of detected disorders. Materials and methods. We examined 16 patients (6 women and 10 men) aged (48.5 ± 10.2) years who had a history of coronavirus infection and received azithromycin. All patients underwent serum biochemical examination with determination of alanine aminotransferase, aspartate aminotransferase, alkaline phosphatase, total bilirubin, and international normalized ratio, ultrasound examination of abdominal organs followed by statistical data processing. The type of liver damage (hepatocellular, cholestatic, and mixed) and its degree (minimal, moderate, and severe) were determined. Results. Hepatic impairment induced by azithromycin in the treatment of COVID-19 was characterized by complaints of pain and heaviness in the right hypochondrium in all patients and dyspeptic manifestations in the form of nausea, bloating — in most patients. Liver damage was characterized mainly by cholestatic and mixed types of damage. Patients have been prescribed the drug of ursodeoxycholic acid in a daily dose of 10–15 mg/kg for 4–6 weeks. The dynamics of treatment revealed a decrease in the frequency and intensity of pain, the severity of dyspeptic and asthenic manifestations, improved cytolysis and cholestasis. Conclusions. The use of ursodeoxycholic acid in the treatment of COVID-19 infection and drug-induced liver damage is an effective and safe tool that can improve both the subjective condition of patients and normalize blood biochemical parameters.
гепатит; коронавірусна хвороба; азитроміцин; урсодезоксихолева кислота
гепатит; коронавирусная болезнь; азитромицин; урсодезоксихолевая кислота
hepatitis; coronavirus disease; azithromycin; ursodeoxycholic acid
Вступ
Матеріали та методи
Результати
/26.jpg)
/27.jpg)
/28.jpg)
Обговорення
Висновки
- COVID-19 Map. Johns Hopkins Coronavirus Resource Center. John Hopkins University and Medicine. 2020. https://coronavirus.jhu.edu/map.html.
- Xie M., Chen Q. Insight into 2019 novel coronavirus — An updated in terim review and lessons from SARS-CoV and MERS-CoV. Int. J. Infect. Dis. 2020. 94. 119-124.
- Коронавірусна інфекція. https://news.google.com/covid19/map?hl=ru&gl=RU&ceid=RU%3Aru.
- Nardo A.D., Schneeweiss-Gleixner M., Bakail M., Dixon E.D., Lax S.F., Trauner M. Pathophysiological mechanisms of liver injury in COVID-19. Liver International. 2020. 00. 1-13. DOI: 10.1111/liv.14730.
- Li J., Fan J.-G. Characteristics and mechanism of liver injury in 2019 coronavirus disease. J. Clin. Transl. Hepatol. 2020. 8. 13.
- Hamid S., Alvares da Silva M.R., Burak K.W., Chen T., Drenth J.P.H., Esmat G., Gaspar R., LaBrecque D., Lee A., Macedo G., McMahon B., Ning Q., Reau N., Sonderup M., van Leeuwen D.J., Armstrong D., Chir B., Yurdaydin C. WGO guidance for the care of patients with COVID-19 and liver disease. J. Clin. Gastroenterol. 2021, Jan. 55(1). 1-11. doi: 10.1097/MCG.0000000000001459.
- Chai X., Hu L., Zhang Y. et al. Specific ACE2 expression in cholangiocytes may cause liver damage after 2019-nCoV infection [PREPRINT]. BioRxiv. 2020. 10.1101/2020.02.03.931766.
- COVID-19 and liver disease. Editor. Sun J., Aghemo A., Forner A., Valenti L. Liver International. 2020. 40. 1278-1281. doi: 10.1111/liv.14470.
- Singh S., Khan A. Clinical characteristics and outcomes of COVID-19 among patients with preexisting liver disease in United States: a multi-center research network study. Gastroenterology. 2020 [Epub a head of print].10.1053/j.gastro.2020.04.064.
- Fontana R.J., Watkins P.В., Bonkovsky H.L., Chalasani N., Davern T., Serrano J., Rochon J. Drug-induced liver Injury network (DILIN) prospective study: Rationale, Design and Conduct. Drug. Saf. 2009. 32(1). 55-68.
- Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике: в 2 т. Минск: Беларусь, 2009. Т. 2. 465 с.
- Медицинская статистика: учебное пособие. Под ред. Басовской М.Т. Ростов-на-Дону: Феникс, 2017. 324 с.
- Sultan Sh., Altayar O., Siddique Sh.M., Davitkov P, Feuerstein J.D., Lim J.K., Falck-Ytter Y., El-Serag H.B. AGA Institute Rapid Review of the Gastrointestinal and Liver Manifestations of COVID-19. Meta-Analysis of International Data, and Recommendations for the Consultative Management of Patients with COVID-19. Gastroenterology. 2020. 159. 320-334.
- Dong Z., Xiang B., Jiang M., Sun M., Dai C. The Prevalence of Gastrointestinal Symptoms, Abnormal Liver Function, Digestive System Disease and Liver Disease in COVID-19 Infection. A Systematic Review and Meta-Analysis. J. Clin. Gastroenterol. 2021, January. Vol. 55. № 1. 67-76.
- Wander P., Epstein M., Bernstein D. COVID-19 Presenting as Acute Hepatitis. Am. J. Gastroenterol. 2020. 00. 1-2. https://doi.org/10.14309/ajg.0000000000000660.
- Lagana S.M., De Michele S., Lee M.J., Emond J.C., Griesemer A.D., Tulin-Silver S.A., Verna E.C., Martinez M., Lefkowitch J.H. COVID-19-Associated Hepatitis Complicating Recent Living Donor Liver Transplantation. Arch. Pathol. Lab. Med. 2020, August. Vol. 144. 929-932.
- Cha M.H., Regueiro M., Sandhu D.S. Gastrointestinal and hepatic manifestations of COVID-19: A comprehensive review. World J. Gastroenterol. 2020. May 21. 26(19). 2323-2332.
- Han B., Sheng Y., Wang L., Feng H., Hou X., Li Y. Intrahepatic cholestasis of pregnancy or azithromycin-induced intrahepatic cholestasis. A case report. Medicine. 2017. 96. 52(e9346). 1-4.
- Maggioli C., Santi L., Zaccherini G., Bevilacqua V., Giunchi F., Caraceni P. A Case of Prolonged Cholestatic Hepatitis Induced by Azithromycin in a Young Woman. Case Reports in Hepatology. 2011. 1-4. ID 314231. doi: 10.1155/2011/314231.
- Chalasani N., Bonkovsky H.L., Fontana R., Lee W., Stolz A., Talwalkar J., Reddy K.R., Watkins P.B., Navarro V., Barnhart H., Gu J., Serrano J. Features and Outcomes of 899 Patients with Drug-induced Liver Injury: The DILIN Prospective Study . Gastroenterology. 2015, June. 148(7). 1340-1352.e7. doi: 10.1053/j.gastro.2015.03.006.
- Beuers U., Gershwin M.E., Gish R.G. et al. Changing nomenclature for PBC: From ‘cirrhosis’ to ‘cholangitis’. J. Hepatol. 2015, Nov. 63(5). 1285-1287.
- Trauner M., Fuchs C.D., Halilbasic E., Paumgartner G. New therapeutic concepts in bile acid transport and signaling for management of holestasis. Hepatology. 2017, Apr. 65(4). 1393-1404.
- Chapman R.W. Cost effectiveness of using ursodeoxycholic acid to treat primary biliary cholangitis. British Journal of Hospital Medicine. 2018. Vol. 79. № 8. https://doi.org/10.12968/hmed.2018.79.8.460.
- Katsinelos P., Vasiliadis T., Xiarchos P. et al. Ursodeoxycholic acid (UDCA) for the treatment of amoxycillin-clavulanate potassium (Augmentin)-induced intra-hepatic cholestasis: report of two cases. Eur. J. Gastroenterol., Hepatol. 2000. 12(3). 365-368.
- Uraz S., Tahan V., Aygun C. et al. Role of ursodeoxycholic acid in prevention of methotrexate-induced liver toxicity. Dig. Dis. Sci. 2008. 53(4). 1071-1077.
- Wree A., Dechene A., Herzer K. et al. Steroid and ursodesoxycholic Acid combination therapy in severe drug-induced liver injury. Digestion. 2011. 84(1). 54-59.
- Stine J.G., Lewis J.H. Current and future directions in the treatment and prevention of drug-induced liver injury: a systematic review. Expert Rev. Gastroenterol., Hepatol. 2016. 10(4). 517-36. doi: 10.1586/17474124.2016.1127756.

/25.jpg)
/27_2.jpg)