Журнал "Гастроэнтерология" Том 58, №3, 2024
Вернуться к номеру
Патогенетичне значення порушень слизового бар’єра у хворих із синдромом подразненого кишечника та можливості корекції
Авторы: Дорофєєв А.Е. (1), Приходько В.М. (1), Ткач С.М. (2), Дядик О.О. (1), Криворук О.М. (3),
Гуркало Ю. (З,4)
(1) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(2) - Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
(3) - Клінічна лікарня «Феофанія», м. Київ, Україна
(4) - Українська військово-медична академія, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
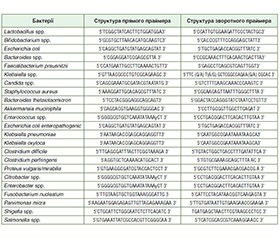
Актуальність. Метою дослідження є оцінка ролі порушень слизового бар’єра кишечника із вивченням кишкового мікробіому та морфологічних змін слизової оболонки кишечника у хворих з СПК та аналіз ефективності пробіотика Ремедіум у комплексному лікуванні цих пацієнтів. Матеріали та методи. Дослідження було рандомізованим відкритим контрольованим порівняльним з паралельними групами. Був обстежений 61 пацієнт з синдромом подразненого кишечника, віком від 21 до 54 років (середній вік (36,0 ± 5,5) року), з них 36 жінок та 25 чоловіків. З огляду на єдині патогенетичні механізми у пацієнтів з СПК, незалежно від характеру порушень випорожнення, у дослідження були включені лише хворі зі змішаним підтипом СПК, які мали і діарею, і запори (СПК-Зм — діарея у ≥ 25 % і запор у ≥ 25 %). Усім пацієнтам у динаміці проводилось дослідження якісного та кількісного складу мікробіому у випорожненнях методом полімеразної ланцюгової реакції з кількісним визначенням Lactobacillus spp., Bifidobacterium spp., Escherichia coli, Bacteroides fragilis group, Bacteroides thetaiotaomicron, Akkermansia muciniphila, Faecalibacterium prausnitzii, співвідношення Firmicutes/Bacteroidetes, Clostridium difficile, Clostridium perfringens, Klebsiella pneumoniae, Klebsiella oxytoca, Escherichia coli enteropathogenic, Enterococcus spp., Proteus spp., Citrobacter spp., Fusobacterium nucleatum, Parvimonas micra, Salmonella spp., Shigella spp., Candida spp., колоноскопія із сегментною біопсією для подальшого патоморфологічного та імунгістохімічного дослідження. Результати. У пацієнтів зі змішаним підтипом СПК на тлі розвитку клінічної симптоматики відбувається порушення кишкового мікробіому зі зниженням облігатної флори: Akkermansia muciniphila, Bifidobacterium spp., Bacteroides thetaiotaomicron та Faecalibacterium prausnitzii та зростанням кількості умовно-патогенних бактерій: Clostridium difficile, Escherichia coli enteropathogenic, Citrobacter spp. Ці зміни індукують мікрозапалення в слизовій оболонці товстого кишечника із десквамацією епітелію, лімфогістіоплазмоцитарною клітинною інфільтрацією строми, порушеннями мікроциркуляції та модифікацією проникності епітеліального бар’єра кишечника. Висновки. Використання пробіотика Ремедіум показало клінічну ефективність та безпечність при корекції клінічних симптомів синдрому подразненого кишечника. Доведено позитивний вплив на відновлення кишкового мікробіому із збільшенням облігатної флори та пригніченням умовно-патогенної, що сприяло регенерації мікропошкоджень в клітинах слизової оболонки кишечника та мінімізації мікрозапалення з тенденцією до нормалізації мікроциркуляції та епітеліальної проникності.
Background. The purpose of the study is to assess the role of intestinal mucosal barrier disorders with the investigation of the intestinal microbiome and morphological changes of the colon mucosa in patients with irritable bowel syndrome (IBS) and to analyze the efficacy of the probiotic Remedium in the comprehensive treatment of these patients. Materials and methods. The study was a randomized, open-label, parallel-group controlled trial. Sixty-one patients with irritable bowel syndrome, 36 women and 25 men aged 21 to 54 years (average of (36.0 ± 5.5) years), were examined. Considering the single pathogenic mechanisms in patients with IBS, regardless of the type of defecation disorders, only people with a mixed subtype of IBS who had both diarrhea and constipation (diarrhea in ≥ 25 % and constipation in ≥ 25 %) were included in the study. All patients underwent a dynamic study of the qualitative and quantitative composition of the microbiome in stool by polymerase chain reaction with quantitative determination of Lactobacillus spp., Bifidobacterium spp., Escherichia coli, Bacteroides fragilis group, Bacteroides thetaiotaomicron, Akkermansia muciniphila, Faecalibacterium prausnitzii, correlation Firmicutes/Bacteroidetes, Clostridium difficile, Clostridium perfringens, Klebsiella pneumoniae, Klebsiella oxytoca, enteropathogenic Escherichia coli, Enterococcus spp., Proteus spp., Citrobacter spp., Fusobacterium nucleatum, Parvimonas micra, Salmonella spp., Shigella spp., Candida spp. Colonoscopy with segmental biopsy for further pathomorphological and immunohistochemical examination was performed. Results. In patients with a mixed subtype of IBS, against the background of the development of clinical symptoms, there is a disturbance of the intestinal microbiome with a decrease in obligate flora: Akkermansia muciniphila, Bifidobacterium spp., Bacteroides thetaiotaomicron and Faecalibacterium prausnitzii, and an increase in the number of opportunistic bacteria: Clostridium difficile, enteropathogenic Escherichia coli, Citrobacter spp. These changes induce microinflammation in the mucosa of the large intestine with desquamation of the epithelium, lymphohistioplasmacytic cell infiltration of the stroma, microcirculation disorders and modification of the permeability of the intestinal epithelial barrier. Conclusions. The use of probiotic Remedium has shown clinical efficacy and safety in correcting the clinical symptoms of irritable bowel syndrome. It had a positive effect on the restoration of the intestinal microbiome with an increase in obligate flora and suppression of opportunistic pathogens, contributed to the regeneration of microdamages to the cells of the intestinal mucosa and minimization of microinflammation with a tendency to normalize microcirculation and epithelial permeability.
синдром подразненого кишечника; слизовий бар’єр; кишковий мікробіом
irritable bowel syndrome; mucosal barrier; intestinal microbiome
Вступ
Матеріали та методи
Результати та обговорення
/36_2.jpg)
Висновки
- Drossman DA, Hasler WL. Rome IV-functional gi disorders: disorders of gut-brain interaction. Gastroenterology. 2016;150(6):1257-61. doi: 10.1053/j.gastro.2016.03.035.
- Ghoshal UC. Postinfection Irritable Bowel Syndrome. Gut Li–ver. 2022;16(3):331-340. doi: 10.5009/gnl210208.
- Melchior C, Colomier E, Trindade IA, Khadija M, Hreinsson JP, Törnblom H, Simrén M. Irritable bowel syndrome: Factors of importance for disease-specific quality of life. United European Gastroenterol J. 2022 Sep;10(7):754-764. doi: 10.1002/ueg2.12277.
- Klem F, Wadhwa A, Prokop LJ, et al. Prevalence, risk factors, and outcomes of irritable bowel syndrome after infectious enteritis: a systematic review and meta analysis. Gastroenterology. 2017;152:1042-1054. doi: 10.1053/j.gastro.2016.12.039.
- Parida PK, Mishra D, Pati GK, et al. A prospective study on incidence, risk factors, and validation of a risk score for post-infection irritable bowel syndrome in coastal eastern India. Indian J Gastroenterol. 2019;38:134-142. doi: 10.1007/s12664-019-00943-w.
- Knowles SR, Austin DW, Sivanesan S, Tye-Din J, Leung C, Wilson J, et al. Relations between symptom severity, illness perceptions, visceral sensitivity, coping strategies and well-being in irritable bowel syndrome guided by the common sense model of illness. Psychol Health Med. 2017;22(5):524-34. doi: 10.1080/13548506.2016.1168932.
- Leech B, Schloss J, Steel A. Treatment Interventions for the Management of Intestinal Permeability: A Cross-Sectional Survey of Complementary and Integrative Medicine Practitioners. J Altern Complement Med. 2019;25(6):623-636. doi: 10.1089/acm.2018.0374.
- Canakis A, Haroon M, Weber HC. Irritable bowel syndrome and gut microbiota. Curr Opin Endocrinol Diabetes Obes. 2020 Feb;27(1):28-35. doi: 10.1097/MED.0000000000000523.
- Ustianowska K, Ustianowski Ł, Machaj F, Gorący A, Rosik J, Szostak B, Szostak J, Pawlik A. The Role of the Human Microbiome in the Pathogenesis of Pain. Int J Mol Sci. 2022 Oct 31;23(21):13267. doi: 10.3390/ijms232113267.
- El-Salhy M, Hatlebakk JG, Hausken T. Diet in Irritable Bo–wel Syndrome (IBS): Interaction with Gut Microbiota and Gut Hormones. Nutrients. 2019 Aug 7;11(8):1824. doi: 10.3390/nu11081824.
- Hillestad EMR, van der Meeren A, Nagaraja BH, Bjørsvik BR, Haleem N, Benitez-Paez A, Sanz Y, Hausken T, Lied GA, Lundervold A, Berentsen B. Gut bless you: The microbiota-gut-brain axis in irritable bowel syndrome. World J Gastroenterol. 2022 Jan 28;28(4):412-431. doi: 10.3748/wjg.v28.i4.412.
- Yuan Y, Wang X, Huang S, Wang H, Shen G. Low-level inflammation, immunity, and brain-gut axis in IBS: unraveling the complex relationships. Gut Microbes. 2023 Dec;15(2):2263209. doi: 10.1080/19490976.2023.2263209.
- Han L, Zhao L, Zhou Y, Yang C, Xiong T, Lu L, et al. Altered metabolome and microbiome features provide clues in understanding irritable bowel syndrome and depression comorbidity. ISME J. 2022 Apr;16(4):983-996. doi: 10.1038/s41396-021-01123-5.
- Yoshimoto T, Oshima T, Huang X, Tomita T, Fukui H, Miwa H. Microinflammation in the intestinal mucosa and symptoms of irritable bowel syndrome. J Gastroenterol. 2022 Feb;57(2):62-69. doi: 10.1007/s00535-021-01838-4.
- Zhang T, Zhang C, Zhang J, Sun F, Duan L. Efficacy of Probiotics for Irritable Bowel Syndrome: A Systematic Review and Network Meta-Analysis. Front Cell Infect Microbiol. 2022;12:859967. Published 2022 Apr 1. doi: 10.3389/fcimb.2022.859967.
- Simon E, Călinoiu LF, Mitrea L, Vodnar DC. Probiotics, Prebiotics, and Synbiotics: Implications and Beneficial Effects against Irritable Bowel Syndrome. Nutrients. 2021 Jun 20;13(6):2112. doi: 10.3390/nu13062112.
- Sheehan GM, Kallakury BV, Sheehan CE, Fisher HA, Kaufman RP Jr, Ross JS. Loss of claudins-1 and -7 and expression of claudins-3 and -4 correlate with prognostic variables in prostatic adenocarcinomas. Hum Pathol. 2007 Apr;38(4):564-9. doi: 10.1016/j.humpath.2006.11.007.

/32.jpg)
/33.jpg)
/34.jpg)
/35.jpg)
/36.jpg)