Журнал "Гастроэнтерология" Том 56, №3, 2022
Вернуться к номеру
Цитокіновий профіль у хворих на атрофічний гастрит в умовах коморбідності з патологією щитоподібної залози
Авторы: Мосійчук Л.М., Татарчук О.М., Коненко І.С., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
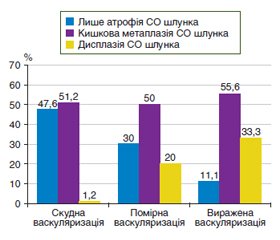
Актуальність. Оптимізація тактики ведення пацієнтів з передраковими станами шлунка в умовах коморбідної патології є актуальним завданням гастроентерології. Мета дослідження: оцінити вміст про- і протизапальних цитокінів, а також рівень васкулоендотеліального фактора росту (VEGF) при різних ступенях вираженості васкуляризації щитоподібної залози у хворих на атрофічний гастрит. Матеріали та методи. Проведено дослідження 120 хворих на атрофічний гастрит з патологією щитоподібної залози. Усім обстеженим проводилось сонологічне дослідження щитоподібної залози на ультразвуковому сканері Toshiba Xario (Japan), за результатами якого у 82 (68,3 %) випадків встановлено скудну васкуляризацію паренхіми; у 20 (16,7 %) хворих діагностовано помірну васкуляризацію і у 18 (15,0 %) пацієнтів спостерігали виражену васкуляризацію паренхіми щитоподібної залози. Кількісний вміст цитокінів (ІЛ-8, ІЛ-10, ІЛ-18, фактора некрозу пухлини альфа), VEGF у сироватці крові визначали імуноферментним методом реактивами фірми «Вектор-БЕСТ». Результати. Серед пацієнтів зі скудною васкуляризацією майже в половини — 39 (47,6 %) осіб — діагностовано лише атрофічні зміни слизової оболонки шлунка, у той час як у третині випадків серед хворих з вираженою васкуляризацією діагностовані диспластичні зміни слизової оболонки шлунка. Кишкову метаплазію виявляли в половині випадків незалежно від вираженості васкуляризації паренхіми щитоподібної залози У хворих на атрофічний гастрит встановлено цитокіновий дисбаланс з найбільшим зсувом при вираженій васкуляризації паренхіми щитоподібної залози за рахунок збільшення в 4 рази рівня прозапальних цитокінів ІЛ-8 (р < 0,05) і в 1,7 раза — ІЛ-18 (р < 0,05) з одночасним зниженням в 3,2 раза вмісту протизапального цитокіну ІЛ-10 (р < 0,05) порівняно з контрольними показниками. Рівень VEGF у сироватці крові хворих на атрофічний гастрит з помірною і вираженою васкуляризацією паренхіми щитоподібної залози був вірогідно підвищений у 1,5 раза (р < 0,05) і 1,7 раза (р < 0,05) порівняно з рівнем у хворих зі скудною васкуляризацією. Висновки. У хворих на атрофічний гастрит встановлено цитокіновий дисбаланс, який поглиблюється при збільшенні вираженості васкуляризації щитоподібної залози, що, можливо, пов’язано зі спільними патогенетичними механізмами розвитку коморбідної патології.
Background. Optimization of the management of patients with precancerous conditions of the stomach in comorbid pathology is an urgent task of gastroenterology. The purpose of the study: to evaluate the content of pro- and anti-inflammatory cytokines, as well as the level of vascular endothelial growth factor (VEGF) at different degrees of vascularization of the thyroid gland in patients with atrophic gastritis. Materials and methods. A study was conducted in 120 patients with atrophic gastritis and thyroid pathology. All of them underwent a sonological examination of the thyroid gland using an ultrasound scanner Toshiba Xario (Japan), which revealed poor vascularization of the parenchyma in 82 (68.3 %) cases, moderate vascularization was diagnosed in 20 (16.7 %) patients and marked — in 18 (15.0 %). Quantitative content of cytokines (interleukins (IL) 8, 10, 18, tumor necrosis factor α), vascular endothelial growth factor in the blood serum was determined by immunoenzymatic assay using Vector-Best reagents. Results. Among patients with poor vascularization, only atrophic changes of the gastric mucosa were diagnosed in almost half — 39 (47.6 %) people, while dysplastic changes of the gastric mucosa were found in a third of patients with marked vascularization. Intestinal metaplasia was detected in half of cases, regardless of the degree of vascularization of the thyroid parenchyma. Cytokine imbalance was found in patients with atrophic gastritis, with the greatest shift in case of marked vascularization of the thyroid parenchyma due to a 4-fold increase in the level of pro-inflammatory cytokines IL-8 (р < 0.05) and by 1.7 times of IL-18 (p < 0.05), with a simultaneous decrease in the content of the anti-inflammatory cytokine IL-10 by 3.2 times (p < 0.05) compared to control indicators. The level of VEGF in the blood serum of patients with atrophic gastritis with moderate and marked vascularization of the thyroid parenchyma was significantly increased by 1.5 (p < 0.05) and 1.7 times (p < 0.05), respectively, compared to that of people with poor vascularization. Correlations were revealed between the degree of vascularization of the thyroid parenchyma and the level of IL-8 (r = 0.491; p = 0.031) and VEGF (r = 0.444; p = 0.019) in patients with atrophic gastritis. Conclusions. Patients with atrophic gastritis had a cytokine imbalance, which deepens as the vascularization of the thyroid gland increases that is possibly related to common pathogenetic mechanisms of the development of comorbid pathology.
атрофічний гастрит; цитокіни; васкулоендотеліальний фактор росту; васкуляризація паренхіми щитоподібної залози
atrophic gastritis; cytokines; vascular endothelial growth factor; vascularization of the thyroid gland parenchyma
Вступ
Матеріали та методи
/15.jpg)
/16.jpg)
Результати
/17_2.jpg)
Обговорення
Висновки
- Shah S.C., Piazuelo M.B., Kuipers E.J., Li D. AGA Clinical Practice Update on the Diagnosis and Management of Atrophic Gastritis: Expert Review. Gastroenterology. 2021. Vol. 161(4). P. 1325-1332.
- Lahner E., Conti L., Annibale B., Corleto V.D. Current Perspectives in Atrophic Gastritis. Curr Gastroenterol Rep. 2020. Vol. 22(8). P. 38.
- Crafa P., Russo M., Miraglia C., Barchi A., Moccia F., Nouvenne A. et al. From Sidney to OLGA: an overview of atrophic gastritis. Acta Biomed. 2018. Vol. 89(8-S). P. 93-99.
- Banks M., Graham D., Jansen M., Gotoda T., Coda S., di Piet–ro M. et al. British Society of Gastroenterology guidelines on the diagnosis and management of patients at risk of gastric adenocarcinoma. Gut. 2019. Vol. 68(9). P. 1545-1575.
- Nieuwenburg S.A.V., Mommersteeg M.C., Eikenboom E.L., Yu B., den Hollander W.J., Holster I.L. et al. Factors associated with the progression of gastric intestinal metaplasia: a multicenter, prospective cohort study. Endosc Int Open. 2021. Vol. 9(3). P. E297-E305.
- Gullo I., Grillo F., Mastracci L., Vanoli A., Carneiro F., Saragoni L. et al. Precancerous lesions of the stomach, gastric cancer and hereditary gastric cancer syndromes. Pathologica. 2020. Vol. 112(3). P. 166-185.
- Пасієшвілі Т.М. Оцінка особливостей змін та діагностичної інформативності цитокінового профілю в осіб молодого віку з гастроезофагеальною рефлюксною хворобою, яка перебігає на тлі автоімунного запалення. Сучасна гастроентерологія. 2019. № 2(106). С. 16–21.
- Magris R., De Re V., Maiero S., Fornasarig M., Guarnieri G., Caggiari L. et al. Low Pepsinogen I/II Ratio and High Gastrin-17 Levels Typify Chronic Atrophic Autoimmune Gastritis Patients With Gastric Neuroendocrine Tumors. Clin Transl Gastroenterol. 2020. Vol. 11(9). P. e00238.
- Rodriguez-Castro K.I., Franceschi M., Miraglia C., Russo M., Nouvenne A., Leandro G. et al. Autoimmune diseases in autoimmune atrophic gastritis. Acta Biomed. 2018. Vol. 89(8-S). P. 100-103.
- Ma H.Y., Liu X.Z., Liang C.M. Inflammatory microenvironment contributes to epithelial-mesenchymal transition in gastric cancer. World J Gastroenterol. 2016. № 22. P. 6619-6628.
- Liao C.-P., Booker R.C., Brosseau J.-P., Chen Z., Mo J., Tchegnon E. et al. Contributions of inflammation and tumor microenvironment to neurofibroma tumorigenesis. J Clin Investig. 2018. № 128. P. 2848-2861.
- Bockerstett K.A., DiPaolo R.J. Regulation of Gastric Carcinogenesis by Inflammatory Cytokines. Cell Mol Gastroenterol Hepatol. 2017. Vol. 4(1). P. 47-53.
- Yoshimura A., Ito M., Chikuma S., Akanuma T., Nakat-–sukasa H. Negative Regulation of Cytokine Signaling in Immunity. Cold Spring Harb Perspect Biol. 2018. Vol. 10(7). P. a028571.
- Дідушко О.М. Ендотеліальна дисфункція як фактор розвитку порушення функції нирок у хворих на гіпотиреоз. Міжнародний ендокринологічний журнал. 2016. № 3(75). С. 114-119.
- Siregar G.A., Halim S., Sitepu V.R. Serum TNF-a, IL-8, VEGF levels in Helicobacter pylori infection and their association with degree of gastritis. Acta Med Indones. 2015. Vol. 47(2). P. 120-126.
- Alexander L.F., Patel N.J., Caserta M.P., Robbin M.L. Thyroid Ultrasound: Diffuse and Nodular Disease. Radiol Clin North Am. 2020. Vol. 58(6). P. 1041-1057. doi: 10.1016/j.rcl.2020.07.003.
- Паламарчук А.В., Власенко М.В. Діагностика вузлових утворень щитоподібної залози. Практикуючий лікар. 2018. T. 7. № 4. С. 46-52.
- Івахно І.В. Діагностичне та прогностичне значення васкуляризації папілярних мікрокарцином щитоподібної залози. Патологія. 2015. № 1(33). С. 70-72.

/16_2.jpg)
/17.jpg)
/18.jpg)