Вступ
Запальні захворювання кишечника (ЗЗК) становлять значну медико-соціальну проблему, що обумовлює суттєвий інтерес до вивчення етіології, патогенезу, клінічних проявів патології, розробки діагностичних та лікувальних комплексів у всьому світі. ЗЗК, до яких відносяться неспецифічний виразковий коліт (НВК) та хвороба Крона (ХК), являють собою хронічні рецидивуючі запальні захворювання шлунково-кишкового тракту, які призводять до необоротних порушень його структури та функцій [1, 2]. Реєструється збільшення кількості хворих на ЗЗК, що характеризуються як системними проявами, так і поліморбідним перебігом. Проблема діагностики та лікування НВК та ХК у наш час залишається однією із найбільш серйозних і невирішених, найскладніших у гастроентерологічній практиці [3, 4].
Відомо, що в основі патогенезу ЗЗК є порушення імунної відповіді, яке призводить до розвитку неспецифічного запалення в стінках та слизовій оболонці кишки. Дія імунних комплексів та медіаторів запалення (цитокінів, гістаміну, активних форм кисню, NO) на клітини стінки кишечника сприяє її пошкодженню та деструкції тканини [4–6].
Особливу увагу приділяють вивченню кишкового мікробіому у пацієнтів із ЗЗК. До факторів, що сприяють нормальному функціонуванню мікробіому кишечника, відноситься система tоll-подібних рецепторів (TLRs 1–13), що відповідають за розпізнавання компонентів клітинної стінки бактерій, активацію каскаду прозапальних цитокінів та інтерлейкінів, формування колонізаційної резистентності і бактеріальну транслокацію. Підвищена експресія TLRs сприяє активації цитокінів та інтерлейкінів, надлишковій продукції TNF-α, ІL-1β, ІL-6, ІL-8 [7]. Зміни мікробіоценозу кишечника можуть індукувати порушення ключових ланок патогенезу ЗЗК: місцевої та системної імунної відповіді, стану слизового бар’єра кишечника, особливостей його проникності, морфологічної структури [1, 2, 8]. Так, у нормі шар слизу на поверхні епітелію утворює бар’єр, у якому гомеостатичні імунні реакції підтримують як цілісність слизової оболонки кишечника, так і життєдіяльність коменсальних мікроорганізмів, які колонізують кишечник і виконують симбіотичні функції. Однак при ушкодженні слизового бар’єра під впливом медіаторів запалення, патогенних мікроорганізмів або будь-яких агентів, які провокують інтенсивні імунні реакції, відбувається активація запального процесу, що змінює кишкове середовище та створює умови для розвитку патогенних штамів кишкової мікрофлори [9–11]. Кількість бактерій, які ферментують волокна і продукують коротколанцюгові жирні кислоти (КЖК), зазвичай менше в слизовій оболонці і калі пацієнтів із ЗЗК порівняно зі здоровими людьми. КЖК, такі як ацетат, пропіонат і бутират, є важливими метаболітами для підтримки гомеостазу кишечника. Недавні відкриття показують, що КЖК, зокрема бутират, також мають важливі імуномодулюючі функції [9].
КЖК є найяскравішим прикладом участі мікробіоти в метаболічних процесах хазяїна та впливу на імунітет. КЖК не перетравлюються в кишечнику за допомогою глікозидази разом з глікозилтрансферазами, які залучені в процеси синтезу та руйнування глікозидних зв’язків. Безумовно, рівень КЖК впливає на вміст показників імунного статусу. Масляна кислота (бутират) посилює регенерацію і знижує проліферацію кишкового епітелію та модифікує продукцію цитокінів Th-клітинами і зміцнює щільність міжклітинних з’єднань, що, у свою чергу, перешкоджає проникненню мікрофлори і запобігає аберантним запальним відповідям. Продукція уксусної кислоти (ацетат) справляє протизапальний ефект завдяки впливу на рецептор GPR43 [4]. Встановлено роль ацетату в посиленні бар’єрних функцій епітелію. КЖК можуть регулювати ацетилювання лізинових залишків — ковалентну модифікацію білків, залучених у різні сигнальні та метаболічні процеси. Було доведено, що гіпоксичне пошкодження слизової ШКТ призводить до переміщення ендотоксинів і бактерій у мезентеріальні лімфатичні вузли, а потім у кровоносні судини. Транслокація ендотоксину може грубо пошкоджувати фізіологічні процеси. На додаток до бактерій та ендотоксинів пошкодження кишечника може призвести до активації нейтрофілів і викиду медіаторів системного запалення — цитокінів, ейкозаноїдів тощо, що призводить до розладів органної перфузії та дисфункції кишечника [12].
У наш час у хворих на НВК та ХК відмічають виражені зміни цитокінової регуляції із підвищенням запальних цитокінів, перш за все TNF-α, а також інтерлейкінів-1, -6, -8, -12 при зниженні протизапальних інтерлейкінів-4, -10, -11. Як відомо, у нормальних фізіологічних умовах TNF-α є імунорегуляторним медіатором та забезпечує ріст, проліферацію, диференціацію різних типів клітин, активує нейтрофіли, Т- і В-лімфоцити, лізує пухлинні та інфіковані бактеріями і вірусами клітини, бере участь в апоптозі. У патологічних умовах TNF-α є активним прозапальним агентом. При запаленні він стимулює Th1-хелпери та макрофаги, індукує системні реакції гострої фази з підвищеним синтезом прозапальних цитокінів. TNF-α є одним з найбільш активних прозапальних цитокінів та вважається ключовим у патогенезі ЗЗК [13, 14]. Було встановлено, що рівень TNF-α у сироватці крові корелює із тяжкістю перебігу ЗЗК [13] та активністю НВК [15].
IL-10 — протизапальний цитокін, який секретується різними клітинами, включаючи дендритні клітини, еозинофіли, тучні клітини, макрофаги, В-клітини, CD4+ Т-клітини (у тому числі клітини Th2, Th1, Th17 і Treg). IL-10 підтримує гомеостаз шляхом зниження надмірної прозапальної відповіді і справляє свій ефект через зв’язування з рецептором IL-10, IL-10R, який являє собою тетрамерний комплекс. Дефекти IL-10 пов’язані із запаленням кишечника [16].
Дослідження останніх років спрямовані на вивчення ролі гуморального імунітету у патогенезі ЗЗК [16, 17]. Дефекти в розвитку В-клітин призводять до відсутності циркулюючих зрілих В-клітин і продукції антитіл, що пов’язані з ЗЗК. Навіть при легкому імунодефіциті, такому як дефіцит імуноглобуліну А (IgA), частота ЗЗК значно вища, ніж у населення в цілому [16].
Підвищена інфільтрація плазматичних клітин слизової оболонки і підвищені рівні імуноглобуліну G (IgG) у слизовій оболонці кишечника спостерігаються як у пацієнтів з ХК, так і у пацієнтів з НВК. Крім того, високі рівні IgG слизової оболонки, спрямовані проти коменсальних бактеріальних антигенів з просвіту кишечника [18], є переконливим доказом мікробно-слизової взаємодії в патогенезі ЗЗК [19].
Мета роботи: оцінити стан гуморальної ланки імунітету, цитокінової регуляції та вміст коротколанцюгових жирних кислот у калі хворих із запальними захворюваннями кишечника.
Матеріали та методи
Проведено обстеження 34 хворих на ЗЗК, які знаходилися на лікуванні у відділенні захворювань кишечника ДУ «Інститут гастроентерології НАМН України». Усі хворі були розділені на дві групи: І група — 25 хворих на НВК та ІІ група — 9 хворих на ХК. Крім того, хворі на НВК були поділені на групи залежно від тяжкості перебігу: легкий ступінь НВК — 3 пацієнти, НВК середнього ступеня — 18 пацієнтів, 4 пацієнти — НВК тяжкого ступеня. Контрольну групу становили 15 практично здорових людей (донорів).
Діагнози ХК та НВК були встановлені згідно із загальноприйнятими стандартами діагностики в гастроентерології. Ступінь тяжкості захворювання визначали з огляду на клінічні дані, результати лабораторного, рентгенологічного, ендоскопічного досліджень та морфологічного дослідження біоптатів слизової оболонки кишечника.
Подані для публікації матеріали не заперечують положенням біоетики.
Матеріалом для дослідження імунологічних показників служила венозна кров, яку забирали з ліктьової вени в об’ємі 10 мл уранці натщесерце. Мононуклеарні клітини виділяли із периферичної венозної крові пацієнтів у градієнті щільності 1,077 г/см. Рівень В-лімфоцитів визначали за допомогою моноклональних антитіл фірми «Сорбент ТМ» до молекул СD22. Циркулюючи імунні комплекси (ЦІК) визначали за методом V. Haskova.
Визначення кількісного вмісту імуноглобулінів (Ig) класів А, М, G у сироватці крові проводили методом кількісного імуноферментного аналізу (ІФА) за допомогою тест-систем ТОВ НВЛ «Гранум» (м. Харків) за рекомендаціями виробника. Рівень ІL-10, TNF-α в сироватці крові визначали ІФА з наборами реактивів фірми «Вектор-БЕСТ», Росія.
ІФА виконували за допомогою імуноферментного аналізатора «Stat Fax 303 Plus» (США), на якому проводили вимірювання оптичної щільності при довжині хвилі 450 та 630 нм.
Визначення КЖК у калі проводили за допомогою апаратно-програмного комплексу для медичних досліджень, з використанням газового хроматографа «Хроматек-Кристал 5000» згідно з методом [20], який детально описаний раніше.
Для оптимізації математичної обробки результати вводили в базу даних, що побудована за допомогою електронних таблиць Microsoft Excel. Статистичне опрацювання результатів виконали за допомогою пакета прикладних програм Statistica 6.1 (серійний номер AGAR909 E415822FA). Для статистичного аналізу даних використовували дескриптивну статистику: М — середнє значення показника, m — помилка визначення середнього, порівняння середніх значень змінних здійснювали за допомогою параметричного методу (t-критерію Стьюдента) за нормального розподілу даних ознак, що виражені в інтервальній шкалі. Відповідність виду розподілу ознак закону нормального розподілу перевіряли за допомогою методу Шапіро — Уїлка. В інших випадках використовували непараметричний метод (U-критерій Манна — Уїтні). Різниця середніх значень показників вважалася вірогідною при р < 0,05. Вираженість взаємозв’язків між змінними оцінювали за допомогою значущих коефіцієнтів кореляції Спірмена (r).
Результати та обговорення
У хворих на ХК встановлено вірогідне підвищення вмісту лейкоцитів, тоді як у хворих на НВК це підвищення було невірогідне (табл. 1). При оцінці стану показників гуморального імунітету у хворих на ЗЗК у 20,0 % хворих на НВК та у 33,3 % хворих на ХК встановлено зниження відносної кількості В-лімфоцитів, у решти хворих їх кількість була у межах норми.
/48.jpg)
У хворих на НВК на фоні збереження нормальної кількості В-лімфоцитів встановлено вірогідне зниження кількості IgМ (у 2,0 раза, р < 0,05) та IgG (у 1,5 раза, р < 0,05). У групі хворих на ХК вірогідно знижено рівень IgА (у 1,4 раза, р < 0,05), IgМ (у 2,1 раза, р < 0,05) та IgG (у 1,4 раза, р < 0,05) порівняно із контрольною групою, що вказує на зниження гуморальної ланки імунітету. Не встановлено статистично значимої різниці між рівнем IgА, IgМ та IgG у хворих на НВК та ХК. Тоді як концентрація IgG4 у групі хворих на НВК була вірогідно вищою в 2,8 раза (р < 0,05) та в 2,7 раза (р < 0,05) порівняно із його рівнем у групі контролю та у хворих на ХК відповідно.
Уміст ЦІК у досліджених хворих на ЗЗК коливався від 0,8 до 10,2 од.опт.щ. Середні показники становили (4,11 ± 0,66) од.опт.щ. у хворих на НВК і (3,20 ± 0,89) од.опт.щ. у хворих на ХК (табл. 1). Статистично значимої різниці між рівнем ЦІК у хворих на НВК та ХК не встановлено.
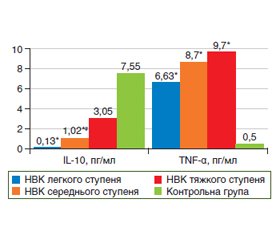
Під час роботи було вивчено рівень прозапальних та протизапальних цитокінів у хворих на ЗЗК (рис. 1). Концентрація TNF-α у хворих на НВК та ХК була вірогідно вищою в 16,8 раза (р < 0,05) та в 23,0 раза (р < 0,05) відповідно порівняно з контрольною групою. Тоді як медіана рівня ІL-10 у хворих на НВК та ХК вірогідно знижена (в 6,1 раза, р < 0,05) порівняно із групою контролю. У результаті визначення співвідношення прозапальних та протизапальних цитокінів (TNF-α/ІL-10) було встановлено зміни їх балансу в бік прозапальних цитокінів у хворих на ЗЗК порівняно із групою контролю. Ці зміни найбільш виражені у хворих на НВК. У хворих на ЗЗК порушення співвідношення TNF-α/ІL-10 у бік прозапальних цитокінів пов’язане із посиленням запалення.
Метод газової хроматографії з визначенням абсолютного та відносного вмісту КЖК у копрофільтраті дозволяє досить швидко та неінвазивно оцінити кількісні складові та метаболічну активність мікрофлори кишечника.
Для більш детального вивчення порушень у мікробіоценозі кишечника у пацієнтів із ЗЗК ми досліджували вміст КЖК С2-С4 у калі. Як у групі із ЗЗК, так і у групах з НВК та ХК спостерігались різноспрямовані зміни метаболічної активності мікрофлори, що проявлялось змінами як сумарного загального вмісту, так і показників окремих КЖК щодо здорових осіб (табл. 2). Виявлено, що рівень оцтової кислоти (С2) вірогідно знижувався в групі хворих із ЗЗК в 15,4 раза, у групі НВК — у 14,3 раза та в групі ХК — у 11,0 раза (р < 0,001) щодо контролю (табл. 2).
/49_2.jpg)
Аналіз вмісту КЖК у копрофільтраті у пацієнтів із ЗЗК вказував на вірогідне підвищення пропіонової кислоти (СЗ), що спостерігалося у пацієнтів як з НВК, так і ХК, в 1,7 раза до (0,0080 ± 0,0001) мкг/мкл та в 2,8 раза до (0,013 ± 0,001) мкг/мкл (р < 0,001) відповідно, що може вказувати на порушення мікроциркуляції в слизовій кишечника та уповільнення метаболічних процесів, тому що пропіонова жирна кислота є регулятором метаболічних процесів ліпідного обміну.
Виявлено зниження масляної кислоти (С4) у пацієнтів з НВК у 2 рази до (0,039 ± 0,008) мкг/мкл та у пацієнтів з ХК в 1,7 раза до (0,046 ± 0,001) мкг/мкл (р < 0,001) порівняно з контролем — (0,08 ± 0,001) мкг/мкл (табл. 2).
При визначенні показників анаеробного індексу (АІ) було встановлено, що у контролі він дорівнював 0,735 ± 0,018 мг/мл, його підвищення спостерігалось в 6,5 раза в загальній групі хворих із ЗЗК до (4,81 ± 0,99), р < 0,001, у 7 разів у групі пацієнтів з НВК до (5,23 ± 0,98), у 4,9 раза у групі хворих на ХК — до (3,61 ± 0,70), р < 0,01 (табл. 2).
Проведено аналіз показників залежно від тяжкості перебігу НВК (табл. 3). У хворих на НВК легкого ступеня нами встановлено підвищення рівня В-клітин в 1,2 раза (р > 0,05), тоді як рівень IgA та IgG вірогідно не відрізнявся від норми. Рівень IgМ знижувався із зростанням тяжкості НВК: у 1,9 раза (р < 0,05) у хворих на НВК легкого ступеня, у 2,0 раза (р < 0,05) у хворих на НВК середнього ступеня та в 2,2 раза (р < 0,05) у хворих на НВК тяжкого ступеня. Уміст IgG у сироватці крові у хворих на НВК середнього ступеня та у хворих на НВК тяжкого ступеня був вірогідно нижчим в 1,6 раза (р < 0,05) щодо контрольної групи.
Підвищення рівня ЦІК у сироватці крові ми спостерігали у 66,7 % хворих з легким ступенем та у всіх хворих з тяжким ступенем перебігу НВК.
Крім того, встановлена тенденція до збільшення рівня TNF-α із збільшенням ступеня тяжкості перебігу НВК (рис. 2). Рівень TNF-α зростав із тяжкістю НВК: був вірогідно вищий у хворих на НВК легкого ступеня (у 13,3 раза, р < 0,05), у хворих на НВК середнього ступеня (у 17,4 раза, р < 0,05) та у хворих на НВК тяжкого ступеня (у 19,4 раза, р < 0,05) порівняно із його рівнем у групі контролю.
/50.jpg)
Аналіз отриманих даних пацієнтів з НВК залежно від ступеня тяжкості захворювання (табл. 4) показав, що рівень оцтової кислоти (С2) вірогідно знижувався в групі НВК легкого ступеня в 15,4 раза, у групі НВК середнього ступеня тяжкості — у 14,3 раза та в групі НВК тяжкого ступеня — у 16,6 раза (р < 0,001) щодо контрольної групи. Це вказувало на виражене пригнічення продуцентів цього метаболіту (більшість анаеробних популяцій E. сoli), можливо, за рахунок дисбіозу кишечника у цих хворих. Виявлено підвищення загального вмісту КЖК у копрофільтраті за рахунок підвищення вмісту пропіонової кислоти. Уміст пропіонової кислоти (СЗ) в усіх групах мав тенденцію до підвищення щодо норми (р > 0,05). Також були вірогідно знижені показники масляної кислоти (С4), яка є енергосубстратом для епітеліоцитів товстої кишки, у 2 рази в групах пацієнтів з НВК легкого та середнього ступеня тяжкості. При цьому її концентрація в групі пацієнтів з НВК тяжкого ступеня була суттєво вірогідно знижена в 2,8 раза щодо здорових осіб (р < 0,01).
Залежно від ступеня тяжкості НВК у пацієнтів реєструвалися також підвищені значення АІ: у пацієнтів з НВК легкого ступеня — у 6 разів, середнього ступеня тяжкості — у 5,3 раза, тяжкого ступеня — у 3,7 раза порівняно з контролем (табл. 4).
Було визначено, що у хворих із ЗЗК залежно від нозології та ступеня тяжкості захворювання процес утворення, всмоктування і утилізації КЖК порушувався, тому вміст і особливо співвідношення окремих КЖК у копрофільтраті змінювались. Отже, різноспрямовані відхилення від фізіологічної норми рівнів цих метаболітів можуть служити біохімічними маркерами структурних і функціональних порушень кишкового мікробіоценозу.
КЖК мають протизапальний вплив на слизову кишечника, проте слід зазначити, що в деяких ситуаціях був показаний прозапальний ефект КЖК. Поясненням цього факту є здатність КЖК посилювати міграцію лейкоцитів. В умовах анаеробної бактеріальної інфекції та порушення цілісності кишкового епітелію підвищена концентрація КЖК може призводити до надмірної акумуляції нейтрофілів та посилення запального процесу. У різних умовах КЖК можуть мати різноспрямовану дію на кишковий епітелій: прозапальну або протизапальну [2, 19].
З огляду на вищенаведене визначення вмісту КЖК у копрофільтраті пацієнтів із ЗЗК має важливе діагностичне і прогностичне значення.
Отже, нами встановлено, що у хворих на НВК збільшення ступеня тяжкості перебігу хвороби супроводжується зниженням гуморальної ланки імунітету та зростанням рівня TNF-α. Підвищений рівень прозапальних цитокінів (TNF-α) у крові хворих на ЗЗК не індукував секрецію протизапальних цитокінів (ІL-10), що призводить до надмірної активації макрофагів, підтримки запального процесу та прогресування хвороби. Найвищі показники TNF-α свідчать про значні зміни системи імунної відповіді при ЗЗК, тому що відомо, що ступінь підвищення вмісту даного цитокіну в сироватці крові корелює з тяжкістю перебігу захворювання [13, 15].
У нашому дослідженні встановлений зв’язок між рівнем показників гуморальної ланки імунітету, цитокінової регуляції та вмістом КЖК у калі, що може вказувати на участь метаболітів кишечника в активації імунітету людини. Так, проведений кореляційний аналіз дозволив встановити у хворих на ЗЗК зв’язок рівня ЦІК із вмістом TNF-α (r = 0,405; р = 0,024), оцтовою кислотою (С2) (r = –0,437; р = 0,014), масляною кислотою (С4) (r = –0,357; р = 0,048) та ∑С2-С4 (r = 0,381; р = 0,034), виявлена асоціація підвищеного рівня СD22+ лімфоцитів із АІ (r = 0,358; р = 0,038).
Висновки
1. Встановлено зниження гуморальної ланки імунітету, про що свідчив вірогідно знижений рівень IgА (у 1,4 раза, р < 0,05), IgМ (у 2,1 раза, р < 0,05) та IgG (у 1,4 раза, р < 0,05) та кількості IgМ (у 2,0 раза, р < 0,05) та IgG (у 1,5 раза, р < 0,05) у хворих на ХК порівняно із контрольною групою. Визначено вірогідне підвищення вмісту TNF-α у хворих на НВК (у 16,8 раза, р < 0,05) та ХК (у 23,0 раза, р < 0,05) порівняно з контрольною групою. Виявлені зміни супроводжувалися підвищенням вмісту пропіонової (С3) кислоти (р < 0,001) та зниженням оцтової (С2) (р < 0,001) і масляної (С4) (р < 0,001) кислот у копрофільтраті хворих на ЗЗК.
2. Рівень TNF-α був вірогідно вищий у хворих на НВК легкого ступеня (у 13,3 раза, р < 0,05), у хворих на НВК середнього ступеня (у 17,4 раза, р < 0,05) та у хворих на НВК тяжкого ступеня (у 19,4 раза, р < 0,05) порівняно із його рівнем у групі контролю; встановлено, що в групі пацієнтів з НВК тяжкого ступеня відбувалося суттєве зниження вмісту масляної кислоти (С4) в 2,8 раза щодо контрольної групи (р < 0,01).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Робота виконується відповідно до плану наукових досліджень відділу захворювань кишечника Державної установи «Інститут гастроентерології НАМН України». Усі пацієнти підписали інформовану згоду на участь у цьому дослідженні.
Внесок авторів у роботу над статтею. Степанов Ю.М. — концепція та дизайн дослідження, редагування тексту; Стойкевич М.В. — відбір пацієнтів, обробка клінічних даних; Кленіна І.А. — збір та обробка матеріалу, виконання біохімічних досліджень, статистична обробка, написання статті; Татарчук О.М. — збір та проведення імунологічних досліджень, статистична обробка та аналіз отриманих результатів.
Отримано/Received 28.04.2022
Рецензовано/Revised 10.05.2022
Прийнято до друку/Accepted 20.05.2022
/49.jpg)
/50.jpg)

/48.jpg)
/49_2.jpg)
/50_2.jpg)