Журнал "Гастроэнтерология" Том 56, №2, 2022
Вернуться к номеру
Морфологічні особливості слизової оболонки товстої кишки при неспецифічному виразковому коліті різних ступенів тяжкості
Авторы: Гайдар Ю.А., Стойкевич М.В., Милостива Д.Ф., Тарасова Т.С.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
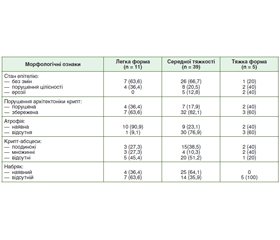
Актуальність. Хронічні запальні захворювання кишечника (ХЗЗК) — одна із самих складних нозологічних груп в гастроентерології, що обумовлено постійним зростанням їх поширення, зміщенням дебюту на більш ранній вік, підвищенням частоти тяжких ускладнених форм. Найбільш поширеним представником ХЗЗК є неспецифічний виразковий коліт (НВК). В основі НВК лежить дифузне виразково-запальне ураження товстої кишки. Провідна роль у діагностиці НВК належить зіставленню результатів ендоскопічного і морфологічного методів дослідження. Морфологічний метод дослідження колонобіоптатів при НВК є золотим стандартом діагностики та дає можливість визначити ознаки активності захворювання навіть за ендоскопічної ремісії. На відміну від описової гістології, патологічної анатомії кількісна морфологія доповнює та уточнює дані досліджень, які проводяться звичайними морфологічними методами з позицій узагальнюючих підходів. Мета кількісної морфології — максимальна об’єктивізація вивчення якісних та кількісних проявів патологічних процесів, нозологічних одиниць, їх патогенезу, морфогенезу, а також виключення похибок вимірювань та, наскільки це можливо, суб’єктивізму дослідника. Мета дослідження: провести порівняльне гістологічне та морфометричне дослідження біоптатів слизової оболонки товстої кишки у пацієнтів з НВК різних ступенів тяжкості перебігу захворювання. Матеріали та методи. Проведено гістологічне та морфометричне дослідження біоптатів слизової оболонки кишечника у 55 пацієнтів з НВК. Пацієнти були розподілені за ступенем тяжкості перебігу захворювання. І група (n = 11) — легкий ступінь тяжкості, ІІ група (n = 39) — середній ступінь тяжкості та ІІІ група (n = 5) — пацієнти з тяжким ступенем НВК. Результати. У 63,6 % при легкому ступені НВК набряк не відмічався, стан епітелію був без змін, архітектоніка не порушена. Крипт-абсцеси були виявлені в 54,6 % випадків, атрофічні зміни — у 90,9 %. Запальний інфільтрат у своєму складі мав переважно нейтрофіли ((176,0 ± 8,22) на 1 мм2 строми) та мононуклеари ((232,4 ± 22,83) на 1 мм2 строми), що вказує на активацію регенеративних функцій слизової оболонки. З морфометричних вимірів найвищим показником була висота епітелію крипт — (38,3 ± 1,49) мкм. При середньому ступені НВК у 33,3 % випадків було порушення цілісності епітелію, атрофічні зміни діагностували у 23,1 % випадків, порушення архітектоніки крипт — у 17,9 %, наявність крипт-абсцесів — у 48,8 %, набряк — у 64,1 %. При морфометричному вимірюванні біоптатів слизової оболонки кишечника при середньому ступені тяжкості НВК відмічались найвищі показники глибини крипт — (452,6 ± 8,12) мкм, висота епітелію крипт — (42,3 ± 0,33) мкм та кількість келихоподібних клітин — (26,6 ± 1,43). Висота епітелію крипт позитивно корелювала з кількістю келихоподібних клітин (r = 0,30; р < 0,05). У пацієнтів з тяжким ступенем НВК в 40 % відмічались як наявність ерозій, загальне порушення епітелію, крипт-абсцеси, так і атрофічні зміни. При тяжкому ступені НВК відмічалась найменша глибина крипт — (426,1 ± 22,37) мкм, висота епітелію крипт — (36,0 ± 2,57) мкм, кількість келихоподібних клітин — (10,5 ± 1,04) та найбільша товщина епітелію — (51,5 ± 2,81) мкм. Висновки. Наявність крипт-абсцесів в основному відмічалась у групі легкої та середньої форми захворювання. Набряк слизової частіше відмічався у групі з перебігом захворювання середньої тяжкості. Підвищена кількість еозинофілів та нейтрофілів відмічалась у групі з тяжкою формою захворювання.
Background. Chronic inflammatory bowel disease (CIBD) is one of the most complex nosological groups in gastroenterology, due to the constant increase in their prevalence, shifting the onset to an earlier age, increasing the frequency of severe complicated forms. The most common representative of CIBD is nonspecific ulcerative colitis (UC). At the heart of UC is a diffuse ulcerative-inflammatory lesion of the colon. The leading role in the diagnosis of UC belongs to the comparison of the results of endoscopic and morphological methods of research. The morphological method of colonobiopsy examination in UC is the gold standard of diagnosis and makes it possible to determine the signs of disease activity even in endoscopic remission. In contrast to descriptive histology, pathological anatomy, quantitative morphology complements and clarifies the data of studies conducted by conventional morphological methods from the standpoint of generalized approaches. The purpose of quantitative morphology is the maximum objectification of the study of qualitative and quantitative manifestations of pathological processes, nosological units, their pathogenesis, morphogenesis, as well as the exclusion of measurement errors and, as far as possible, the subjectivity of the researcher. The purpose of the study: to conduct a comparative histological examination of biopsies of the mucous membrane of the colon in patients with UC of different severity of the disease. Materials and methods. Histological examination of intestinal biopsy specimens was performed in 55 patients with ulcerative colitis. Patients were divided according to the severity of the disease. Group I (n = 11) — mild form, group II (n = 39) — moderate form and group III (n = 5) — patients with severe UC. Results. In 63.6 % with a mild severity of UC edema was not observed, the condition of the epithelium was unchanged, the architecture is not disturbed. Crypt abscesses were detected in 54.6 % of cases, atrophic changes — in 90.9 %. Inflammatory infiltrate consisted mainly of neutrophils ((176.0 ± 8.22) per 1 mm2 stroma) and mononuclear cells ((232.4 ± 22.83) per 1 mm2 stroma), which indicates the activation of regenerative functions of the mucous membrane. From morphometric measurements the highest indicator was the height of the crypt epithelium (38.3 ± 1.49) μm. With an moderate degree of UC in 33.3 % of cases there was a violation of the integrity of the epithelium, atrophic changes were diagnosed in 23.1 % of cases, violations of crypt architecture — in 17.9 %, the presence of crypt abscesses — 48.8 %, edema — 64.1 %. Morphometric measurement of intestinal mucosal biopsies with moderate severity of UC showed the highest crypt depth (452.6 ± 8.12) μm, crypt epithelial height (42.3 ± 0.33) μm and the number of goblet cells (26.6 ± 1.43). The height of the crypt epithelium was positively correlated with the number of goblet cells (r = 0.30; p < 0.05). Erosions, general epithelial disorders, crypt abscesses, and atrophic changes were observed in the majority of patients with severe UC in 40 %. In severe UC, the smallest crypt depth (426.1 ± 22.37) μm, crypt epithelial height (36.0 ± 2.57) μm, the number of goblet cells (10.5 ± 1.04) and the largest epithelial thickness were observed (51.5 ± 2.81) μm. Conclusions. The presence of crypt abscesses was mainly observed in the group of mild and moderate forms of the disease. Mucosal edema was more common in the group with moderate severity disease. Increased numbers of eosinophils and neutrophils were observed in the group with severety disease.
виразковий коліт; морфологічне дослідження; морфометрія
ulcerative colitis; morphological examination; morphometry
Вступ
Матеріали та методи
Власні дослідження
/40.jpg)
Висновки
- Peripheral Eosinophilia in Patients with Inflammatory Bowel Disease Defines an Aggressive Disease Phenotype / B. Click et al. Am J Gastroenterol. 2017. Vol. 112. Р. 1849-58. doi: 10.1038/ajg.2017.402
- Gordon I.O., Agrawal N., Willis E., Goldblum J.R., Lopez R., Allende D., Liu X. et al. Fibrosis in ulcerative colitis is directly linked to severity and chronicity of mucosal inflammation / I.O. Gordon et al. Aliment Pharmacol Ther. 2018. Vol. 47, № 7. Р. 922-939. doi: /10.1111/apt.14526.
- Kaplan G.G., Ng S.C. Understanding and Preventing the Global Increase of Inflammatory Bowel Disease. Gastroenterology. 2017. Vol. 152, № 2. Р. 313-321. doi: 10.1053/j.gastro.2016.10.020.
- González-Castro A.M., Martínez C., Salvo-Romero E. Mucosal pathobiology and molecular signature of epithelial barrier dysfunction in the small intestine in irritable bowel syndrome. J Gastroenterol Hepatol. 2017. Vol. 32. Р. 53-63. doi: 10.1111/jgh.13417.
- Windsor J.W., Kaplan G.G. Evolving Epidemiology of IBD. Curr Gastroenterol Rep. 2019. Vol. 21, № 8. Р. 40. doi: 1007/s11894-019-0705-6.
- Dmochowska N., Wardill H.R., Hughes P.A. Advances in Imaging Specific Mediators of Inflammatory Bowel Disease. International Journal of Molecular Sciences. 2018. Vol. 19, № 9. Р. 2471. doi: 10.3390/ijms19092471.
- Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies / S.C. Ng et al. Lancet. 2018. Vol. 390. Р. 2769-2778. doi: 10.1016/S0140-6736(17)32448-0.
- Yalchin M., Baker A.-M., Graham T.A., Hart А. Predicting Colorectal Cancer Occurrence in IBD. Cancers (Basel). 2021. Vol. 13, № 12. Р. 2908. doi: 10.3390/cancers13122908.
- Downregulated Eosinophil Activity in Ulcerative Colitis With Concomitant Primary Sclerosing Cholangitis / M. Lampinen et al. J Leukoc Biol. 2018. Vol. 104. P. 173-83. doi: 10.1002/JLB.3MA0517-175R
- Choi E.-Y.K., Appelman H.D. Chronic Colitis in Biopsy Samples: Is It Inflammatory Bowel Disease or Something Else? Surg Pathol Clin. 2017. Vol. 10, № 4. P. 841-861. doi: /10.1016/j.path.2017.07.005.
- Targeted mutational analysis of inflammatory bowel disease-associated colorectal cancers / L. Alpert et al. Hum Pathol. 2019. Vol. 89. P. 44-50. doi: 10.1016/j.humpath.2019.04.013.
- Prognostic Significance of Faecal Eosinophil Granule Proteins in Inflammatory Bowel Disease / K. Amcoff et al. Scand J Gastroenterol. 2019. Vol. 54. P. 1237-44. doi: 10.1080/00365521. 2019.1670251.
- Mao R., Rimola J., Chen M.-H., Rieder F. Intestinal fibrosis: The Achilles heel of inflammatory bowel diseases? J Dig Dis. 2020. Vol. 21, № 6. Р. 306-307. doi: 10.1111/1751-2980.12876.
- Sairenji T., Collins K.L., Evans D.V. An Update on Inflammatory Bowel Disease. Prim Care. 2017. Vol. 44, № 4. P. 673-692. doi: 0.1016/j.pop.2017.07.010.
- Henriksen M., Høivik M.L., Jelsness-Jørgensen L.-P., Moum B. Irritable Bowel-like Symptoms in Ulcerative Colitis are as Common in Patients in Deep Remission as in Inflammation: Results From a Population-based Study [the IBSEN Study]. J Crohns Colitis. 2018. Vol. 12, № 4. Р. 389-393. doi: 10.1093/ecco-jcc/jjx152.
- Meningeal lymphatic vessels regulate brain tumor drainage and immunity / X. Hu et al. Cell Res. 2020. Vol. 30, № 3. Р. 229-43. doi: 10.1038/s41422-020-0287-8.
- Filippone R.T., Sahakian L., Apostolopoulos V., Nurgali К. Eosinophils in Inflammatory Bowel Disease. Inflamm Bowel Dis. 2019. Vol. 25, № 7. Р. 1140-1151. doi: 10.1093/ibd/izz024.
- Exosome-mediated effects and applications in inflammatory bowel disease / D.K.W. Ocansey et al. Biol Rev. 2020. Vol. 95, № 5. Р. 1287-307. doi: 10.1111/brv.12608.
- Role of Eosinophils in Intestinal Inflammation and Fibrosis in Inflammatory Bowel Disease: An Overlooked Villain? / I. Jacobs et al. Front Immunol. 2021. Vol. 12. P. 754413. doi: 10.3389/fimmu.2021.754413.
- Snisarevsky P.P. Modern morphological diagnostics of ulcerative colitis and irritable bowel syndrome: histological, histochemical and immunohistochemical criteria. Wiad Lek. 2021. Vol. 74, № 3. Р. 381-387. doi: 10.36740/WLek202103101
- Histologic scoring indices for evaluation of disease activity in ulcerative colitis / M.H. Mosli et al. Cochrane Database Syst Rev. 2017. Vol. 5, № 5. P. 11256. doi: 10.1002/14651858.CD011256.
- Role of eosinophils in a murine model of inflammatory bowel disease / Z. Wang et al. Biochem Biophys Res Commun. 2019. Vol. 511, № 1. P. 99-104. doi: 10.1016/j.bbrc.2019.02.056.
- Cellular and molecular mediators of lymphangiogenesis in inflammatory bowel disease / D.K.W. Ocansey et al. J Transl Med. 2021. Vol. 19, № 1. P. 254. doi: 10.1186/s12967-021-02922-2.
- Emerging treatment options in inflammatory Bowel disease: Janus Kinases, stem cells, and more / B. Misselwitz et al. Digestion. 2020. Vol. 101. P. 69-82. doi: 10.1159/000507782.
- Mast cells, angiogenesis and lymphangiogenesis in human gastric cancer / G. Sammarco et al. Int J Mol Sci. 2019. Vol. 20. P. 2106. doi: 10.3390/ijms20092106

/41.jpg)
/41_2.jpg)
/41_3.jpg)
/42.jpg)
/42_2.jpg)