Журнал "Гастроэнтерология" Том 56, №2, 2022
Вернуться к номеру
Особливості слизового бар’єра при функціональних захворюваннях кишечника та неспецифічному виразковому коліті
Авторы: Дорофєєв А.Е. (1), Ткач С.М. (2), Дядик О.О. (1), Приходько В.М. (1)
(1) — Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(2) — Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Актуальність. Слизовий бар’єр кишечника може змінюватися через вплив екзогенних та ендогенних факторів. Зміни його фізичних та хімічних характеристик спостерігаються як при шлунково-кишкових захворюваннях, таких як синдром подразненого кишечника, неспецифічний виразковий коліт, хвороба Крона, так і при інших патологіях — цукровому діабеті, харчовій алергії, ревматоїдному артриті тощо. Також на проникність стінки кишечника впливають тісні контакти, які послаблюються через порушення дієти, психоемоційні чинники та хімічні агенти. Метою роботи була оцінка змін слизового бар’єра у пацієнтів з функціональними та запальними захворюваннями кишечника. Матеріали та методи. Було досліджено 270 пацієнтів з різними підтипами синдрому подразненого кишечника та 218 з неспецифічним виразковим колітом. Усім пацієнтам була проведена колоноскопія з подальшою морфологічною оцінкою біоптатів та проведенням імуногістохімічних досліджень з використанням маркерів клаудину-1 та -7, муцинів 1, 2, 3, 4, 5АС, трефоїлових факторів 1–3. Результати. У пацієнтів з функціональним ураженням кишечника спостерігалось зниження кількості клаудинів — білків щільних контактів. Клаудин-1 знижувався у пацієнтів із синдромом подразненого кишечника, асоційованим з діареєю, у той час як клаудин-7 — у пацієнтів із синдромом подразненого кишечника зі змішаною формою. При неспецифічному виразковому коліті спостерігалось зниження рівня експресії як секреторних, так і мембранозв’язуючих муцинів і при цьому збільшення виділення трефоїлових факторів, що вказує на порушення регуляції та зниження протективних властивостей слизу. Висновки. При функціональних та запальних захворюваннях кишечника порушення захисної функції слизової оболонки має різний патогенез, що може визначати різні підходи до лікування пацієнтів з такими патологіями.
Background. The intestinal mucosal barrier may change under the influence of exogenous and endogenous factors. Changes in its physical and chemical characteristics are observed in patients with gastrointestinal diseases, such as irritable bowel syndrome, ulcerative colitis, Crohn’s disease, and with other pathologies, such as diabetes mellitus, food allergies, rheumatoid arthritis, etc. Also, the permeability of the intestinal wall was influenced by tight junctions, which are weakened due to eating disorders, psycho-emotional factors, and chemical agents. The purpose of the study was evaluating of changes in the mucosal barrier in patients with functional and inflammatory bowel diseases. Materials and methods. 270 patients with different subtypes of irritable bowel syndrome and 218 patients with ulcerative colitis were examined. Colonoscopy followed by a morphological assessment of biopsy specimens and immunohistochemical studies using markers of claudin 1 and 7, mucins 1, 2, 3, 4, 5AC, and trefoil factors 1–3 was performed in all patients. Results. A decrease in the level of tight junction proteins called claudins was observed in patients with functional bowel disease. Patients with irritable bowel syndrome associated with diarrhea had a lower level of claudin-1 only, while patients with mixed form had also a lower level of claudin-7. A decrease in the level of both secretory and membrane-bound mucins and an increase in the level of the trefoil factors were observed at the same time among the patients with ulcerative colitis which may indicate a dysregulation and a violation of the protective function of mucus. Conclusions. The pathogenesis of a violation of the protective function of the mucosa of functional and inflammatory bowel disease is different, which may determine approaches to the treatment of patients with such pathologies.
слизовий бар’єр кишечника; функціональні захворювання кишечника; синдром подразненого кишечника; неспецифічний виразковий коліт
mucosal barrier of the bowel; functional bowel disease; irritable bowel syndrome; nonspecific ulcerative colitis
Вступ
Матеріали та методи
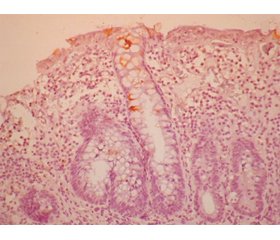
Результати та обговорення
/34_2.jpg)
/35.jpg)
Висновки
- Colonic immune cells in irritable bowel syndrome: A systematic review and meta-analysis / M. Bashashati et al. Neurogastroenterol Motil. 2018 Jan. № 30(1). doi: 10.1111/nmo.13192. Epub 2017 Aug 29. PMID: 28851005.
- Pharmacological, Pharmacokinetic, and Pharmacogenomic Aspects of Functional Gastrointestinal Disorders / M. Camilleri et al. Gastroenterology. 2016. № 150. Р. 1319-1331.
- Leech B., Schloss J., Steel A. Treatment Interventions for the Management of Intestinal Permeability: A Cross-Sectional Survey of Complementary and Integrative Medicine Practitioners. J Altern Complement Med. 2019 Jun. № 25(6). Р. 623-636. doi: 10.1089/acm.2018.0374. Epub 2019 Apr 29. PMID: 31038350.
- Farré R., Vicario M. Abnormal Barrier Function in Gastrointestinal Disorders. Handb Exp Pharmacol. 2017. № 239. Р. 193-217. doi: 10.1007/164_2016_107. PMID: 27995392.
- Zihni С., Mills C., Matter K., Balda M. Tight junctions: from simple barriers to multifunctional molecular gates. Nature reviews. Molecular Cell Biology. 2016. № 17(9). Р. 564-580.
- High-fat Diet Accelerates Intestinal Tumorigenesis Through Disrupting Intestinal Cell Membrane Integrity / M.Y. Park et al. Journal of Cancer Prevention. 2016. № 21(2). P. 95-103.
- Simrén M., Tack J. New treatments and therapeutic targets for IBS and other functional bowel disorders. Nature reviews. Gastroenterology & Hepatology. 2018. № 15(10). Р. 589-605. doi: 10.1038/s41575-018-0034-5. PMID: 29930260.
- Enck P., Mazurak N. Dysbiosis in Functional Bowel Disorders. Annals of Nutrition & Metabolism. 2018. № 72(4). Р. 296-306. doi: 10.1159/000488773.
- Sheehan G.M., Kallakury B.V., Sheehan C.E. Loss of claudin-1 and -7 and expression of claudin-3 and -4 correlate with prognostic variables in prostatic adenocarcinomas. Human Pathology. 2007. № 38(4). Р. 564-569. doi: 10.1016/j.humpath.2006.11.007.
- Tsukita S., Tanaka H., Tamura A. The Claudins: From Tight Junctions to Biological Systems. Trends in Biochemical Sciences. 2019. № 44(2). Р. 141-152. doi: 10.1016/j.tibs.2018.09.008.
- Suzuki T. Regulation of the intestinal barrier by nutrients: The role of tight junctions. Animal Science Journal = Nihon Chikusan Gakkaiho. 2020. № 91(1). Р. e13357. doi: 10.1111/asj.13357.
- Citi S. The mechanobiology of tight junctions. Biophysical Reviews. 2019. № 11(5). Р. 783-793. doi: 10.1007/s12551-019-00582-7.
- Mast cells are increased in the small intestinal mucosa of patients with irritable bowel syndrome: A systematic review and meta-analysis / A. Robles et al. Neurogastroenterology and Motility: the official journal of the European Gastrointestinal Motility Society. 2019. № 31(12). Р. e13718. doi: 10.1111/nmo.13718.
- The Relationship between Mucins and Ulcerative Colitis: A Systematic Review / E. Bankole et al. Journal of Clinical Medicine. 2021 Apr 30. № 10(9). 1935. doi: 10.3390/jcm10091935.
- Stool and urine trefoil factor 3 levels: associations with symptoms, intestinal permeability, and microbial diversity in irritable bowel syndrome / M. Heitkemper et al. Beneficial Microbes. 2018. № 9(3). Р. 345-355.
- Receptor activator of nuclear factor kB ligand, osteoprotegerin, and risk of death following a breast cancer diagnosis: results from the EPIC cohort / D. Sarink et al. BMC Cancer. 2018. № 18(1). P. 1010. doi: 10.1186/s12885-018-4887-3.

/33.jpg)
/34.jpg)
/34_3.jpg)
/35_2.jpg)