Журнал "Гастроэнтерология" Том 56, №2, 2022
Вернуться к номеру
Аналіз стану калікреїн-кінінової системи при коморбідному перебігу хронічного панкреатиту і цукрового діабету 2 типу
Авторы: Бабінець Л.С., Галабіцька І.М.
Тернопільський національний університет імені І.Я. Горбачевського МОЗ України, м. Тернопіль, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
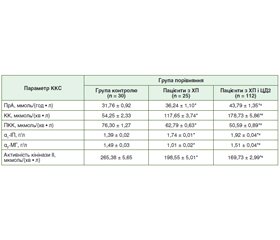
Актуальність. За доказовими даними, у межах приблизно 8 років у 50 % пацієнтів із хронічним панкреатитом (ХП) розвивається ендокринна й екзокринна недостатність, що проявляється як стеаторея, втрата ваги, цукровий діабет (ЦД) і нутритивні розлади. ЦД посилює ці явища, що поглиблює розлад обмінних процесів при ХП, у тому числі і білкового обміну. До білкових структур належать компоненти калікреїн-кінінової системи (ККС), яка відіграє роль у регуляції судинного тонусу, діурезу, запалення, коагуляції та рецепції болю. Унаслідок неодноразових загострень панкреатиту відбувається фіброзування підшлункової залози, збільшується ризик виникнення інсулінорезистентності і формування ЦД 2 типу (ЦД2). Таким чином, порушення калікреїн-кінінової системи і прогресування ХП взаємопов’язані, що робить актуальним вивчення стану ККС при ХП, особливо у поєднанні із ЦД2. Мета: дослідити стан калікреїн-кінінової системи при хронічному панкреатиті в амбулаторних пацієнтів залежно від наявності супутнього цукрового діабету 2 типу. Матеріали та методи. Було досліджено 137 амбулаторних пацієнтів із ХП та супутнім ЦД2 або без нього: основна група — 112 хворих із ХП поза загостренням у поєднанні із ЦД2 у стані повної чи субкомпенсації, група порівняння — 25 хворих на ізольований ХП. Оцінку показників загального і специфічного протеолізу (α1-інгібітор протеїназ, α2-макроглобулін, калікреїн, активність кінінази ІІ, прекалікреїн, протеолітична активність плазми) проводили за методом імуноферментного аналізу за допомогою стандартних наборів фірми BIOSERV ELISA. Результати. Було виявлено підвищення на 20,8 % рівня загальної протеолітичної активності плазми у групі пацієнтів з коморбідністю ХП та ЦД2 порівняно з групою з ізольованим ХП, підвищення специфічного протеолізу (або кініногенезу) на 51,9 % — за рівнем калікреїну (ферменту протеолізу), p < 0,05. Одночасно встановили зниження прекалікреїну (неактивного попередника калікреїну) у групі пацієнтів із коморбідністю на 19,4 % щодо такого при ізольованому ХП (p < 0,05); збільшення на 9,4 % вмісту α1-інгібітора протеїназ при коморбідності ХП і ЦД2 щодо такого при ізольованому ХП; зниження вмісту α2-макроглобуліну при ХП щодо групи контролю (p < 0,05), у той же час встановили підвищення вмісту α2-макроглобуліну при коморбідності ХП із ЦД2 на 49,5 % щодо ізольованого ХП; зниження активності кінінази ІІ при ХП і ЦД2 на 14,5 % щодо такої при ХП. Висновки. Було відмічено активацію ККС із різноспрямованими змінами її параметрів і загального та специфічного протеолізу при ХП. При ХП і при його коморбідному перебігу з ЦД2 відбувалась подальша активація протеолізу з одночасним включенням захисних механізмів розрішення запалення і дезінтоксикації. Доведено надмірну продукцію кінінів при супутньому ЦД2, що ослабляло захисну реакцію організму.
Background. According to evidence, within approximately 8 years, 50 % of patients with chronic pancreatitis (CP) develop endocrine and exocrine insufficiency, which manifests itself as steatorrhea, weight loss, diabetes mellitus (DM), and nutritional disorders. Diabetes mellitus aggravates these phenomena, which deepens the disorder of metabolic processes in CP, including protein metabolism. Protein structures include components of the kallikrein-kinin system (KKS), which plays a role in the regulation of vascular tone, diuresis, inflammation, coagulation, and pain reception. Due to repeated exacerbations of pancreatitis, there is fibrosis of the pancreas, which increases the risk of insulin resistance and the formation of type 2 diabetes. Thus, disorders of the kallikrein-kinin system and the progression of CP are interrelated, which makes it important to study the state of KKS in CP, especially in combination with type 2 diabetes mellitus. The purpose is to investigate the state of the kallikrein-kinin system in chronic pancreatitis in outpatients, depending on the presence of concomitant type 2 diabetes. Material and methods. 137 outpatients with CP with concomitant diabetes mellitus and without diabetes were studied: the main group — 112 patients with CP without exacerbation in combination with diabetes mellitus in a state of complete or subcompensation, and the comparison group — 25 patients with isolated CP. Evaluation of general and specific proteolysis (α1-proteinase inhibitor, α2-macroglobulin, kallikrein, kininase II activity, prekallikrein, plasma proteolytic activity) was performed by the method analysis using standard kits from BIOSERV ELISA. Results. There was a 20.8 % increase in the level of the total proteolytic activity of plasma in the group of patients with comorbidity of CP and diabetes mellitus compared with the group with isolated CP, 51.9 % increase in specific proteolysis (or kininogenesis) — the level of kallikrein (proteolysis enzyme), p < 0.05. At the same time, a decrease in prekallikrein (inactive precursor of kallikrein) was found in the group of patients with comorbidity by 19.4 % compared to that in isolated CP (p < 0.05). The presence of dissociation of protective parameters of kallikrein-kinin system is proved; increase by 9.4 % of α1-proteinase inhibitor content at comorbidity of CP and DM2 in relation to that in isolated CP; decrease in the content of α2-macroglobulin in CP relative to the control group (p < 0.05), which showed a decrease in the body’s compensatory capacity in CP, at the same time found an increase in α2-macroglobulin in the comorbidity of CP with DM2 by 49.5 % relative to isolated CP; reduction of kininase-II activity in CP and diabetes mellitus by 14.5 % relative to that in CP. Conclusions. Activation of KKS with multidirectional changes in KKS parameters and general and specific proteolysis in CP was noted. In CP and in the comorbid course with diabetes mellitus, further activation of proteolysis took place with the simultaneous inclusion of protective mechanisms for resolving inflammation and detoxification. Excessive production of kinins in concomitant DM2 has been proven, which weakened the body’s protective response.
хронічний панкреатит; цукровий діабет 2 типу; калікреїн-кінінова система; протеолітична активність плазми; α2-макроглобулін
chronic pancreatitis; type 2 diabetes mellitus; kallikrein-kinin system; the proteolytic activity of plasma; α2-macroglobulin
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Redkva O.V., Babinets L.S., Halabitska I.M. Evaluation of parameters of actual typical pathogenetic syndromes in comorbidity of type 2 diabetes mellitus and chronic pancreatitis. Wiad Lek. 2021. Vol. 74(10 cz 2). P. 2557-2559. doi: 10.36740/wlek202110204.
- The influence of exocrine pancreatic insufficiency in the formation of osteopenia in patients with primary osteoarthritis / L.S. Babinets et al. Wiad Lek. 2020. Vol. 73(10). P. 2238-2240. doi: 10.36740/WLek202010125.
- Babinets L.S., Shevchenko N.A., Sasyk H.M., Zemlyak O.S. Research of lipid exchange diffusion of medium-age patients with chronic pancreatitis with diabetes mellitus. Journal of Education, Health and Sport formerly journal of Health Sciences. 2017. Vol. 7(11). P. 309-318. doi: 10.5281/zenodo.1136094.
- Patient and disease characteristics associated with the presence of diabetes mellitus in adults with chronic pancreatitis in the United States / M.D. Bellin et al. Am J Gastroenterol. 2017. Vol. 112(9). P. 1457-65. doi: 10.1038/ajg.2017.181.
- A Spanish multicenter study to estimate the prevalence and incidence of chronic pancreatitis and its complications / J.E. Dominguez-Munoz et al. Rev Esp Enferm Dig. 2014 Apr. Vol. 106(4). P. 239-45. doi: 10.17235/reed.2016.4056/2015.
- Levy P., Dominguez-Munoz E., Imrie C., Lohr M., Maisonneuve P. Epidemiology of chronic pancreatitis: burden of the disease and consequences. United European Gastroenterol J. 2014 Oct. Vol. 2(5). P. 345-54. doi: 10.1177/2050640614548208.
- Lew D., Afghani E., Pandol S. Chronic pancreatitis: current status and challenges for prevention and treatment. Dig Dis Sci. 2017 Jul. Vol. 62(7). P. 1702-1712. doi: 10.1007/sl0620- 017-4602-2.
- Melitas C., Meiselman M. Metabolic pancreatitis: pancreatic steatosis, hypertriglyceridemia, and associated chronic pancreatitis in 3 patients with metabolic syndrome. Case Rep Gastroenterol. 2018 Jun 25. Vol. 12(2). P. 331-336. doi: 10.1159/000490042.
- Determinants of glucose control in patients with chronic pancreatitis / H. Schrader et al. Diabetologia. 2019. P. 43-47. doi: 10.1007/s00125-010-1705-0.
- Whitcomb D.C. Primer on precision medicine for complex chronic disorders. Clin Trans Gastroenterol. 2019. Vol. 10(7). P. e00067. doi: 10.14309/ctg.0000000000000067.
- Yang D., Forsmark C.E. Chronic pancreatitis. Curr Opin Gastroenterol. 2017 Sep. Vol. 33(5). P. 396-403. doi: 10.1097/MOG.0000000000000377.
- Yu J.H., Kim H. Oxidative stress and inflammatory signaling in cerulein pancreatitis. World J Gastroenterol. 2014 Dec 14. Vol. 20(46). P. 17324-9. doi: 10.3748/wjg.v20.i46.17324.
- Deficiency of the serine peptidase Kallikrein 6 does not affect the levels and the pathological accumulation of a-synuclein in mouse brain / V. Samantha Sykioti et al. J Neurochem. 2021. Vol. 157(6). P. 2024-2038. doi: 10.1111/jnc.15199.
- Blocking Kallikrein 6 promotes developmental myelination / H. Yoon et al. Glia. 2022. Vol. 70(3). P. 430-450. doi: 10.1002/glia.24100.
- Yoon H., Scarisbrick I.A. Kallikrein-related peptidase 6 exacerbates disease in an autoimmune model of multiple sclerosis. Biol Chem. 2016. Vol. 397(12). P. 1277-1286. doi: 10.1515/hsz-2016-0239.
- Crystal structure and biochemical characterization of human kallikrein 6 reveals that a trypsin-like kallikrein is expressed in the central nervous system / M.J. Bernett et al. J Biol Chem. 2002. Vol. 277(27). P. 24562-24570. doi: 10.1074/jbc.M202392200.
- Prassas I., Eissa A., Poda G., Diamandis E.P. Unleashing the therapeutic potential of human kallikrein-related serine proteases. Nat Rev Drug Discov. 2015. Vol. 14(3). P. 183-202. doi: 10.1038/nrd4534.
- Srinivasan S., Kryza T., Batra J., Clements J. Remodelling of the tumour microenvironment by the kallikrein-related peptidases. Nat Rev Cancer. 2022. Vol. 22(4). P. 223-238. doi: 10.1038/s41568-021-00436-z.

/14.jpg)