Журнал "Гастроэнтерология" Том 56, №1, 2022
Вернуться к номеру
Можливості ультразвукової діагностики при запальних захворюваннях кишечника
Авторы: Стойкевич М., Федорова Н., Недзвецька Н., Коненко І.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Стаття присвячена складним в плані діагностичного пошуку та ведення хворого нозологіям — неспецифічному виразковому коліту та хворобі Крона. На сьогодні основною діагностичною процедурою при цих захворюваннях залишається ендоскопія з біопсією та гістологією. Проте зберігаються обмеження щодо їх проведення та в оцінці ускладнень і проксимального поширення хвороби Крона. Європейські керівництва з діагностики неспецифічного виразкового коліту та хвороби Крона рекомендують додаткові методи візуалізації для діагностики та визначення локалізації, ступеня та ускладнень, а саме УЗД шлунково-кишкового тракту. У статті наведені клінічні випадки неспецифічного виразкового коліту та хвороби Крона, при яких пацієнтам було виконане УЗД кишечника, та показана висока діагностична значимість останнього.
The article deals with nosologies that are complex for diagnostic search and management of the patient — ulcerative colitis and Crohn’s disease. To date, the main diagnostic procedure for these diseases is endoscopy with biopsy and histology. However, there are limitations in their conduct and in the assessment of complications and proximal spread of CD. European guidelines for the diagnosis of UC and CD recommend additional imaging methods to diagnose and determine the location, degree and complications, namely ultrasound of the gastrointestinal tract. The article presents clinical cases of UC and CD, in patients who underwent ultrasound of the intestine and shows its high diagnostic value.
неспецифічний виразковий коліт; хвороба Крона; ультразвукова діагностика
ulcerative colitis; Crohn’s disease; ultrasound diagnostics
/47.jpg)
/47_2.jpg)
/48.jpg)
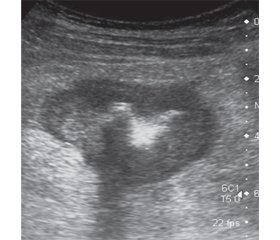
Клінічний випадок 1
/50.jpg)
Клінічний випадок 2
/50_2.jpg)
- Molodecky N.A., et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology. 2012. № 142. Р. 46-54.
- Maaser C., et al. Guideline for Diagnostic Assessment in IBD. Part 1: Initial diagnosis, monitoring of known IBD, detection of complications. J. Crohns Colitis. 2019. Vol. 13. № 2. Р. 144-164.
- De Souza H.S., Fiocchi C. Immunopathogenesis of IBD: Current state of the art. Nat. Rev. Gastroenterol. Hepatol. 2016. № 13. Р. 13-27. doi: 10.1038/nrgastro.2015.186.
- Захараш М.П., Пойда А.И., Мельник В.М. Современная хирургическая тактика при неспецифическом язвенном колите. Харьківська хірургічна школа. 2009. Т. 2. С. 31-34.
- Нечипуренко Т.Б. Мультидисциплінарний підхід у тактиці ведення запальних захворювань кишечника: хірургічні ускладнення — як не пропустити терапевту. Гастроентерологія. 2021. Т. 55. № 2. С. 73-77.
- Panes J. et al. Imaging techniques for assessment of inflammatory bowel disease: joint ECCO and ESGAR evidence-based consensus guidelines. J. Crohns Colitis. 2013. Vol. 7. № 7. Р. 556-85. doi: 10.1016/j.crohns.2013.02.020.
- Дуброва С.Э., Сташук Г.А. Возможности лучевых методов в диагностике воспалительных заболеваний кишечника. Альманах клинической медицины. 2016. № 44 (6). С. 757-769.
- Nicholson B.D. et al. Colonoscopy for colonic wall thickening at computed tomography: a worthwhile pursuit? Surg. Endosc. 2011. № 25(8). Р. 2586-91. doi: 10.1007/s00464-011-1591-7.
- Gomollón F. et al. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1: Diagnosis and Medical Management. J. Crohns Colitis. 2017. № 11. Р. 3-25.
- Antonelli E. et al. Ultrasonographic assessment of colonic wall in moderate-severe ulcerative colitis: comparison with endoscopic fndings. Dig. Liver Dis. 2011. № 43(9). Р. 703-6. doi: 10.1016/j. dld.2011.02.019.
- Митьков В.В. Практическое руководство по ультразвуковой диагностике. Общая ультразвуковая диагностика. Москва: ВИДАР, 2019. 756 с.
- Пиманов С.И., Дикарева Е.А. Трансабдоминальное ультразвуковое исследование при воспалительных и опухолевых заболеваниях кишечника: новые возможности при пероральном контрастировании полиэтиленгликолем. Consilium Medicum. 2020. № 22 (8). С. 65-70. doi: 10.26442/20751753.2020.8.200000.
- Pallotta N. et al. Small intestine contrast ultrasonography: an alternative to radiology in the assessment of small bowel disease. Inflamm. Bowel Dis. 2005. № 11(2). Р. 146-53.
- Parente F. et al. Oral contrast enhanced bowel ultrasonography in the assessment of small intestine Crohn’s disease. A prospective comparison with conventional ultrasound, x ray studies, and ileocolonoscopy. Gut. 2004. № 53(11). Р. 1652-7. doi: 10.1136/gut.2004.041038.
- Kunze G., Seitz K., Mauch M., Petersen F. Clinical Ultrasound in Inflammatory Bowel Disease. Ultraschall Med. 2019. № 40 (2). Р. 132-62. doi: 10.1055/a-0869-8799.
- Nylund K. et al. EFSUMB Recommendations and Guidelines for Gastrointestinal Ultrasound. Part 1: Examination Techniques and Normal Findings (Long version). Ultraschall Med. 2017. № 38. Р. 1-15. doi:10.1055/s-0042-115853.
- Atkinson N.S. Gastrointestinal Ultrasound: Theory and Practice. Ultrasound Med. Biol. 2016. № 42(12). Р. 2732-2742.
- Quaia E. et al. The value of small bowel wall contrast enhancement after sulfur hexafluoride-flled microbubble injection to dierentiate inflammatory from fbrotic strictures in patients with Crohn’s disease. Ultrasound Med. Biol. 2012. № 38(8). Р. 1324-32. doi: 10.1016/j.ultrasmedbio.2012.04.008.
- Pallotta N., Vincoli G., Montesani C. Small intestine contrast ultrasonography (SICUS) for the detection of small bowel complications in Crohn’s disease: a prospective comparative study versus intraoperative fndings. Inflamm. Bowel Dis. 2012. № 18(1). Р. 74-84. doi: 10.1002/ ibd.21678.
- De Franco A., Di Veronica A., Armuzzi A. Ileal Crohn disease: mural microvascularity quantifed with contrast-enhanced US correlates with disease activity. Radiology. 2012. № 262(2). Р. 680-8. doi: 10.1148/radiol.11110440.
- Maconi G. et al. EFSUMB Recommendations and Clinical Guidelines for Intestinal Ultrasound (GIUS) in Inflammatory Bowel Diseases. Ultraschall Med. 2018. № 39(3). Р. 304-17. doi: 10.1055/s-0043-125329.
- Hata J. et al. Ultrasonographic assessment of inflammatory bowel disease. Am. J. Gastroenterol. 1992. № 87. Р. 443-7.
- Kinoshita K. et al. Usefulness of transabdominal ultrasonography for assessing ulcerative colitis: a prospective, multicenter study. J. Gastroenterol. 2019. № 54 (6). Р. 521-9. doi: 10.1007/s00535-018-01534-w.
- Omotehara S. et al. Validation of US evaluation of ulcerative colitis activity. Ultrasound Med. Biol. 2019. № 45 (7). Р. 1537-44. doi: 10.1016/j.ultrasmedbio.2019.02.018.
- Nylund K., Hausken T., Gilja O.H. Ultrasound and inflammatory bowel disease. Ultrasound Q. 2010. № 26(1). Р. 3-15. doi: 10.1097/RUQ. 0b013e3181ce0929.
- Martínez M.J. et al. Assessment of the extension and the inflammatory activity in Crohn’s disease: comparison of ultrasound and MRI. Abdom. Imaging. 2009. № 34(2). Р. 141-8. doi: 10.1007/ s00261-008-9365-y.
- Maconi G. et al. Contrast radiology, computed tomography and ultrasonography in detecting internal fstulas and intra-abdominal abscesses in Crohn’s disease: a prospective comparative study. Am. J. Gastroenterol. 2003. № 98(7). Р. 1545-55. doi: 10.1111/j.1572-0241.2003.07521.x.
- Parente F. et al. Bowel ultrasound in assessment of Crohn’s disease and detection of related small bowel strictures: a prospective comparative study versus Х ray and intraoperative fndings. Gut. 2002. № 50(4). Р. 490-5. doi: 10.1136/gut.50.4.490.
- Arienti V. et al. Management of severe ulcerative colitis with the help of high resolution ultrasonography. Am. J. Gastroenterol. 1996. № 91(10). Р. 2163-9.
- Siğirci A. et al. Doppler sonography of the inferior and superior mesenteric arteries in ulcerative colitis. J. Clin. Ultrasound. 2001. № 29(3). Р. 130-9.
- Spalinger J. et al. Doppler US in patients with Crohn disease: vessel density in the diseased bowel reflects disease activity. Radiology. 2000. № 217(3). Р. 787-91. doi: 10.1148/radiology.217.3.r00dc19787.
- Marmo R. et al. Meta-analysis: capsule enteroscopy vs. conventional modalities in diagnosis of small bowel diseases. Aliment. Pharmacol. Ther. 2005. № 22(7). Р. 595-604. doi: 10.1111/j.1365- 2036.2005.02625.x.
- Allocca M. et al. Accuracy of Humanitas Ultrasound Criteria in assessing disease activity and severity in ulcerative colitis: A prospective study. J. Crohns Colitis. 2018. № 12. Р. 1385-91. doi: 10.1093/ecco-jcc/jjy107.
- Пиманов С.И., Романович А.В., Солодовникова О.И. Трансабдоминальное ультразвуковое исследование кишечника: новые возможности в практике гастроэнтеролога. Гастроэнтерология Санкт-Петербурга. 2018. № 1. С. 53-59.

/48_2.jpg)
/48_3.jpg)
/49.jpg)