Журнал "Гастроэнтерология" Том 56, №1, 2022
Вернуться к номеру
Показники вуглеводного та жирового обміну у хворих з різним ступенем жирової дистрофії печінки
Авторы: Ягмур В.Б., Кислова Р.М., Кленіна І.А., Татарчук О.М., Меланіч С.Л.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
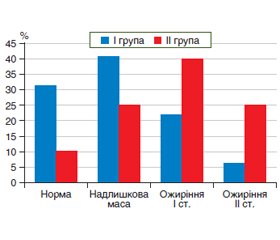
Актуальність. Неалкогольна жирова хвороба печінки (НАЖХП) займає перше місце серед хронічної патології печінки та охоплює майже чверть глобальної популяції. Накопичено достатньо даних щодо взаємного впливу метаболічних зсувів та жирової дистрофії печінки різного ступеня на існування і прогресування один одного. Співіснування неалкогольного стеатогепатиту (НАСГ) із різними коморбідними станами вже зафіксовано у багатьох дослідженнях, які визначили прямий зв’язок між наявністю жирової дистрофії та різними складовими метаболічного синдрому — артеріальною гіпертензією, діабетом другого типу, ожирінням та дисліпідемією. Мета дослідження: визначити взаємозв’язки стану вуглеводного та жирового обміну у пацієнтів з НАЖХП з показником жирової дистрофії печінки. Матеріали та методи. Обстежено 72 хворі на НАЖХП, які за ступенем стеатозу були розподілені на дві групи. У І групу увійшли 46 пацієнтів з помірним стеатозом (частка гепатоцитів, що містять жирові включення, від 33 до 66 %), визначеним згідно з показником контрольованого параметра ультразвукового затухання (САР), що становив від 232 до 256 дБ/м. ІІ групу становили 26 хворих із вираженим стеатозом (частка гепатоцитів, що містять жирові включення, більша за 66 %), з показниками САР більше за 256 дБ/м. У всіх пацієнтів оцінювався трофологічний статус, визначались показники вуглеводного та жирового обміну. Проводився статистичний аналіз отриманих даних — порівнювались середні значення у групах та оцінювався внесок показників у значення САР за допомогою метода множинного регресійного аналізу Результати. Рівень інсуліну та НОМА-IR у пацієнтів зі значною жировою дистрофією печінки становив (22,7 ± 9,7) мкОд/мл та (5,4 ± 2,7) мкОд/мл відповідно. Ці показники були вищими, ніж відповідні показники І групи (р < 0,05), що становили (17,1 ± 10,3) мкОд/мл та (4,01 ± 2,90) мкОд/мл для інсуліну та НОМА-IR відповідно. Показники глюкози, ліпідного спектра вірогідно між групами не відрізнялись, за виключенням ЛПДНЩ, що були вірогідно вищими у пацієнтів з більшим ступенем жирової дистрофії та становили 3,4 (2,3–4,1) ммоль/л та 3,0 (2,4–3,8) ммоль/л у ІІ та І групі відповідно. Був проведений множинний регресійний аналіз для визначення внеску показників жирового та вуглеводного обміну у значення САР. У результаті покрокового аналізу у моделі залишились два показника, а саме індекс НОМА (коефіцієнт регресії β 5,285, р = 0,04) та ІМТ (коефіцієнт регресії β 4,666, р = 0,001). Визначено, що зміни ІМТ та НОМА обумовлюють 31 % змін у величині САР. Висновки. Концентрація інсуліну, значення індексу НОМА, ІМТ та ЛПДНЩ вищі у пацієнтів із вираженим стеатозом. За результатами множинного регресійного аналізу виявлений вірогідний внесок рівнів НОМА та ІМТ у показники контрольованого параметра ультразвукового затухання.
Background. Non-alcoholic fatty liver disease (NAFLD) ranks first among chronic liver diseases and covers almost a quarter of the population. Enough data have been accumulated on the mutual influence of metabolic changes and steatosis of the liver of varying degrees on the existence and progression of each other. The coexistence of non-alcoholic steatohepatitis (NASH) with various comorbidal conditions has already been recorded in many studies, a direct relationship has been determined between the presence of fatty degeneration and various components of the metabolic syndrome — arterial hypertension, type 2 diabetes, obesity and dyslipidemia. The purpose was to determine the relationship between carbohydrate and fat metabolism in patients with NAFLD depending on the degree of fat accumulation in the liver. Materials and methods. Data were obtained from 72 patients with NAFLD, who were divided into two groups according to the degree of steatosis. The I group included 46 patients with moderate steatosis (the proportion of hepatocytes containing fatty is 33–66 %). The indicator of the controlled parameter of ultrasonic attenuation (CAP) ranged from 232 to 256 dB/m. The II group consisted of 26 patients with severe steatosis (the proportion of hepatocytes containing fatty inclusions more than 66 %), with CAP more than 256 dB/m. The trophological status, the parameters of carbohydrate and fat metabolism were determined. A statistical analysis of the data was carried out — the mean values in the groups were compared and the contribution of variables to the value of CAP was estimated using the method of multiple regression analysis. Results. The level of insulin and HOMA-IR in patients with severe fatty degeneration of the liver was (22.7 ± 9.7) and (5.4 ± 2.7) μU/ml, respectively. These indicators were higher than the corresponding indicators of group I (p < 0.05), (17.1 ± 10.3) and (4.01 ± 2.9) μU/ml for insulin and HOMA-IR, respectively. Glucose, lipid spectrum did not differ significantly between the groups, except for the fraction of very-low density lipoproteins (VLDL), which were significantly higher in patients with a higher degree of fatty degeneration and amounted to 3.4 (2.3–4.1) and 3.0 (2.4–3.8) mmol/L in groups II and I, respectively. Multiple regression analysis was performed to determine the contribution of fat and carbohydrate metabolism to CAP values. As a result of step-by-step analysis, two indicators remained in the model, namely the HOMA index (regression coefficient β 5.285, p = 0.04) and BMI (regression coefficient β 4.666, p = 0.001). It was determined that changes in BMI and HOMA are responsible for 31 % of changes in the value of CAP. Conclusions. Insulin values, HOMA index, BMI and VLDL are higher in patients with severe steatosis. According to the results of multiple regression analysis, a significant contribution of HOMA and BMI values to the CAP was revealed.
неалкогольна жирова хвороба печінки; жировий обмін; контрольований параметр ультразвукового затухання; стеатоз
non-alcoholic fatty liver disease; fat metabolism; controlled parameter of ultrasonic attenuation; steatosis
Вступ
Матеріали та методи
Результати
/36_2.jpg)
Обговорення
Висновки
- Eslam M., Sarin S.K., Wai-Sun Wong V. et al. The Asian Pacifc Association for the Study of the Liver clinical practice. Guidelines. 2020. Р. 890-909. URL: https://link.springer.com/article/10.1007 %2Fs12072-020-10094-2.
- Friedman S.L., Neuschwander-Tetri B.A., Rinella M., Sanyal A.J. et al. Mechanisms of NAFLD development and therapeutic strategies. Nat. Med. 2018. Vol. 24(7). Р. 908-22. doi.org/10.1038/s41591-018-0104-9
- Younossi Z.M., Koenig A.B., Abdelatif D., Fazel Y., Henry L., Wymer M. Global epidemiology of nonalcoholic fatty liver disease — meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016. Vol. 64(1). Р. 73-84. doi.org/10.1002/hep.28431.
- Yang X. et al. Performance of liver stiffness measurements obtained with FibroScan is affected by glucose metabolism in patients with nonalcoholic fatty liver disease. Lipids Health Dis. 2021. Mar 23. Vol. 20(1). P. 27. doi: 10.1186/s12944-021-01453-5.
- Cariou B. et al. Nonalcoholic fatty liver disease as a metabolic disease in humans: A literature review. Diabetes, Obesity and Metabolism. 2021. Р. 1069-1073. doi/10.1111/dom.14322.
- Adams L.A. et al. Non-alcoholic fatty liver disease and its relationship with cardiovascular disease and other extrahepatic diseases. Gut. 2017. Vol. 66(6). Р. 1138-53. doi.org/10.1136/gutjnl-2017-313 884.
- Chi-Cervera L.A., Montalvo G.I., Icaza-Chávez M.E. Clinical relevance of lipid panel and aminotransferases in the context of hepatic steatosis and fibrosis as measured by transient elastography (FIBROSCAN®). J. Med. Biochem. 2021. Р. 1-5. doi.org/10.1155/2021/6662760.
- Sirli R., Sporea I. Controlled. Attenuation Parameter for Quantification of Steatosis: Which Cut-Offs to Use? Canadian Journal of Gastroenterology and Hepatology. 2021. Р. 1-5. doi.org/10.1155/2021/6662760.
- Бессесен Д.Г., Кушнер Р. Избыточный вес и ожирение. Под общ. ред. Н.А. Мухина. М.: Бином С, 2004. 239 с.
- Dewidar B., Kahl S., Pafili K. et al. Metabolic liver disease in diabetes — From mechanisms to clinical trials. Metabolism. 2020 Oct. 111S. 154299. doi.10.1016 / j.metabol. 2020.154299.
- Hydes T., Alam U., Cuthbertson D.J. et al. The Impact of Macronutrient Intake on Non-alcoholic Fatty Liver Disease (NAFLD): Too Much Fat, Too Much Carbohydrate, or Just Too Many Calories? eCollection. 2021, 16 February. doi.org/10.3389/fnut.2021.640557 (дата звернення: 20.08.2021).
- Pastorі D., Baratta F., Novo M. et al. Remnant Lipoprotein Cholesterol and Cardiovascular and Cerebrovascular Events in Patients with Non-Daniele Alcoholic Fatty Liver Disease. Clin. Med. 2018. Vol. 7(11). Р. 378. doi.org/10.3390/jcm7110378.
- Chin J. et al. Association between remnant lipoprotein cholesterol levels and non-alcoholic fatty liver disease in adolescents. JHEP Reports. July 2020. Vol. 2(6). 100150. doi.org/10.1016/j.jhepr.2020.100150.
- Bullón-Vela V., Abete I., Tur J.A., Konieczna J. Relationship of visceral adipose tissue with surrogate insulin resistance and liver markers in individuals with metabolic syndrome chronic complications. eCollection. 2020. Published online 2020 Oct 23. doi/full/10.1177/2042018820958298. (9.09.2021).
- Chi-Cervera L.A., Montalvo G.I., Icaza-Chávez M.E. Сlinical relevance of lipid panel and aminotransferases in the context of hepatic steatosis and fibrosis as measured by transient elastography (FIBROSCAN®). J. Med. Biochem. 2021. Р. 60-65. doi 10.5937 / jomb0-24689.

/36.jpg)