Журнал «» Том 14, №6, 2021
Вернуться к номеру
Артеріальна гіпертензія та нирки: погляд кардіолога та нефролога
Авторы: Тетяна Чистик
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Хронічна хвороба нирок (ХХН) — це порушення структури або функції нирок, що триває понад три місяці й негативно впливає на здоров’я і якість життя пацієнтів. ХХН спричиняє більше летальних випадків, ніж злоякісні новоутворення молочної і передміхурової залоз. Важливою причиною ХХН і водночас — її наслідком є артеріальна гіпертензія (АГ). Вона являє собою основний фактор ризику серцево-судинних подій в осіб із ХХН. Жорсткий контроль артеріального тиску (АТ) знижує мікроальбумінурію і протеїнурію та уповільнює прогресування ниркової недостатності.
18 листопада 2021 року за підтримки Національного університету охорони здоров’я України імені П.Л. Шупика, ГО «Українська асоціація медичної освіти», Всеукраїнського громадського об’єднання «Проти гіпертензії» відбулася фахова школа з
онлайн-трансляцією «UkraneCardioGlobal-2021. Seassion 5». У рамках цього заходу розглядалися найважливіші питання постковідних проблем у хворих на серцево-судинні захворювання, роль нирок у патогенезі АГ, місце артеріальної гіпертензії в розвитку хронічної хвороби нирок.
З доповіддю «Артеріальна гіпертензія та нирки: погляд кардіолога та нефролога» виступила доктор медичних наук, професор кафедри нефрології і нирково-замісної терапії Національного університету охорони здоров’я України імені П.Л. Шупика Стелла Вікторівна Кушніренко.
Згідно з даними регістру ERA-EDTA, провідними причинами виникнення хронічної хвороби нирок є цукровий діабет (27,7 %) і артеріальна гіпертензія (16,4 %). Інші місця посідають захворювання нирок — гломерулонефрит (15,9 %), пієлонефрит (7,3 %), полікістозна хвороба нирок (6,8 %) і ниркові судинні захворювання (2,2 %).
У 2022 році можемо відзначати 20-річчя терміна «хронічна хвороба нирок». Його створила велика робоча група, до складу якої входили представники різних медичних спеціальностей. Об’єднання різноманітних нозологічних форм під загальною назвою «ХХН» зумовлене об’єктивними причинами. По-перше, зміни з боку нирок, якщо вони не ліквідуються протягом трьох місяців, можна інтерпретувати як хронічний процес. По-друге, цей термін зрозумілий і прийнятий усією медичною спільнотою, що дозволяє всім лікарям говорити однією мовою.
Один із президентів Американського товариства урологів, Mark D. Okusa, сказав: «Настав час для конструктивних змін у політиці догляду за нирками». І це не випадково. Понад 850 млн людей у всьому світі страждають від тієї чи іншої форми захворювання нирок, що приблизно вдвічі перевищує кількість людей, які живуть із цукровим діабетом (422 млн), і у 20 разів більше, ніж поширеність онкологічних захворювань у всьому світі (42 млн).
Серед чоловіків страждають від ХХН 10,4 % осіб, серед жінок — 11,8 %. Стандартизованій за віком коефіцієнт через низьку функцію нирок (швидкість клубочкової фільтрації (ШКФ)) становить 21 смерть на 100 000 осіб. Річна вартість гемодіалізу на одного пацієнта в США — 88 195 $, у Німеччині — 58 812 $, у Бельгії — 83 616 $, у Франції — 70 928 $.
ХХН класифікується за причиною, стадією ШКФ і категорією альбумінурії. Причина ХХН визначається за наявністю або відсутністю системного захворювання і його ознак у нирках з існуючими або передбачуваними патологоанатомічними характеристиками.
Прогресування ХХН визначається на підставі показника ШКФ (категорія G), згідно з яким виділяють 5 стадій:
— G1 — ШКФ ≥ 90 мл/хв/1,73 м2 — нормальна або висока;
— G2 — ШКФ 60–89 мл/хв/1,73 м2 — незначно знижена;
— G3a — ШКФ 45–59 мл/хв/1,73 м2 — незначно або помірно знижена;
— G3b — ШКФ 30–44 мл/хв/1,73 м2 — помірно або виражено знижена;
— G4 — ШКФ 15–29 мл/хв/1,73 м2 — виражено знижена;
— G5 — ШКФ < 15 мл/хв/1,73 м2 — ниркова недостатність.
Розрахунок швидкості клубочкової фільтрації здійснюється за допомогою спеціальних формул, з яких найбільш досконалою є формула CKD-EPІ. З 2009 року використовуються CKD-EPІ для осіб віком понад 18 років і CKD-EPІ на підставі креатиніну, з 2012 року — CKD-EPІ креатинін/цистатин С і CKD-EPІ цистатин С. До 17 років нормальними показниками цистатину С є 0,5–1,29 мг/л, з 17 до 65 років — 0,5–1,0 мг/л, після 65 років — 0,89–3,39 мг/л.
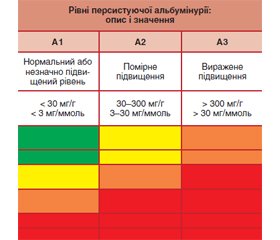
Також важливо визначати співвідношення альбуміну/креатиніну (САК) і категорію альбумінурії. За рекомендаціями KDIGO виділяють такі категорії:
— А1 (альбумін < 30 мг/г, САК < 3 мг/ммоль) — норма або незначне підвищення;
— А2 (альбумін 30–300 мг/г, САК 3–30 мг/ммоль) — помірне підвищення;
— А3 (альбумін > 300 мг/г, САК > 30 мг/ммоль) — виражене підвищення.
Ризики серцево-судинної смертності, розвитку термінальної хронічної ниркової недостатності й прогресування ХХН у будь-якому діапазоні ШКФ істотно різняться залежно від рівня альбумінурії або співвідношення альбуміну/креатиніну (рис. 1).
Основними маркерами нефропатії є артеріальна гіпертензія, альбумінурія, протеїнурія ≥ 30 нг/л (0,033 г/л), анемія (для чоловіків < 130 г/л, для жінок < 120 г/л), гіперазотемія, гіперурикемія, гіперкаліємія.
Слід відзначити, що останніми роками змінився погляд на сечову кислоту, яка була компонентом подагри й уратного нефролітіазу або оксалатно-кальцієвого поєднання з гіперурикемією і гіперглюкозурією. На сьогодні сечова кислота розглядається як ініціатор розвитку хронічної хвороби нирок і драйвер прогресування нефросклерозу.
Так, результати нещодавнього масштабного італійського дослідження URRAH (n = 21963) продемонстрували, що гіперурикемія є фактором ризику серцево-судинної смерті та смерті від усіх причин на додаток до розрахункової ШКФ і альбумінурії в пацієнтів із серцево-судинним ризиком.
При кожному збільшенні сечової кислоти на 1 мг/дл ризик розвитку серцево-судинної смерті та смерті від усіх причин збільшувався на 10 %, навіть після коригування на потенційні фактори, такі як розрахункова ШКФ і наявність альбумінурії.
Ускладнення ХХН залежать від рівня ШКФ. Найпоширенішим із цих ускладнень є артеріальна гіпертензія, яка становить 18,8 % при ШКФ ≥ 90 мл/хв/1,73 м2 і 82,1 % при ШКФ < 30 мл/хв/1,73 м2. Тому основна мета гальмування ХХН — нормалізація АТ.
Рекомендації KDIGO-2021 пропонують у дорослих пацієнтів з високим артеріальним тиском і хронічною хворобою нирок знижувати систолічний АТ до цільового рівня < 120 мм рт.ст. В осіб із високим АТ, ХХН і вираженою альбумінурією (G1-G4, A3) без цукрового діабету рекомендують розпочинати терапію з інгібіторів ренін-ангіотензинової системи, інгібіторів ангіотензинперетворюючого ферменту (іАПФ) або блокаторів рецепторів ангіотензину (БРА) (1В). Також ця стартова терапія призначається особам з високим АТ, ХХН і помірною альбумінурією (G1-G4, A2) без діабету (2С). Особам з високим артеріальним тиском, хронічною хворобою нирок, помірною/вираженою альбумінурією (G1-G4, А2 або А3) з діабетом рекомендовано призначати зі старту іАПФ або БРА (1В).
Ірбесартан належить до класу БРА ІІ, призначається в дозі 150–300 мг і має привабливі фармакодинамічні особливості: найбільш високу біодоступність — 60–80 %, відсутність зв’язування з їжею, тривалий період напіввиведення — 11–15 год, відсутність активного метаболіту, виведення через нирки/печінку — 20/80 %. За ступенем спорідненості до рецепторів ангіотензину ІІ 1-го типу в порядку зменшення препарати розташовуються так: ірбесартан > олмесартан > кандесартан > епросартан > валсартан > лозартан.
На фармацевтичному ринку України ірбесартан представлений препаратом Ірбетан («Київський вітамінний завод», Україна). Ірбетан забезпечує гарантоване збереження ефекту протягом 24 год при одноразовому прийомі. Низка публікацій демонструє зручність його прийому й ефективність, що є запорукою прихильності до антигіпертензивної терапії. Так, у дослідженні ICE (Irbesartan Complance Evolution), яке проводилось у різних країнах Європи (Німеччина, Франція, Велика Британія), була проаналізована прихильність пацієнтів до терапії протягом 12 місяців. Його результати продемонстрували значну перевагу ірбесартану (60,8 %) над іншими видами препаратів — діуретиками (34,4 %), іАПФ (42 %), антагоністами кальцію (43,6 %), лозартаном (44,7 %), β-блокаторами (49,7%) та іншими сартанами (51,3 %).
У дослідженні IRMA II взяли участь 590 хворих на цукровий діабет з АГ і мікроальбумінурією. Усі пацієнти були рандомізовані на 3 групи лікування: ірбесартан 150 мг/добу, або ірбесартан 300 мг/добу, або плацебо. Як показали результати цього дослідження, ірбесартан забезпечував адекватний контроль АТ і сприяв зменшенню мікроальбумінурії. Найкращий результат щодо зниження ризику прогресування нефропатії було отримано в пацієнтів, які приймали ірбесартан у дозі 300 мг/добу. Повний регрес мікроальбумінурії був констатований у 34 % пацієнтів, які отримували ірбесартан 300 мг/добу, у 24 % хворих, які приймали цей препарат у дозі 150 мг/добу; у групі плацебо подібного результату досягли 21 % учасників. Відносний ризик розвитку протеїнурії знизився на 39 % у групі ірбесартану 150 мг/добу і на 70 % — у групі ірбесартану 300 мг/добу.
Дослідження IDNT включало хворих на цукровий діабет (n = 1715) з добовою екскрецією альбуміну > 900 мг/дл і АГ (середні цифри АТ — 156/85 мм рт.ст.). У більшості учасників спостерігалося зниження ниркової функції (середня креатинемія — 1,7 мг/дл), а протеїнурія досягала нефротичного рівня (4,2 г/добу); відзначалася надмірна вага. При цьому 16,5 % пацієнтів на момент включення в дослідження вже перенесли гострий інфаркт міокарда. Хворі отримували ірбесартан 300 мг/добу, або амлодипін 10 мг/добу, або плацебо. Тривалість спостереження становила 2,6 року.
У результаті проведеного лікування у хворих, які отримували ірбесартан, було відмічено зниження ризику термінальної ниркової недостатності на 23 % порівняно з тими, хто лікувався амлодипіном або плацебо (р = 0,07). При порівнянні з групою плацебо виявилося, що ризик подвоєння рівня креатиніну сироватки крові з призначенням ірбесартану зменшується на 33 % (р = 0,003).
Це дослідження має велике значення. По-перше, воно ще раз продемонструвало корисність досягнення цільових рівнів АТ. Цей факт сам по собі сприяє покращанню ниркового прогнозу. По-друге, було встановлено, що ірбесартан достовірно гальмує темпи зниження ШКФ, причому незалежно від її початкового рівня, показників АТ і протеїнурії. Отже, дослідження IDNT показало нефропротекторні можливості ірбесартану в пацієнтів із поєднанням цукрового діабету й АГ.
Однак при використовуванні монотерапії не завжди можливе досягнення цільового АТ. Тому посилення зниження артеріального тиску досягається призначенням раціональних комбінацій — іАПФ/БРА + діуретик/блокатори кальцієвих каналів, для більш потужного посилення — іАПФ/БРА + моксонідин. При волюмзалежному АТ раціональною комбінацією є іАПФ/БРА + діуретик, при тахікардії і молодому віці пацієнтів — іАПФ/БРА + β-блокатори.
Ірбетан® Н — комбінований препарат ірбесартану й гідрохлортіазиду (ГХТ). За даними клінічного дослідження RAPIHD (2009), саме комбінація ірбесартану й гідрохлортіазиду виявилася більш ефективною в досягненні цільових рівнів АТ, ніж монотерапія кожним з компонентів комбінації. Через 12 тижнів лікування частота досягнення цільових значень АТ становила 55,8 % у групі комбінованої терапії, тоді як в групі ГХТ та ірбесартану ці показники були 25 і 34 % відповідно. Крім того, комбінація ірбесартану/ГХТ дозволяла швидше досягти цільових значень.
При призначенні ірбесартану за 3 тижні лікування діастолічний АТ знизився на 17 мм рт.ст., комбінації ірбесартану/ГХТ — на 21,2 мм рт.ст., через 7 тижнів ці показники становили 19,9 і 24,5 мм рт.ст. відповідно. Це дозволило дійти висновку, що ірбесартан/ГХТ знижує АТ більш виражено, ніж при монотерапії кожним з компонентів.
Поєднання ірбесартану з ГХТ — це не тільки посилення ефекту, але й компонент метафілактики, що дозволяє знизити рецидивне утворення конкрементів у пацієнтів з АГ і сечокам’яною хворобою.
До комбінації ірбесартану/ГХТ можна додати блокатори кальцієвих каналів, які мають нефропротективні властивості. Лерканідипін (Ванлерк®, «Київський вітамінний завод») — це ідеальний партнер у досягненні цільового артеріального тиску, що може призначатися в комбінації з іАПФ, β-блокаторами, діуретиками й сартанами.
Фармакокінетика Ванлерк® контролюється клітинною мембраною. Серед усіх антагоністів кальцію Ванлерк® має найвищу вазоселективність. Він справляє мінімальний вплив на інотропну функцію серця й практично не впливає на функцію синусово-передсердного вузла й атріовентрикулярну провідність.
Ванлерк® має найбільш значну спорідненість до рецепторів Са2+ каналів L-типу: фіксується на рецепторах Са2+ каналів L-типу, повільно вивільняється зі зв’язку з рецепторами й прогресивно і тривало інгібує вхід Са2+ у клітину. Також Ванлерк® має виключну ліпофільність, високий ступінь зв’язування з мембраною, завдяки чому накопичується в біліпідному шарі мембрани з формуванням депо. Зі сформованих депо відбувається його поступова дифузія до структур кальцієвих каналів.
Ванлерк® має кардіопротекторні властивості, зменшуючи ремоделювання серця й судин, жорсткість судин, знижує пульсовий периферичний, систолічний АТ, аугментаційний індекс. Він має нефропротекторні й нейропротекторні властивості, забезпечує первинну профілактику інсульту, покращує мозковий кровообіг, при цьому не погіршує вуглеводний і ліпідний обмін. Ванлерк® демонструє оптимальну переносимість, відзначається значно меншою частотою розвитку й вираженістю набряків, забезпечує високу прихильність до терапії.
Нефропротекторні властивості препарату Ванлерк® були показані в дослідженні ZAFRA. Додавання лерканідипіну в дозі 10 мг до іАПФ або БРА ІІ у пацієнтів з підвищеним АТ і супутньою патологією нирок через 6 місяців дозволило досягти: додаткового зниження альбумінурії (–37 %), підвищення кліренсу ендогенного креатиніну, зниження АТ у 89,2 % пацієнтів і досягнення цільового рівня АТ у 58,6 % хворих.

/10.jpg)