Журнал "Гастроэнтерология" Том 55, №4, 2021
Вернуться к номеру
Особливості системи гемостазу у хворих на неалкогольну жирову хворобу печінки
Авторы: Діденко В.І., Меланіч С.Л., Ягмур В.Б., Рубан К.А.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
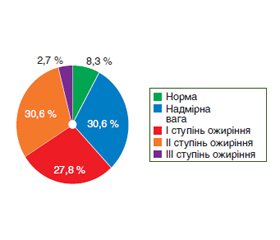
Актуальність. Неалкогольна жирова хвороба печінки (НАЖХП) є найпоширенішим хронічним захворюванням печінки. Останнім часом активно вивчаються порушення в системі гемостазу та їх роль у прогресуванні захворювань печінки та розвитку серцево-судинних ускладнень при НАЖХП. Мета: вивчити особливості системи гемостазу у хворих на неалкогольну жирову хворобу печінки. Матеріали та методи. Обстежено 36 хворих на НАЖХП (20 жінок та 16 чоловіків) віком 29–73 роки. Усім пацієнтам проводилось антропометричне, загальноклінічне, біохімічне дослідження сироватки крові з визначенням тромбоцитів, протромбінового індексу (ПТІ), міжнародного нормалізованого співвідношення (МНС), фібриногену, ультразвукове дослідження органів черевної порожнини з еластометрією з подальшою статистичною обробкою даних. Результати. Серед хворих на НАЖХП переважали ожиріння II ступеня та надмірна вага (по 30,6 %), ожиріння I ступеня (27,8 %). При цьому, за даними САР, у 38,9 % спостерігався тяжкий ступінь стеатозу, у 33,3 % — помірний та у 27,8 % — легкий. Серед показників гемостазу в 44,4 % хворих визначалось вірогідне підвищення рівня фібриногену до (4,9 ± 0,5) г/л; ступінь вираженості порушень вмісту фібриногену мав тенденцію до підвищення зі зростанням ступеня стеатозу печінки. Висновки. У 44,4 % хворих на НАЖХП зі збільшенням ступеня стеатозу печінки зростала схильність до гіперкоагуляції з підвищенням вмісту фібриногену в 1,6 раза (р < 0,001). Зміни показників МНС, ПТІ та тромбоцитів визначались у поодиноких випадках: більше ніж у 83,3 % хворих на НАЖХП порушень з боку цих показників не встановлено.
Background. Non-alcoholic fatty liver disease (NAFLD) is the most common chronic liver disease. In recent years, disorders in the hemostasis system, their role in the progression of liver diseases and the development of cardiovascular complications in NAFLD have been actively studied. The purpose was to investigate the features of the hemostasis system in patients with non-alcoholic fatty liver disease. Materials and methods. We examined 36 individuals with NAFLD (20 women and 16 men) aged 29–73 years. All patients underwent an anthropometric, general clinical, biochemical study of blood serum with the determination of platelets, prothrombin time ratio, international normalized ratio, fibrinogen, ultrasound examination of the abdominal cavity organs with elastometry, followed by statistical data processing. Results. Among patients with NAFLD, class 2 obesity and overweight (30.6 % each), class 1 obesity (27.8 %) prevailed. At the same time, according to the controlled attenuation parameter, 38.9 % of people had a severe degree of steatosis, 33.3 % — moderate and 27.8 % — mild. Regarding the indicators of hemostasis, a significant increase in the level of fibrinogen up to (4.9 ± 0.5) g/l was detected in 44.4 % of patients, its severity tended to grow with an increase in the degree of hepatic steatosis. Conclusions. In 44.4 % of NAFLD patients, with an increase in the degree of hepatic steatosis, the tendency to hypercoagulability has grown with an increase in fibrinogen content by 1.6 times (p < 0.001). Changes in the international normalized ratio, prothrombin time ratio and platelets were determined in isolated cases: more than 83.3 % of patients with NAFLD didn’t have violations of these parameters.
неалкогольна жирова хвороба печінки; гемостаз; фібриноген
non-alcoholic fatty liver disease; hemostasis; fibrinogen
Вступ
Матеріали та методи
Результати
/28.jpg)
/28_2.jpg)
Обговорення
Висновки
- Chalasani N., Younossi Z., Lavine J.E. et al. The Diagnosis and Management of Nonalcoholic Fatty Liver Disease: Practice Guidance From the American Association for the Study of Liver Diseases. Hepatology. 2018. Vol. 67. № 1. Р. 328-357.
- Imajo K., Kessoku T., Honda Y. et al. Magnetic resonance imaging more accurately classifies steatosis and fibrosis in patients with nonalcoholic fatty liver disease than transient elastography. Gastroenterology. 2016. № 150. Р. 626-637.
- Virović-Jukić L., Stojsavljević-Shapeski S., Forgač J. et al. Non-alcoholic fatty liver disease — a procoagulant condition? REVIEW. Croat. Med. J. 2021. № 62. Р. 25-33. https://doi.org/10.3325/cmj.2021.62.25
- Madan S.A., John F., Pitchumoni C.S. Nonalcoholic fatty liver disease and mean platelet volume: a systemic review and meta-analysis. J. Clin. Gastroenterol. 2016. № 50. Р. 69-74. Medline: 25984978. doi: 10.1097/ MCG.0000000000000340.
- Verrijken A., Francque S., Mertens I. et al. Prothrombotic Factors in Histologically Proven Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis. Hepatology. 2014. Vol. 59. № 1. Р. 121-129.
- Potze W., Siddiqui M.S., Sanyal A.J. Vascular Disease in Patients with Nonalcoholic Fatty Liver Disease. Semin. Thromb. Hemost. 2015. № 41. Р. 488-493. Medline: 26049073. doi: 10.1055/s-0035-1550433.
- Tripodi A., Fracanzani A.L., Primignani M. et al. Procoagulant imbalance in patients with non-alcoholic fatty liver disease. J. Hepatol. 2014. № 61. Р. 148-154. Medline: 24657400. doi: 10.1016/j.jhep.2014.03.013.
- Kotronen A., Joutsi-Korhonen L., Sevastianova K. et al. Increased coagulation factor VIII, IX, XI and XII activities in non-alcoholic fatty liver disease. Liver Int. 2011. № 31. Р. 176-183. Medline: 21134109. doi: 10.1111/j.1478- 3231.2010.02375.x.
- Бессесен Д.Г., Кушнер Р. Избыточный вес и ожирение. Под общ. ред. Мухина Н.А. М.: Бином, 2004. 239 с.
- Sasso M. et al. Novel controlled attenuation parameter (CAP™) for non-invasive assessment of steatosis using FibroScan®: validation in chronic hepatitis C. J. Viral Hepatitis. 2011. Vol. 19. P. 224-253.
- Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике: в 2 т. Минск: Беларусь, 2009. Т. 2. 465 с.
- Медицинская статистика: учебное пособие. Под ред. Басовской М.Т. Ростов-на-Дону: Феникс, 2017. 324 с.

/29_2.jpg)
/29.jpg)