Журнал "Гастроэнтерология" Том 55, №4, 2021
Вернуться к номеру
Особливості взаємозв’язку агресивних та захисних факторів слизової оболонки шлунка у хворих на патологію езофагогастродуоденальної зони з порушенням адаптаційного потенціалу та вегетативного гомеостазу (за даними PRECISE-діагностики)
Авторы: Шевченко Б.Ф., Пролом Н.В., Зигало Е.В., Руденко А.І., Демешкіна Л.В., Кислова Р.М.
ДУ «Інститут гастроентерології НАМН України, м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
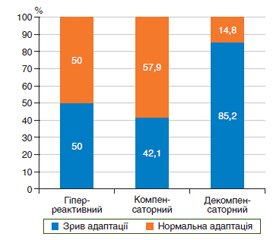
Актуальність. Дисбаланс взаємодії симпатичної і парасимпатичної ланок вегетативної нервової системи призводить до вегетативної дисрегуляції серцевого ритму, наслідком якої є недостатня стійкість до стресів, порушення адаптації та виснаження захисних механізмів слизової оболонки шлунка, тому метою нашого дослідження було оцінити адаптаційний потенціал організму залежно від агресивних та захисних факторів шлункового соку. Матеріал та методи. Був обстежений 71 хворий із патологією езофагогастродуоденальної зони з використанням PRECISE-діагностики. У шлунковому вмісті визначали рівень рН, пепсину, глікопротеїнів, фукози та сіалових кислот. Хворі були розподілені на 3 репрезентативні групи: І — 30 пацієнтів із грижею стравохідного отвору діафрагми; ІІ — 20 хворих на ахалазію кардії; ІІІ — 21 пацієнт із ускладненим перебігом виразкової хвороби дванадцятипалої кишки. Результати. 85,2 % пацієнтів мали дисбаланс симпатичної та парасимпатичної ланок вегетативної системи. Симпатичні механізми домінували в 71,3 % пацієнтів. У той же час більшість пацієнтів з ахалазією кардії мали ваготонію. Адаптаційний та компенсаторний механізми були виявлені після вивчення взаємозв’язку між факторами агресії та захистом слизової шлунка. При аналізі співвідношення агресивних та захисних факторів шлункового соку були виділені такі адаптаційно-компенсаторні варіанти: 1) гіперреактивний — одночасне підвищення рівня факторів як агресії, так і захисту; 2) компенсаторний — збільшення рівня агресивних факторів на фоні нормальних захисних показників; 3) декомпенсаторний — підвищення рівня агресивних факторів одночасно зі зниженням рівня факторів захисту. Висновки. Адапатаційний потенціал організму 85,2 % хірургічних хворих, переважно пацієнтів із грижею стравохідного отвору діафрагми та ахалазією кардії, за даними PRECISE-діагностики, визначений як знижений у вигляді зриву адаптації при декомпенсаторному варіанті співвідношення агресивних та захисних факторів шлункового соку.
Background. An imbalance of interaction between the sympathetic and parasympathetic links of the autonomic nervous system leads to autonomic dysregulation of the heart rate resulting in insufficient stress resistance, impaired adaptation and depletion of the protective mechanisms of the gastric mucosa. Therefore, the purpose of our research was to study adaptive potential of the body depending on the aggressive and protective factors of the gastric juice. Materials and methods. Seventy-one patients with esophagogastroduodenal pathology were examined using the method of PRECISE-diagnostics. The level of pH, pepsin, glycoproteins, fucose and sialic acids in the gastric contents was determined. The patients were divided into 3 representative groups: I — 30 individuals with hiatal hernia; II — 20 patients with achalasia cardia; III — 21 people with duodenal ulcer disease complicated by stenosis. Results. An imbalance of sympathetic and parasympathetic links of autonomic system was detected in 85.2 % of patients. The sympathetic mechanisms dominated in 71.3 % of cases. At the same time, most patients with achalasia cardia had vagotonia. The adaptive and compensatory mechanisms were identified after studying the relationship between the aggressive and protective factors of the gastric mucosa. When analyzing the correlation of aggressive and protective factors of gastric juice, the following adaptive and compensatory options were revealed: 1) hyperreactive, with simultaneous increase in the factors of both aggression and protection; 2) compensatory (an increase in the level of aggressive factors against the background of normal protective indicators); 3) decompensatory (an increase in the level of aggressive factors simultaneously with a decrease in protective factors). Conclusions. The adaptive potential of the body in 85.2 % of surgical patients, mostly those with hiatal hernia and achalasia cardia, according to PRECISE-diagnostics was defined as reduced, in the form of impaired adaptation in decompensatory type of the relationship between aggressive and protective factors of gastric juice.
агресивні та захисні фактори; слизова оболонка шлунка; вегетативний тонус; адаптаційний потенціал; варіабельність серцевого ритму; езофагогастродуоденальна зона
aggressive and protective factors; gastric mucosa; autonomic tone; adaptive potential; heart rate variability; esophagogastroduodenal zone
Вступ
Матеріали та методи
Результати та обговорення
/17_2.jpg)
/18.jpg)
Висновки
- Kim H.G., Cheon E.J., Bai D.S., Lee Y.H. Stress and Heart Rate Variability: A Meta-Analysis and Review of the Literature. Psychiatry Investig. 2018. № 15(3). P. 235-245. doi: 10.30773/pi.2017.08.17.
- Clinical investigation report. Randomized, prospective, sham-controlled, blinded, cross-over clinical study of the effect of the virtual reality (VR) technology on the recovery of the indicators of the autonomic nervous system in healthy volunteers affected by moderate stress. Pure Purr virtual reality techn. 1000 N. West St., Ste 1501, City of Wilmington, Delaware 19801, 2019. 40 р.
- Mondéjar-Guerra V., Rouco J., Novo J., Penedo M., Ortega M. Heartbeat classification fusing temporal and morphological information of ECGs via ensemble of classifiers. Biomedical Signal Processing and Control. 2019. Vol. 47. P. 41-48. doi: org/10.1016/j.bspc.2018.08.007.
- Sen J., McGill D. Fractal analysis of heart rate variability as a predictor of mortality: A systematic review and meta-analysis. Chaos: An Interdisciplinary Journal of Nonlinear Science. 2018. V. 28(7). Р. 72-101. https://doi.org/10.1063/1.5038818
- Sessa F., Anna V., Messina G. et al. Heart rate variability as predictive factor for sudden cardiac death. Aging (Albany NY). 2018. № 10(2). P. 166-177. doi: 10.18632/aging.101386.
- Еремина Е.Ю., Зверева С.И., Козлова Л.С. Показатели вариабельности сердечного ритма у пациентов с гастроэзофагеальной рефлюксной болезнью. Экспериментальная и клиническая гастроэнтерология. 2018. Вып. 157. № 9. С. 10-14.
- Чижиков Д.А., Фомин Л.Б., Борисов В.И. Использование методики определения вариабельности ритма сердца для дифференциальной диагностики язвенной болезни и идиопатических язв двенадцатиперстной кишки. Современные технологии в медицине. 2015. Т. 7. № 2. С. 99-104. doi: 10.17691/stm2015.7.213.
- Nadaleto B.F., Herbella F.A., Patti M.G. Gastroesophageal reflux disease in the obese: Pathophysiology and treatment. Surgery. 2016. Vol. 159. № 2. P. 475-486. doi: 10.1016/j.surg.2015.04.034.
- Yandrapu H., Sarosiek J. Protective Factors of the Gastric and Duodenal Mucosa: An Overview. Curr. Gastroenterol. Rep. 2015 Jun. № 17(6). Р. 24. doi: 10.1007/s11894-015-0452-2.
- PRECISE automated ECG interpretation. California, 90291, United States. 2018.
- Шелекетина И.И., Кожухарь Н.П., Минько А.Ф., Руденко А.И. Количественный метод определения гастромукопротеидов: Инф. письмо. 1983. Вып. 63. 3 с.
- Руденко А.І., Майкова Т.В., Мосійчук Л.М. та ін. Клініко-лабораторна оцінка функціонального стану секреторних залоз шлунка: Методичні рекомендації. 2004. 23 с.
- Шелекетина И.И., Кожухарь Н.П., Минько А.Ф., Руденко А.И. К методике определения активности пепсина в желудочном соке. Лаб. дело. 1981. № 4. С. 254-255.
- Мамаев А.Н. Основы медицинской статистики. М.: Практическая медицина, 2011. 128 с.

/17.jpg)
/17_3.jpg)
/18_2.jpg)