Робота виконана в рамках НДР відділу артеріальної гіпертонії ДУ «Національний інститут терапії ім. Л.Т. Малої НАМН України» «Розробити способи профілактики прогресування гіпертензивного серця у хворих на гіпертонічну хворобу з ожирінням на основі вивчення молекулярно-генетичних, гуморальних і структурно-функціональних факторів» (строки виконання 2017–2019 рр.).
Гіпертонічна хвороба серця (ГХС), або гіпертрофія лівого шлуночка (ГЛШ), — це збільшення маси міокарда лівого шлуночка (ММЛШ) у відповідь на його тривале перевантаження. Компенсаторна і потенційно оборотна на початкових стадіях свого розвитку ГХС у подальшому за відсутності належної терапії трансформується в патологічний стан і призводить до порушення систолічної функції лівого шлуночка (ЛШ), а також істотно підвищує ризик серцево-судинних ускладнень і негативно впливає на прогноз для пацієнта.
Необхідно звернути увагу на те, що ГХС зберігається навіть при нормалізації ступеня навантаження на ЛШ і досягненні цільового рівня артеріального тиску (АТ).
Поширеність ГХС у хворих на артеріальну гіпертензію (АГ), за даними літератури, варіює в широких межах — від 10 до 90 % і пов’язана з різними генетичними, демографічними, клінічними і біохімічними факторами. Демографічні фактори і спосіб життя, асоційовані з розвитком ГХС, включають вік, стать, фізичну активність, расу, ожиріння, чутливість до солі, кількість споживаного алкоголю. Також тяжкість ГХС залежить від ступеня підвищення АТ, наявності вад серця, серцевої недостатності, порушень ритму, цукрового діабету, ниркових захворювань та ін. [1–4].
Відомо, що ГХС значно збільшує ризик серцево-судинних ускладнень, загальної смертності та раптової серцево-судинної смерті. На кожне збільшення ММЛШ, що дорівнює 50 г/м та індексоване на зріст, частота серцево-судинних ускладнень і смерті збільшується в 1,5 раза [30, 32].
Ризик розвитку інсульту і транзиторної ішемічної атаки (ТІА) достовірно збільшується за наявності ЕКГ- та ЕхоКГ-критеріїв ГХС незалежно від віку, статі, рівня АТ, коморбідних патологій. На кожне збільшення індексу ММЛШ (ІММЛШ), що дорівнює 27 г/м2, ризик розвитку цереброваскулярних подій збільшувався на 31 % [7].
ГХС відіграє першочергову роль у розвитку електричної нестабільності міокарда, що клінічно може проявлятися надшлуночковими і шлуночковими аритміями, фібриляцією передсердь. Наявність ГХС у хворих на АГ пов’язана з розвитком нових випадків фібриляції і тріпотіння передсердь, що сприяє збільшенню ризику інсультів, хронічної серцевої недостатності (ХСН) та інфаркту міокарда (ІМ) [7, 24].
За наявності у хворого на АГ такої коморбідної патології, як ішемічна хвороба серця (ІХС), дегенеративне ураження клапанів або цукровий діабет 2-го типу, ризик розвитку ХСН зростає до 5,1 і 9,5 % на рік відповідно за відсутності або наявності ГХС. У міру збільшення ММЛШ (від 50-го до 95-го перцентиля) ризик ХСН збільшується у 8,6 раза [10].
ГХС має дуже велике негативне значення не тільки при АГ, що перебігає без ускладнень або супутніх серцево-судинних захворювань. Показано, що при ІМ наявність концентричного ремоделювання ЛШ збільшує ризик смерті або комбінованої кінцевої точки (серцево-судинна смерть, повторний ІМ, ХСН, інсульт) у 3 рази, ексцентричної ГЛШ — у 3,1 раза, концентричної ГЛШ — у 5,4 раза. Причому на кожне збільшення ІММЛШ, що дорівнює 10 г/м2, ризик смерті і нефатальних серцево-судинних ускладнень збільшувався на 22 % [40].
У популяційному дослідженні було виявлено, що ГХС у хворих на АГ пов’язана з такою коморбідною патологією, як ревматоїдний артрит, що слід розглядати як фактор, що сприяє уповільненню регресування ГХС [29].
Рівень систолічного АТ у нічний час може негативно впливати на розвиток ГХС. Було показано, що зі збільшенням систолічного АТ у нічний час на кожні 10 мм рт.ст. ризик ГХС збільшується на 15 % [15].
Було виявлено, що несприятливий прогноз хворих на АГ залежить від ступеня вираженості ГЛШ, що класифікується згідно з рекомендаціями ASE/EAE [8, 41]. При проведенні багатофакторного аналізу було визначено, що ризик смерті і кардіальних подій зростав у 1,3 раза на кожному ступені збільшення ІММЛШ: при початковій ГХС — відносний ризик загальної смертності становив 2,17, при помірній — 3,04, при значній — 3,81 [8].
Патофізіологічне ГХС — це реактивне збільшення ММЛШ у відповідь на підвищене робоче навантаження, що супроводжується гіпертрофією міоцитів, а також підвищенням вмісту колагену і фіброзом. В основі розвитку ГХС лежать насамперед патологічні ефекти ангіотензину II (АІІ), які обумовлені стимуляцією АТ1-рецепторів. Рівні концентрації АII корелюють із вираженістю ГХС, оскільки чим вище його концентрація, тим більш активно проходять такі процеси, як вазоконстрикція, оксидативний стрес, посилене вивільнення факторів росту, а в подальшому — фіброз, ремоделювання міокарда, апоптоз його клітин. Найбільш істотну роль у розвитку гіпертрофії і ремоделювання ЛШ відіграє власна кардіальна ренін-ангіотензин-альдостеронова система (РААС). Відомо, що РААС в організмі представлена як у плазмі крові, так і в тканинах. При цьому плазмова частина РААС становить всього 10 % і викликає негайні ефекти (серцеві, ниркові), тоді як більша частина (90 %) РААС розподілена в різних тканинах і відповідальна за тривалі ефекти, у тому числі за формування необоротних змін в органах і тканинах. РААС відіграє виняткову роль у розвитку ГХС при усіх її етіопатогенетичних факторах (вік, стать, генетичні особливості, раса, споживання солі, нейрогуморальні порушення, ожиріння, АГ та ін.)
Зараз розглядаються механізми ремоделювання серця в курців [28]. Було відмічене, що перебудова серця в пацієнтів, які палять, характеризується змінами як на молекулярному, так і на клітинному рівні зі значною зміною міжклітинного матриксу міокарда. Потенційними механізмами негативного впливу куріння на регресування ГХС автори вважають разом із гемодинамічними і нейрогуморальними змінами оксидативний стрес, запалення, трансформацію оксиду азоту, зниження рівня матриксних металопротеїназ та активацію мітогенактивованої білкової кінази.
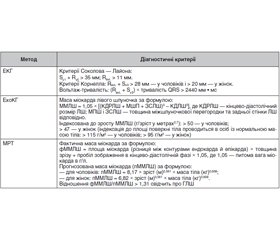
У клінічній практиці для діагностики ГХС використовуються 3 основні неінвазивні методи: електрокардіографія (ЕКГ), ехокардіографія (ЕхоКГ) і магнітно-резонансна томографія (МРТ) серця. Через низьку чутливість ЕКГ-критеріїв у визначенні ГХС, з одного боку, і складнощі проведення МРТ — з іншого, ЕхоКГ є найкращим методом діагностики ГХС у хворих на АГ [14]. Одна з проблем полягає в тому, що на сторінках багатьох наукових видань із питання визначення рейтингу точності і прогностичної значимості ЕхоКГ-критеріїв для оцінки ГХС ведеться дискусія і є спірні моменти [19]. Існують критерії ГЛШ, засновані як на товщині стінок (збільшенням вважається товщина стінок > 1,0 см для жінок і > 1,1 см для чоловіків), так і на оцінці ММЛШ. Слід зазначити, що ММЛШ є більш точним показником його гіпертрофії. Але разом із тим відомо, що якщо наповнення ЛШ у діастолу суттєво знижене, то товщина міокарда ЛШ у діастолу може збільшитися при його нормальній масі. І навпаки, при дилатації ЛШ його стінки можуть бути тонкими навіть при істотно збільшеній масі міокарда [22].
Також обговорюється питання про найкращий спосіб стандартизації оцінки ММЛШ. Для вибору розрахунку ММЛШ найбільш часто пропонуються такі три методи: формула Penn Convention [18]; формула, рекомендована Американським товариством ехокардіографії [38], і формула, запропонована L. Teiсholz [35]. У всіх наведених вище формулах використані тільки три змінні — товщина міжшлуночкової перегородки, товщина задньої стінки ЛШ і кінцевий діастолічний розмір ЛШ. При цьому відмінності між формулами полягають лише в наборі математичних операцій і коефіцієнтів. Проте, якщо брати до уваги лінійну залежність між величиною ММЛЖ і ризиком серцево-судинної смертності, відмінності результатів при розрахунках за різними формулами можуть відображатися на результатах клінічних досліджень [30]. Експерти Американської спілки ЕхоКГ вважають, що ГХС у чоловіків класифікується як початкова при коливанні ІММЛШ, обчисленого під час піднесення до третього степеня М-модальних вимірювань, у межах 116–131 г/м2, помірна — у діапазоні 132–148 г/м2 і значна — 149 г/м2 і більше. На підставі результатів двомірної ЕхоКГ висновок про початкову, помірну або значну ГХС робиться при таких показниках: 103–116, 117–130 та 131 г/м2 і більше відповідно. ГХС у жінок при М-модальному дослідженні класифікується як початкова при коливанні ІММЛШ у межах 96–108 г/м2, помірна — у діапазоні 109–121 г/м2 і значна — 122 г/м2 і більше. За результатами В-модальної ЕхоКГ висновок про початкову, помірну або значну гіпертрофію робиться при таких показниках: 89–100, 101–112 та 113 г/м2 і більше відповідно [22]. Тип ГЛШ визначають з огляду на значення відносної товщини стінок. Якщо відношення подвоєного значення товщини задньої стінки ЛШ до кінцевого діастолічного розміру ЛШ > 0,43, то ГЛШ розцінюють як концентричну, а при значенні 0,43 — як ексцентричну. Серед пацієнтів із нормальною величиною ІММЛШ виділяють таких із концентричним ремоделюванням ЛШ, коли відносна товщина стінок — > 0,43. У групі хворих з ексцентричним типом ГЛШ відповідно до рекомендацій О. Savage зі співавт. додатково виділяють підгрупи осіб із дилатацією ЛШ (індекс кінцевого діастолічного розміру ЛШ > 3,1 см/м2) і без дилатації ЛШ [34]. Експерти з Dallas Heart Study наполягають на 4-рівневій класифікації ГЛШ, що враховує, крім відносної товщини стінок, об’єм порожнини ЛШ. Виділяють товсту, дилатаційну, комбіновану, а також невизначену гіпертрофію. Однак практична доцільність цієї класифікації далеко не очевидна [20]. Відомо, що в клінічних дослідженнях для визначення ММЛШ найбільш часто використовується площа поверхні тіла. Однак даний підхід призводить до недооцінки поширеності ГХС у пацієнтів із надмірною масою тіла та ожирінням. Частота виявлення ГХС як при ожирінні, так і при серцево-судинних захворюваннях збільшується при індексації маси міокарда ЛШ до зросту. Відношення ММЛШ (г) до зросту (м) у степені 2–3 є найбільш часто використовуваним методом індексації в дітей і підлітків. Як правило, використовується піднесення до степеня 2,7 (у хворих із надлишковою масою тіла) [20].
Магнітно-резонансну томографію рекомендується використовувати для оцінки маси і розмірів лівого шлуночка тільки в тому разі, коли технічне виконання ЕхоКГ неможливе або візуалізація серця може дати додаткову необхідну терапевтичну інформацію [13]. Проте дослідження в цьому напрямку тривають. У рамках проведення епідеміологічного дослідження MESA (Multi-Ethnic Study of Atherosclerosis) при виконанні МРТ серця був виявлений новий маркер (індекс глобальної функції лівого шлуночка), що відображає співвідношення структурно-функціональних характеристик лівого шлуночка і визначає прогноз хворих щодо тяжких серцево-судинних подій і ХСН [11, 27].
На сьогодні європейськими експертами [41] пропонуються такі критерії визначення ГЛШ (табл. 1).
З урахуванням описаного важливого значення ГХС для прогнозу захворювання актуальною проблемою є проблема регресування даного стану та профілактики її розвитку і прогресування.
Регресування ГХС у хворих на АГ, за даними клінічних досліджень, забезпечує зниження ризику серцево-судинних подій більше ніж на 50 %. Зменшення ЕКГ-показників, які відображають вираженість ГХС на тлі антигіпертензивної терапії протягом у середньому 4,8 року, привело до зниження ризику комбінованої кінцевої точки на 14 % на кожне зменшення корнелльського добутку на 1050 мм • мс і на 17 % на кожне зниження вольтажу індексу Соколова — Лайона, що дорівнює 10,5 мм [33].
Профілактика розвитку ГХС та її регресування забезпечують профілактику інсульту. Частота цереброваскулярних подій (за 3,5 року спостереження) становила 0,25 на 100 хворих на рік серед осіб із нормальним ІММЛШ і регресуванням ГХС і 1,16 на 100 хворих на рік серед осіб із новими випадками ГХС та за відсутності її регресування. Відповідно, ризик інсульту і ТІА був у 2,8 раза вищим за наявності розвитку ГХС і відсутності позитивної динаміки при вихідному збільшенні ІММЛШ [36].
Зниження збільшеної ММЛШ у хворих на АГ забезпечує не тільки зниження ризику кардіальних подій загалом, але і знижує частоту розвитку нових випадків фібриляції передсердь, як було виявлено в багатоцентровому клінічному дослідженні LIFE [39]. У даному дослідженні також було продемонстровано, що регресування ЕКГ-показників, які відображають ГХС, на тлі тривалої антигіпертензивної терапії було пов’язане також зі зниженням ризику нових випадків розвитку ХСН і госпіталізацій [39]. У субаналізах цього дослідження було виявлено, що й у хворих з ізольованою АГ регресування ЕКГ-критеріїв ГХС забезпечило зниження ризику не тільки серцево-судинних подій, а й нових випадків ХСН [31].
Відомо, що добитися регресування ГХС вдається не у всіх хворих на АГ, тому що цьому процесу перешкоджає ціла низка факторів. Найбільш відомими є такі: високі концентрації в плазмі і тканинах реніну, ангіотензину II, альдостерону; порушення процесів колагенолізу в міокарді зі зсувом у бік підвищеного утворення колагену за рахунок зниження активності матриксних металопротеїназ або/та підвищення дії їх інгібіторів, порушення процесів апоптозу в міжклітинному матриксі [21].
Наявність ожиріння також може перешкоджати зворотному ремоделюванню міокарда ЛШ у хворих на ГХС на тлі прийому антигіпертензивних засобів [17].
Останнім часом виявляються нові предиктори гальмування регресування ГХС. Зокрема, велика увага приділяється оксидативному стресу і гуморальним факторам, які беруть участь у формуванні ГХС — це білки теплового шоку та деякі ферменти — кінази, кальциневрин та ін. [12]. Також було відзначено, що у хворих на АГ, у яких не досягалося адекватне зниження мікроальбумінурії незалежно від ступеня зниження АТ регресування ГХС було значно меншим [4, 17].
Важливо вказати на те, що в темпах прогресування й регресування ГХС відіграють роль генетично детерміновані особливості. Як вважається, саме цим фактом пояснюється неоднакове збільшення ММЛШ у різних пацієнтів за наявності подібного гіпертензивного анамнезу і ступеня підвищення АТ. Деякі хромосомні аномалії, наприклад 9p, пов’язані з розвитком і прогресуванням ГХС у хворих на АГ [26]. Протягом більше 10 років генетичний поліморфізм розглядається як одна з вагомих причин, які негативно впливають на регресування ГХС у хворих на АГ на тлі лікування антигіпертензивними препаратами. Потенційними генами-кандидатами, асоційованими з розвитком ГХС, вважаються ті, які кодують білки, що визначають структурні характеристики серцевого м’яза, так чи інакше регулюють рівень гемодинамічного навантаження, кальцієвий гомеостаз, гормональний статус, субстратний й енергетичний метаболізм, контролюють роботу чинників зростання і сигнальні шляхи міжклітинної взаємодії [9]. Серйозна увага приділяється поліморфізму ферментів і гормонів, що беруть участь у роботі ренін-ангіотензин-альдостеронової системи. Зокрема, при ГХС, що розвивається на тлі підвищених фізичних навантажень, спостерігається інсерційно-делеційний поліморфізм ангіотензинперетворюючого ферменту (АПФ), поліформізм гена A1166C (ген рецепторів 1-го типу до ангіотензину II), поліморфізм гена ангіотензиногену М235Т [23]. Крім цього, було показано, що поліморфізм гена рецепторів 2-го типу до ангіотензину II (+1675 G/A) пов’язаний із порушенням геометрії ЛШ у молодих чоловіків із помірною АГ, мононуклеотидний поліморфізм у гені 344 C/T альдостеронсинтази CYP11B2 асоціюється з ексцентричною ГХС у хворих на АГ. Був виявлений вплив поліморфізму гена β1-рецепторів (заміна гліцину на аргінін у 389-й позиції) на збільшення ММЛШ у пацієнтів із нирковою недостатністю. Установлено, що з підвищенням ММЛШ корелює поліморфізм гена β3-субодиниці G-білка (C825T) [9]. Також виявили, що мононуклеотидний поліморфізм в інтроні гена α-рецепторів, які активуються пероксисомним проліфератором (peroxisome proliferator-activated receptor alpha — PPARα), сприяє зростанню маси кардіоміоцитів ЛШ у хворих на АГ. За даними Фремінгемського дослідження, експресія гена рецепторів 2-го типу до ангіотензину II (AGTR2) корелює з масою міокарда і розмірами ЛШ, ген β2-АР (ADRB2) — з масою міокарда і товщиною стінок ЛШ, а ген кардіоспецифічного тропоніну Т (TNNT2) — із діаметром ЛШ [5]. У дослідженні HyperGEN (The Hypertension Genetic Epidemiology Network) у хворих на АГ вивчали генетичні детермінанти розвитку ГХС і тип ремоделювання ЛШ. Такими генами-кандидатами відповідно до цієї роботи є NPY1R, NPY2R, NPY5R, CPE, IL15 і SFRP2 [6].
Корекція способу життя залишається одним із базових способів регресування ГХС. Вона включає:
— зменшення маси тіла в осіб із надмірною вагою й ожирінням за допомогою правильно підібраної дієти, в якій враховано зменшення калорій, та програми, що передбачає збільшену фізичну активність (аеробні фізичні навантаження);
— обмеження споживання солі до 5 г (85 ммоль) хлориду натрію на добу;
— обмеження споживання алкоголю: максимальна добова доза (у перерахунку на етанол) не повинна перевищувати 20 г на добу в чоловіків і 10 г на добу в жінок [3, 41].
Відомо, що основним способом корекції ГХС є медикаментозна терапія. Дані дослідження CAPPP (CAPtopril Prevention Project) свідчили про статистично більш виражений вплив прийому каптоприлу порівняно з метопрололом на вираженість ГЛШ. На тлі однакового зниження рівнів АТ тиску прийом каптоприлу 1 рік приводив до більш статистично значущого зменшення ІММЛШ (на 13 і 6 % відповідно; p < 0,01) [25]. У дослідженні PICXEL було доведено, що комбінація периндоприлу й індапаміду забезпечує регресування ГЛШ достовірно (р < 0,0001) більше, ніж монотерапія еналаприлом [16]. Сучасна позиція з питання впливу антигіпертензивних препаратів на регресування ГХC така: більшість із них забезпечують разом із гіпотензивним ефектом зменшення ММЛШ [7]. В одному з метааналізів (75 публікацій, 6001 хворий на АГ) було виявлено, що β-адреноблокатори справили порівняно з іншими антигіпертензивними засобами достовірно менший кардіопротективний ефект. При цьому антагоністи рецепторів ангіотензину ІІ (АРА) порівняно з іншими гіпотензивними препаратами забезпечили достовірне більш виражене зниження ІММЛШ.
Максимальне регресування ГХС, за даними метааналізу, зареєстроване при використанні антагоністів кальцію (АК), переважно при призначенні амлодипіну. Отже, при комбінації препаратів найбільше регресування ГХС можна було очікувати при використанні інгібіторів АПФ (ІАПФ) або АРА та АК дигідропіридинового ряду — амлодипін (табл. 2) [1, 4, 5, 37].
Ця позиція зараз регламентована в останніх рекомендаціях EHS/ESC (2018), де сказано, що для базисної терапії хворих на ГХ та ГХС слід обирати препарат із групи ІАПФ, або АРА, або АК, які продемонстрували здатність до найбільш суттєвого регресування ГЛШ за результатами клінічних досліджень [1, 33, 37].
Вважається. що за наявності ГХС першим кроком лікування є комбінація (в одній таблетці) двох препаратів: ІАПФ/АРА + АК/тіазидний чи тіазидоподібний діуретик, другим кроком — комбінація трьох вищезазначених препаратів. Це забезпечує ефективне зниження АТ та оптимальний вплив на ГЛШ (І клас доказів). Цільові рівні АТ у пацієнтів із ГХС повинні становити 120–130 мм рт.ст. (ІІа клас доказів) [41].
Таким чином, доведено, що ГХС є несприятливим прогностичним фактором ураження органів-мішеней, серцево-судинних і ренальних подій. Поширеність і ризик розвитку ГХС у хворих на АГ залежать від багатьох факторів: клінічних, гемодинамічних, нейрогуморальних, генетичних, а також вибору критеріїв її оцінки. Регресування ГХС покращує прогноз хворих на АГ. Для забезпечення максимального регресування ГХС рекомендована терапія блокаторами ренін-ангіотензин-альдостеронової системи й антагоністами кальцію дигідропіридинового ряду, якщо можливо, у фіксованій комбінації. АРА, порівняно з ІАПФ, у складі комбінованої терапії з АК можуть бути кращими препаратами, тому що викликають менше побічних ефектів, ніж останні. Перспективним вважається подальше вивчення клінічних, гуморальних, генетичних та інших чинників, що перешкоджають регресуванню ГХС у хворих на АГ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Коваль С.М. Проблеми класифікації і діагностики артеріальної гіпертензії та стратифікації ризику розвитку її ускладнень в світлі Європейських рекомендацій 2018 року (коментар до рекомендацій). Артеріальна гіпертензія. 2019. 1(63). 3-41.
2. Коваль С.М. Діагностика та лікування артеріальної гіпертензії: від рекомендацій до клінічної практики. Здоров’я України. 2019. 10(455). 6.
3. Милославський Д.К., Коваль С.М., Снігурська І.О., Старченко Т.Г., Божко В.В., Юшко К.А., Щенявська О.М. Модифікація способу життя та дієтичне харчування хворих на артеріальну гіпертензію у поєднанні з цукровим діабетом: рекомендації європейських консенсусів та реалії життя (огляд літератури). Міжнародний ендокринологічний журнал. 2018. Т. 14. № 2. С. 99-110.
4. Сіренко Ю.М., Рековець О.Л., Доброход А.С. Оцінка впливу моно- та комбінованої антигіпертензивної терапії дигідропіридиновими та недигідропіридиновими антагоністами кальцію на показники офісного артеріального тиску та артеріального тиску при добовому моніторуванні у пацієнтів із м’якою та помірною артеріальною гіпертензією. Артериальная гипертензия. 2016. № 1. С. 45-66.
5. Сиренко Ю.Н., Рековец О.Л., Кушнир С.Н., Торбас Е. Сравнительная эффективность эналаприла и периндоприла по влиянию на центральное артериальное давление и упруго-эластические свойства артерий у пациентов с мягкой и умеренной артериальной гипертензией. Артериальная гипертензия. 2016. № 2. 101-111.
6. Arnett D.K., Devereux R.B., Rao D.C. et al. Novel genetic variants contributing to left ventricular hypertrophy: the HyperGEN study. J. Hypertens. 2009. 27(8). 1585-1593.
7. Bang C.N., Soliman E.Z., Simpson L.M. et al. Electrocardiographic Left Ventricular Hypertrophy Predicts Cardiovascular Morbidity and Mortality in Hypertensive Patients: The ALLHAT Study. ALLHAT Collaborative Research Group. Am. J. Hypertens. 2017, Sept 1. 30(9). 914-922.
8. Barbieri A., Bursi F., Mantovani F. et al. Left ventricular hypertrophy reclassification and death: application of the Recommendation of the American Society of Echocardiography/European Association of Echocardiography. Eur. Heart J. Cardiovasc. Imaging. 2012. 13(1). 109-117.
9. Berezin А. Circulating biomarkers in heart failure: diagnostic and prognostic importance. Adv. Exp. Med. Biol. 2018. 1067. 89-108. doi: 10.1007/5584.
10. Bluemke D.A., Kronmal R.A., Lima J.A. et al. The relationship of left ventricular mass and geometry to incident cardiovascular events: the MESA (Multi-Ethnic Study of Atherosclerosis) study. J. Am. Coll. Cardiol. 2008. 52(25). 2148-2155.
11. Burns J., Ball S.G., Worthy G. et al. Hypertensive left ventricular hypertrophy: a mechanistic approach to optimizing regression assessed by cardiovascular magnetic resonance. J. Hypertens. 2012. 30(10). 2039-2046.
12. Cacciapuoti F. Molecular mechanisms of left ventricular hypertrophy (LVH) in systemic hypertension (SH)-possible therapeutic perspectives. J. Am. Soc. Hypertens. 2011. 5(6). 449-455.
13. Codella N.C., Lee H.Y., Fieno D.S. et al. Improved left ventricular mass quantification with partial voxel interpolation: in vivo and necropsy validation of a novel cardiac MRI segmentation algorithm. Circ. Cardiovasc. Imaging. 2012. 5. 137-146.
14. Cuspidi C., Facchetti R., Sala C. еt al. Normal values of left-ventricular mass: echocardiographic findings from the PAMELA study. J. Hypertens. 2012. 30(5). 997-1003.
15. Cuspidi C., Facchetti R., Bombelli M. et al. Nighttime blood pressure and new-onset left ventricular hypertrophy: findings from the Pamela population. Hypertension. 2013. 62(1). 78-84.
16. Dahlöf B., Gosse j.Ph. Gueret P., Dubourg O.J. Perindopril/indapamide combination more effective than enalapril in reducing blood pressure and left ventricular mass: The PICXEL study J. of Hypertension. 2005. 23(11). 2063-2070. DOI: 10.1097/01.hjh.0000187253.35245.dc.
17. de Simone G., Devereux R.B., Izzo R. et al. Lack of reduction of left ventricular mass in treated hypertension: the strong heart study. J. Am. Heart Assoc. 2013. 2(3). e000144.
18. Devereux R.B., Alonso D.R., Lutas E.M. et al. Echocardiographic assessment of left ventricular hypertrophy: comparison to necropsy findings. Am. J. Cardiology. 1986. 57. 450-458.
19. Gerdts E., Okin P.M., Boman K. et al. Association of heart failure hospitalizations with combined electrocardiography and echocardiography criteria for left ventricular hypertrophy. Am. J. Hypertens. 2012. 25(6). 678-683.
20. Khouri M.G., Peshock R.M., Ayers C.R., de Lemos J.A., Drazner M.H. A 4-tiered сlassification of left ventricular hypertrophy based on left ventricular geometry. The Dallas Heart Study. Circ. Cardiovasc. Imaging. 2010. 3. 164-171.
21. Koval S.M., Snihurska I.O., Vysotska O., Strashnenko H.M., Wójcik W., Dassibekov K. Prognosis of essential hypertension progression in patients with abdominal obesity. Information Technology in Medical Diagnostics II — Wójcik, Pavlov& Kalimoldayev (Eds). Taylor&Francis Group, London. 2019. DOI: 10.1201/9780429057618-32.
22. Lang R.M., Badano L.P., Mor-Avi V. et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American society of echocardiography and the European association of cardiovascular imaging. European Heart Journal — Cardiovascular Imaging. 2015. 16. 233-271.
23. Lynch A.I., Tang W., Shi G. et al. Epistatic effects of ACE I/D and AGT gene variants on left ventricular mass in hypertensive patients: The Hypergiant Study. Journal of human hypertension. 2012. 26(2). 133-140.
24. Macfarlane P.W., Murray H., Sattar N. et al. The incidence and risk factors for new onset atrial fibrillation in the PROSPER study. Europace. 2011. 13(5). 634-639.
25. Malmqvist K., Kahan T., Isaksson H., Ostergren J. Regression of left ventricular mass with captopril and metoprolol, and the effects on glucose and lipid metabolism. Blood Press. 2001. 10. 101-110.
26. Menni C., Boffi L., Cesana F. et al. Variant on chromosome 9p is associated with left ventricular mass: results from two cohorts of essential hypertensive individuals. J. Hypertens. 2012. 30(11). 2144-2150.
27. Mewton N., Opdahl A., Choi E.Y. et al. Left ventricular global function index by magnetic resonance imaging-a novel marker for assessment of cardiac performance for the prediction of cardiovascular events: the multi-ethnic study of atherosclerosis. Hypertension. 2013. 61(4). 770-778.
28. Minicucci M.F., Azevedo P.S., Polegato B.F. et al. Cardiac remodeling induced by smoking: concepts, relevance, and potential mechanisms. Inflamm. Allergy Drug. Targets. 2012. 11(6). 442-447.
29. Myasoedova E., Davis J.M. 3rd, Crowson C.S. et al. Brief report: rheumatoid arthritis is associated with left ventricular concentric remodeling: results of a population-based cross-sectional study. Arthritis Rheum. 2013. 65(7). 1713-1718.
30. Okin P.M., Bang C.N., Wachtell K. et al. Relationship of sudden cardiac death to new-onset atrial fibrillation in hypertensive patients with left ventricular hypertrophy. Circ. Arrhythm. Electrophysiol. 2013. 6(2). 243-251.
31. Okin P.M., Wachtell K., Devereux R.B. et al. Regression of electrocardiographic left ventricular hypertrophy and decreased incidence of new-onset atrial fibrillation in patients with hypertension. JAMA. 2006. 296(10). 1242-1248.
32. Panikkath R., Reinier K., Uy-Evanado A. et al. Electrocardiographic predictors of sudden cardiac death in patients with left ventricular hypertrophy. Ann. Noninvasive Electrocardiol. 2013. 18(3). 225-229.
33. Radchenko G. Left ventricular hypertrophy: determination factors, methods of evaluation, possibility of regression. Український кардіологічний журнал. 2010. 6. 99-109.
34. Savage D.D., Garrison M.S., Kannel W.B. et al. The spectrum of left ventricular hypertrophy in a general population sample: The Framingham Study. Circulation. 1987. 75 (1, Pt 2). I26-I33.
35. Schiller N.B., Shah P., Crawford M. et al. Recommendations for quantitation of the left ventricle by two-dimensio-nal echocardiography. American Society of Echocardiography committee on standards, subcommittee on quantitation of two-dimensional echocardiograms. J. Am. Soc. Echocardiography. 1989. 2. 358-367.
36. Soliman E.Z., Byington R.P., Bigger J.T. et al. Effect of Intensive Blood Pressure Lowering on Left Ventricular Hypertrophy in Patients With Diabetes Mellitus: Action to Control Cardiovascular Risk in Diabetes Blood Pressure Trial. Hypertension. 2015 Dec. 66(6). 1123-1129.
37. Thomopoulos C., Parati G., Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: Effects of more vs. less intensive blood pressure lowering and different achieved blood pressure levels — updated overview and meta-analyses of randomized trials. J. Hypertens. 2016 Apr. 34(4). 613-622.
38. Troy B., Pombo J., Rackley C.E. Measurement of left ventricular wall thickness and mass by echocardiography. Circulation. 1972. 45. 602-611.
39. Verdecchia P., Angeli F., Gattobigio R. еt al. Regression of left ventricular hypertrophy and prevention of stroke in hypertensive subjects. J. Hypertens. 2006. 19(5). 493-439.
40. Verma A., Meris A., Skali H. et al. Prognostic implications of left ventricular mass and geometry following myocardial infarction: the VALIANT (VALsartan In Acute myocardial iNfarcTion) Echocardiographic Study. JACC Cardiovasc Imaging. 2008. 1(5). 582-591.
41. Williams B., Mancia G., Spiering W., Agabiti E. et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. European Heart Journal. Vol. 39. Is. 33. 1 Sept 2018. 3021-3104.

/40.jpg)
/42.jpg)