Вступ
Артеріальна гіпертензія (АГ) протягом тривалого періоду залишається найпоширенішим неінфекційним захворюванням і одним із найвпливовіших факторів ризику розвитку серцево-судинних захворювань (ішемічна хвороба серця (ІХС), інфаркт міокарда, серцева недостатність, раптова смерть), хронічної хвороби нирок (ХХН), цереброваскулярних захворювань (інсульт, когнітивна дисфункція), атеросклеротичного захворювання периферичних артерій [1]. Результати міжнародних багатоцентрових досліджень свідчать, що особливо несприятливим є прогноз пацієнтів із резистентною АГ (РАГ), що є значно гіршим, ніж у загальній популяції пацієнтів з АГ [2, 3]. РАГ пов’язана з високим ризиком розвитку серцево-судинних ускладнень. Ризик розвитку порушень мозкового кровообігу, інфаркту міокарда, серцевої недостатності, термінальної стадії ХХН та смерті у 2–6 разів вищий, ніж у пацієнтів без резистентності до лікування [4, 5].
Відомо, що РАГ асоціюється з іншими факторами ризику серцево-судинних ускладнень — похилим віком, цукровим діабетом (ЦД), ожирінням, гіпертрофією лівого шлуночка (ГЛШ), ХХН, синдромом обструктивного апное сну [2], проте це питання потребує подальших досліджень.
Уперше термін «резистентна артеріальна гіпертензія» запропонував у 1988 році R. Gifford [6]. Того ж року E. Frohlich дав характеристику резистентної АГ як стану, при якому існує нездатність контролювати АТ нижче рівня 160/100 мм рт.ст., незважаючи на адекватне немедикаментозне та медикаментозне втручання. При цьому адекватною вважалась терапія із застосуванням трьох антигіпертензивних препаратів, один з яких належить до діуретиків [7]. В наші часи критерії РАГ дещо змінились з огляду на зміни щодо значень АТ як критерію АГ — із 160/100 мм рт.ст. на 140/90 мм рт.ст. та появу ефективних нових груп антигіпертензивних препаратів — інгібіторів ренін-ангіотензинової системи — в останніх рекомендаціях.
Відповідно до рекомендацій Європейського товариства кардіологів (ЄТК)/Європейського товариства з гіпертензії (ЄТГ) 2018 року, резистентною вважається АГ, при якій на тлі застосування оптимальних доз антигіпертензивних препаратів, що включають інгібітори ангіотензинперетворюючого ферменту (ІАПФ) або блокатори рецепторів ангіотензину в комбінації з блокатором кальцієвих каналів та тіазидним/тіазидоподібним діуретиком, систолічний (САТ) та/або діастолічний артеріальний тиск (ДАТ) перевищує цільові рівні (140/90 мм рт.ст.), та неадекватний контроль АТ підтверджено результатами добового моніторування (ДМАТ) або домашнього АТ, а також виключено різні причини псевдорезистентної та вторинної АГ [1]. Порівняно з попередніми рекомендаціями ЄТК/ЄТГ (2013), в яких було вказано, що, незважаючи на застосування комбінованої антигіпертензивної терапії, яка складається з трьох препаратів в оптимальних дозах, один з яких діуретик, у нових уточнено всі три групи рекомендованих до застосування антигіпертензивних препаратів [8]. В оновлених рекомендаціях Американської колегії кардіологів (АСС) та Американської асоціації серця (АНА) 2017 року РАГ характеризується як підвищення АТ більше від цільових значень (130 мм рт.ст.) у пацієнтів, які одночасно приймають три препарати, включаючи блокатори кальцієвих каналів тривалої дії, блокатор системи ренін-ангіотензину (ІАПФ або антагоністи рецепторів ангіотензину) і діуретик у максимальних або максимально переносимих дозах, або коли цільові рівні АТ досягаються тільки на тлі прийому 4 та більше антигіпертензивних препаратів. Причому АГ розцінюють як резистентну тільки за умови виключення неточності вимірювання АТ, поганої прихильності до лікування, підтвердження рівня АТ за допомогою домашнього та добового моніторування та виключення вторинної АГ [4]. Отже європейські та американські рекомендації різняться лише цільовим рівнем АТ. Критерії РАГ, прийняті в Україні, відповідають європейським.
Поширеність РАГ, за різними даними, суттєво коливається залежно від характеристики пацієнтів та обраних критеріїв її діагностики. Поширеність РАГ у дорослих сягає 13 % за умови користування європейськими критеріями, при використання нових американських критеріїв (рекомендації АСС/АНА, 2017), збільшується на 4 % [4]. За даними дослідження ALLHAT, 27 % із 33 000 пацієнтів не досягли цільового рівня АТ, незважаючи на прийом трьох і більше антигіпертензивних препаратів [9], тоді як в американському епідеміологічному дослідженні здоров’я населення NHANES поширеність РАГ серед пацієнтів, які приймали відповідну терапію, становила 12,8 % [10]. За даними низки досліджень, резистентність до антигіпертензивної терапії асоціюється з триразовим підвищенням ризику розвитку серцево-судинних подій порівняно з пацієнтами, які на тлі лікування досягли цільових рівнів АТ [3, 11, 12].
Патогенез АГ, зокрема її резистентного перебігу, є багатофакторним і у даний час до кінця не визначеним; важливу роль у розвитку РАГ відіграють активація симпатоадреналової та ренін-ангіотензин-альдостеронової систем (РААС), системного запального процесу та інтенсифікація оксидативного стресу, порушення метаболізму та функції ендотелію [2, 13–16]. Взаємодія безлічі чинників призводить до суттєвого і стійкого підвищення АТ, розвитку мікроангіопатій, значного ураження органів-мішеней, серцево-судинних і ниркових ускладнень, включаючи інфаркт міокарда, серцеву недостатність, інсульт, термінальну стадію ХХН.
Все це підтверджує важливість проблеми РАГ, обумовлює необхідність розробки підходів до своєчасної діагностики та адекватного її лікування.
Мета роботи: дослідити особливості ураження органів-мішеней, нейрогуморального та прозапального статусу у пацієнтів з РАГ.
Матеріали та методи
У дослідження було включено 257 пацієнтів, у яких за даними анамнезу, клінічного статусу та обстежень було встановлено попередній діагноз РАГ. Всі пацієнти надали інформовану згоду на участь у дослідженні.
Для підтвердження діагнозу РАГ та виключення вторинної АГ усім пацієнтам проводили фізикальне обстеження, лабораторні та інструментальні дослідження згідно з настановою та клінічним протоколом надання медичної допомоги «Артеріальна гіпертензія», затвердженим наказом МОЗ України № 384 від 24.05.2012 року. За результатами обстеження у 22 пацієнтів з підо-зрою на РАГ (8,5 %) виявлено вторинну АГ. Для виключення псевдорезистентної АГ (ПРАГ) усім пацієнтам призначали стандартну трикомпонентну фіксовану комбінацію (ФК) антигіпертензивних препаратів у максимальних дозах: блокатор РААС/тіазидний (тіазидоподібний) діуретик/антагоніст кальцію. Через три місяці лікування у 103 пацієнтів було підтверджено РАГ, вони становили основну групу дослідження; у 132 пацієнтів було досягнуто цільових рівнів АТ і вони увійшли в групу порівняння з ПРАГ.
Всім пацієнтам було проведено загальноклінічне обстеження — аналіз скарг, анамнестичних та об’єктивних даних, зокрема вимірювання офісного АТ, частоти серцевих скорочень (ЧСС), зросту, маси тіла, окружності талії. Розраховано індекс маси тіла та площу поверхні тіла за загальноприйнятими формулами.
Прихильність пацієнтів до лікування оцінювали на підставі результатів, отриманих за допомогою опитувальника Моріскі — Гріна [17].
Усім пацієнтам проводили ЕхоКГ у режимах М- і секторального сканування за стандартним протоколом. Розраховували відносну товщину стінок лівого шлуночка (ВТС ЛШ) та масу міокарда ЛШ (ММЛШ). Індекс ММЛШ розраховували як відношення ММЛШ до площі поверхні тіла (ІММЛШs) та до зросту пацієнта (ІММЛШh), зважаючи на наявність серед обстежених значної кількості пацієнтів з ожирінням. ГЛШ діагностували при значеннях ІММЛШ понад 115 і 95 г/м2 відповідно у чоловіків і жінок. Концентричний характер змін ЛШ — при значеннях ВТС > 0,42. Стан діастолічної функції (ДФ) ЛШ вивчали за кривою трансмітрального кровотоку в імпульсно-хвильовому режимі допплерографії та методом тканинної допплерографії з вивченням швидкості руху фіброзного кільця мітрального клапана, імпульсно-хвильову допплерографію трансмітрального та венозного легеневих потоків. Розраховували співвідношення максимальної швидкості раннього діастолічного наповнення трансмітрального кровотоку та максимальної швидкості діастолічної хвилі руху мітрального кільця (E/Е’). При первинному обстеженні для диференціації нормального та псевдонормального типів трансмітрального кровотоку проводили пробу Вальсальви.
Дуплексне сканування екстра- та інтракраніальних артерій проводили за стандартною методикою. Потовщенням вважали товщину комплексу інтима-медіа (ТКІМ) > 0,9 мм, наявністю атеросклеротичних бляшoк — збільшення ТКІМ від 1,5 мм. Вимірювали пікову систолічну та мінімальну діастолічну швидкість кровотоку у середніх мозкових артеріях, розраховували індекс цереброваскулярної резистивності середніх мозкових артерій.
Для дослідження когнітивної функції використовували опитувальник Монреальської шкали оцінки когнітивних функції (МоСА). Добове моніторування АТ проводили за стандартним протоколом; розрахунок показників — з використанням програмного забезпечення Medibase 1.38. Характер добового ритму АТ оцінювали відповідно за значенням добового індексу систолічного АТ: dipper (11–20 %), non-dipper (0–10 %), over-dipper (> 20 %), night-peaker (< 0 %).
Функціональний стан нирок оцінювали за розрахунковою швидкістю клубочкової фільтрації (ШКФ) за формулою CKD-EPI, а також розраховували ШКФ із включенням у формулу цистатину С.
Біохімічні дослідження крові проводили за загальноприйнятими методиками. Концентрацію в плазмі крові глюкози, креатиніну, С-реактивного протеїну (СРП), фібриногену, добову екскрецію альбуміну з сечею (ЕАС) визначали імунотурбідиметричним методом на біохімічному аналізаторі Biosystems A25 (Іспанія) з використанням відповідних тест-систем.
Вміст у плазмі інтерлейкіну-6 (ІЛ-6), фактора некрозу пухлини α (ФНП-α) (Labsystems iEMS, Фінляндія), цистатину С (Elisa, Німеччина), активного реніну (IBL, Німеччина), альдостерону (концентрація альдостерону плазми) (BDC, Канада), метанефринів у добовій сечі (IBL, Німеччина) визначали імуноферментним методом з використанням відповідних тест-систем.
Аналіз ефективності четвертого компонента комплексної антигіпертензивної терапії проведено у 66 пацієнтів з РАГ, яким через 3 місяці застосування потрійної ФК додавали почергово четвертий компонент терапії — антагоністи мінералокортикоїдних рецепторів спіронолактон 25–50 мг, еплеренон 25–50 мг, бета-адреноблокатор небіволол 5–10 мг та агоніст імідазолінових рецепторів моксонідин 0,4–0,6 мг на період 3 місяці кожний. Контроль калію та креатиніну крові, а також титрування дози препаратів (в разі необхідності) проводився через 1 місяць терапії. Після закінчення кожного етапу 3-місячної терапії проводили офісне та амбулаторне вимірювання АТ, визначали рівень калію, натрію, креатиніну в плазмі, після чого відбувалася ротація четвертого компонента антигіпертензивної терапії пацієнтів з істинною РАГ.
Статистичну обробку даних проводили за допомогою програми SPSS, версія 13. Характер розподілення змінних оцінювали за допомогою тесту Колмогорова — Смирнова для однієї вибірки. Залежно від характеру розподілу змінних застосовували методи параметричної та непараметричної статистики. Для визначення наявності та ступеня взаємозв’язку між незалежними змінними використовували кореляційний та регресійний аналіз. Всі значення наведені у вигляді (М ± m), де М — середнє арифметичне значення показника, m — стандартна помилка середньої величини. При перевірці статистичних гіпотез нульову гіпотезу відкидали при Р < 0,05.
Результати та обговорення
Основні вихідні характеристики пацієнтів подано в табл. 1.
У структурі інсультів переважали ішемічні: у пацієнтів з РАГ — 12 випадків, у хворих із ПРАГ — 5 випадків; два пацієнти з РАГ перенесли геморагічний інсульт, ще чотири — транзиторну ішемічну атаку (ТІА). Персистуючу фібриляцію передсердь зафіксовано у 5 хворих групи РАГ. Цукровий діабет мав місце у 23,3 % пацієнтів з РАГ, у групі ПРАГ — у 7,6 % (χ2 = 12,5; Р = 0,001). На момент первинного обстеження в усіх пацієнтів ЦД був компенсований або субкомпенсований; середній вміст глюкози у венозній крові пацієнтів з РАГ і ПРАГ становив 6,09 ± 0,19 ммоль/л і 5,38 ± 0,12 ммоль/л відповідно (Р = 0,004).
Пацієнти з РАГ мали вищі (Р < 0,001), ніж пацієнти з ПРАГ, значення систолічного АТ не тільки при його офісному вимірюванні, але й за даними ДМАТ — в усі періоди доби, а також нижчий добовий індекс систолічного (Р < 0,001) та діастолічного АТ (Р < 0,01) та достовірно вищий ранковий приріст (РП) САТ (Р < 0,001) і ДАТ (Р < 0,01) (табл. 2).
/78.jpg)
За даними K. Kario і співавт., надмірний ранковий приріст АТ є незалежним прогностичним фактором розвитку церебральних ускладнень. Частота «німих» інфарктів головного мозку, за даними МРТ, при спостереженні протягом 3,5 року виявилась найбільшою (57 %) в групі пацієнтів із РП САТ > 55 мм рт.ст., достовірно (Р < 0,001) перевищуючи їх кількість (33 %) у пацієнтів з меншим його значенням. Частота розвитку інсульту за період спостереження сягала 19 % в групі з високим РП САТ проти 7,2 % в групі порівняння (Р = 0,004). Кількість інсультів, що розвинулись в ранкові години, сягала 60 % серед осіб зі значним РП АТ і 46 % — серед інших обстежених пацієнтів, а частота розвитку інсультів у нічні години становила відповідно 30 і 7,75 %. Автори вважають, що надмірний РП АТ небезпечніше за значне зниження АТ вночі за типом over-dipper [18]. В нашому дослідженні у пацієнтів з РАГ та наявністю атеросклеротичних бляшок у сонних артеріях виявлено достовірно (Р < 0,05) вищий ранковий приріст САТ порівняно з пацієнтами з РАГ без атеросклеротичних бляшок — відповідно 55,89 ± 2,35 мм рт.ст. і 47,65 ± 2,10 мм рт.ст. (Р = 0,03), що вказує на асоціацію між РП АТ та атеросклеротичним ураженням сонних артерій.
Відсоток пацієнтів з нормальним двофазним добовим ритмом АТ та недостатнім зниженням АТ у період сну (non-dipper) в обох групах був порівнянний. У групі РАГ пацієнтів з найнесприятливішим добовим ритмом АТ (nigh-peaker) було значно більше (13,9 %), ніж у групі ПРАГ (1,2 %). І, навпаки, надмірне зниження АТ в нічний період (over-dipper) зареєстровано у 12 % хворих із ПРАГ, проте було дуже рідкісним (2,8 %) у пацієнтів з РАГ.
Довготривала АГ призводить до ураження органів-мішеней — серця, судин, нирок, що зумовлює високий ризик розвитку серцево-судинних ускладнень. Зокрема, за даними Фремінгемського дослідження [19], збільшення індексу ММЛШ понад 116 г/м2 збільшує ризик серцево-судинних ускладнень в 3–4 рази порівняно з особами, в яких ІММЛШ менший за 75 г/м2 незалежно від наявності АГ. ГЛШ вважається потужним предиктором серцево-судинної захворюваності та смертності, зокрема раптової смерті.
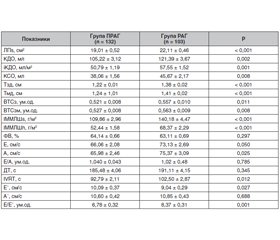
Ознаки ремоделювання ЛШ були виявлені в усіх обстежених пацієнтів, причому виключно концентричного характеру: концентрична ГЛШ (КГЛШ) була у 95,14 % пацієнтів групи РАГ та у 56 % пацієнтів групи ПРАГ, в інших — концентричне ремоделювання (КРЛШ), що може бути обумовлено довготривалим перебігом АГ зі значним підвищенням АТ. Важливо зазначити, що і в групі ПРАГ тривалий час до корекції лікування (призначення адекватної антигіпертензивної терапії) АТ був суттєво вищим за його цільові значення. Показники структури, систолічної та діастолічної функції ЛШ у групах РАГ і ПРАГ наведені в табл. 3.
/79.jpg)
Згідно з табл. 3, показники, що характеризують ГЛШ, були достовірно більшими в групі РАГ: Тзд, Тмд, ІММЛШs, ІММЛШh (Р = 0,0001 для всіх зазначених показників), більшою виявилась і порожнина ЛШ — КДО (Р = 0,002) та іКДО (Р = 0,001). ВТС ЛШ (при будь-якому її розрахунку — ВТСз і ВТСзм) у пацієнтів цієї групи була достовірно більша, ніж у групі ПРАГ (Р = 0,011 і Р = 0,008 відповідно). Незважаючи на виражену ГЛШ і більший об’єм порожнини ЛШ в групі РАГ, фракція викиду в обох групах була в межах нормальних значень, що свідчить про збереження його систолічної функції, і між групами суттєво не різнилась (Р = 0,297).
Відомо, що у пацієнтів з АГ, особливо за наявності ГЛШ, розвитку систолічної дисфункції ЛШ передує порушення його діастолічного наповнення. На більш виражену діастолічну дисфункцію (ДД) ЛШ в групі пацієнтів з РАГ перш за все вказує суттєво більша дилатація лівого передсердя в цій групі пацієнтів (Р < 0,001). Загалом у пацієнтів з РАГ порушення ДФ ЛШ були суттєвішими, ніж у групі ПРАГ. У всіх пацієнтів з РАГ були виявлені ознаки ДД ЛШ, причому у більшості з них — за ІІ типом (псевдонормалізація). В групі ПРАГ у більшості пацієнтів були виявлені ознаки порушення розслаблення ЛШ. Міжгрупове порівняння показників ДФ ЛШ виявило, що швидкість наповнення ЛШ в систолу передсердь (А) в групі РАГ достовірно (Р = 0,03) перевищувала таку в пацієнтів групи ПРАГ, що свідчить про більший внесок у наповнення ЛШ систоли передсердя. В групі РАГ пікова швидкість діастолічної хвилі раннього наповнення ЛШ (Е’) була достовірно більшою (Р = 0,03), час сповільнення швидкості раннього діастолічного наповнення (ДТ) дещо меншим, тривалість періоду ізоволюмічного розслаблення (IVRT) ЛШ та співвідношення Е/Е’ — достовірно (Р = 0,01 і Р = 0,001 відповідно) більшими в групі пацієнтів з РАГ (табл. 3). Незважаючи на відсутність суттєвої різниці між групами щодо сповільнення пасивного розслаблення ЛП, у групі РАГ порівняно з групою ПРАГ спостерігали уповільнення енергозалежної клітинної релаксації, на що вказують більші значення IVRT. Це підтверджує більш суттєве погіршення розслаблення ЛШ у хворих з РАГ, що є наслідком більш значного потовщення його стінок, ступеня гіпертрофії, наявності більш виражених змін геометрії ЛШ за концентричним типом (а саме концентричної ГЛШ у всіх пацієнтів з РАГ), а також збільшення порожнини ЛШ та вищого рівня АТ при офісному та амбулаторному вимірюванні в усі періоди доби, і особливо вночі.
Пацієнти з РАГ мали і достовірно більш виражені прояви гіпертензивної макроангіопатії, ніж пацієнти групи ПРАГ, про що свідчать більш виражені структурні зміни ЗСА: більша ТКІМ — 1,42 ± ± 0,05 мм проти 1,18 ± 0,04 мм (р = 0,001) та ДЗСА 8,39 ± 0,14 мм проти 7,39 ± 0,11 мм (р = 0,001).
Відповідно до останніх рекомендацій ЄТК/ЄТГ (2018), ТКІМ не розглядається як маркер ураження сонних артерій в силу значної залежності показника перш за все від віку [1]. Основним критерієм ураження сонних артерій у хворих на АГ є наявність атеросклеротичної бляшки. За нашими даними, у хворих із РАГ в 1,4 раза частіше, ніж у пацієнтів групи ПРАГ, були виявлені атеросклеротичні бляшки — відповідно у 80,0 і 58,3% (χ2 = 11,2; Р = 0,02). Виявлені зміни структури сонних артерій у пацієнтів з РАГ поєднувались з тенденцією до зниження максимальної систолічної швидкості кровотоку порівняно з пацієнтами з ПРАГ — 125,58 ± 5,62 м/с і 146,40 ± 5,98 м/с (Р = 0,05), достовірним зниженням діастолічної швидкості кровотоку по середніх мозкових артеріях — 52,5 ± 0,9 м/с і 61,5 ± 0,9 м/с (Р = 0,03), а також тенденцією до підвищення судинного опору, який відображає індекс цереброваскулярної резистивності — 162,00 ± 9,46 ум.од. і 149,23 ± 9,43 ум.од. (Р = 0,07).
Дослідження когнітивної функції виявило її зниження у пацієнтів обох груп: у пацієнтів з РАГ та ПРАГ середній бал МоСА становив відповідно 23,55 ± 0,41 і 23,06 ± 0,52 (Р = 0,59). Серед пацієнтів з РАГ найчастіше траплялись порушення таких когнітивних доменів, як увага — 41,8 %, вербальна швидкість — 50,7 %, відкладене повторення — 97 %. Для визначення факторів, що могли вплинути на стан когнітивної функції, пацієнти з РАГ були розподілені на дві підгрупи: І підгрупа (n = 69) — зі зниженою когнітивною функцією (МоСА < 26), ІІ підгрупа (n = 34) — зі збереженою когнітивною функцією (МоСА ≥ 26). Пацієнти зі зниженою когнітивною функцією мали більш виражені прояви гіпертензивної макроангіопатії, про що свідчили більші діаметр загальних сонних артерій (ЗСА) 8,53 ± 0,02 мм та ТКІМ — 1,16 ± 0,04 мм проти відповідно 8,33 ± ± 0,03 мм та 1,01 ± 0,06 мм у ІІ групі (Р < 0,05 в обох випадках), більшу ТКІМ в ділянці атеросклеротичної бляшки — відповідно 2,70 ± 0,17 мм та 1,69 ± 0,13 мм (Р < 0,05), що вказує на більші атеросклеротичні зміни сонних артерій. Окрім цього нами виявлено достовірно більший діаметр внутрішніх яремних вен — 10,91 ± 0,43 мм проти 9,22 ± 0,97 мм та збільшення швидкостей кровотоку по венах Ро-зенталя — 24,39 ± 0,21 мм проти 22,14 ± 0,50 мм (Р < 0,05 в усіх випадках), що може бути непрямим свідченням підвищення внутрішньочерепного тиску у цих пацієнтів та справляти додатковий негативний вплив на когнітивну функцію.
Показники, що характеризують функціональний стан нирок, між групами РАГ і ПРАГ також різнились. Гірші показники спостерігали у пацієнтів з РАГ. Так, хоча вміст у крові креатиніну в обох групах був у межах нормальних значень, але у пацієнтів з РАГ він виявився достовірно (Р = 0,04) вищим, ніж у групі ПРАГ (відповідно 94,5 ± 3,6 мкмоль/л і 85,2 ± 2,0 мкмоль/л), що обумовило менші значення ШКФ (відповідно в групах РАГ и ПРАГ — 75,6 ± 2,6 мл/хв/1,73 м2 і 83,5 ± 2,1 мл/хв/1,73 м2; Р = 0,02). При оцінці ШКФ за цистатином С зниження функ-ції нирок у пацієнтів з РАГ було ще більш вираженим — ШКФ становила 69,6 ± 2,0 мл/хв/1,73 м2, тоді як в групі ПРАГ показник ШКФ з цистатину С практично не відрізнявся від розрахункового значення за формулою СКD-EPI на основі креатиніну і становив 82,7 ± 2,3 мл/хв/1,73 м2. Відповідно концентрація цистатину С була вищою у пацієнтів з РАГ — 1,45 ± 0,09 мг/л) проти 1,14 ± 0,08 мг/л у пацієнтів з ПРАГ. Крім того, ще один ранній маркер ниркового ураження — мікроальбумінурія як за частотою, так і за величиною була більшою у пацієнтів групи РАГ. Добова ЕАС більше ніж удвічі перевищувала таку у пацієнтів з ПРАГ, становивши відповідно 43,5 ± 3,9 мг/добу і 20,4 ± 3,2 мг/добу (Р = 0,001).
Порівняльний аналіз активності показників РААС виявив такі особливості у пацієнтів з істинною РАГ: концентрація альдостерону плазми (КАП) була на 20,4 % вищою, ніж в групі ПРАГ 25,0 ± 1,7 нг/дл проти 19,9 ± 1,3 нг/дл (Р = 0,02). Вміст активного реніну в плазмі був вищим у пацієнтів з істинною РАГ на 55 %, проте різниця не досягла межі достовірності — 19,9 ± 5,1 нг/л проти 8,9 ± 1,5 нг/л (Р = 0,12). Рівень добової екскреції метанефринів із сечею (ЕМС), за яким оцінювали активність симпатоадреналової системи (САС), був на 21 % вищим у пацієнтів з істинною РАГ порівняно з хворими на ПРАГ — 159,8 ± 9,0 мкг/добу проти 126,8 ± 8,9 мкг/добу (Р = 0,03). За результатами кореляційного аналізу, КАП корелювала з показниками амбулаторного АТ: середньодобового САТ (r = 0,19; р = 0,03) і ДАТ (r = 0,21; р = 0,002), середньоденного САТ (r = 0,18; р = 0,02) і ДАТ (r = 0,21; р = 0,007), середньонічного САТ (r = 0,23; р = 0,005) і ДАТ (r = 0,24; р = 0,003). Проте не було встановлено значимого зв’язку між умістом активного реніну і ЕМС, з одного боку, та показниками офісного АТ і ДМАТ — з іншого.
Аналіз показників запального статусу засвідчив вищу активність системного запалення у пацієнтів з істиною РАГ порівняно з хворими на ПРАГ. На це вказують вищий уміст СРП на 17,3 % (р = 0,02), фібриногену на 10,6 % (р = 0,03), ІЛ-6 на 21,8 % (р = 0,01), ФНП-α на 13 % (р = 0,003) в групі хворих на істинну РАГ при порівнянні з групою ПРАГ. За результатами кореляційного аналізу, зростання вмісту СРП у крові прямо асоційоване з рівнем середньодобового (r = 0,382; р = 0,02) і середньоденного (r = 0,394; р = 0,01) САТ, а вміст фібриногену — з рівнем середньонічного САТ (r = 0,359; р = 0,02), що свідчить про можливу роль активації системного запалення у формуванні резистентності до терапії. З іншого боку, в дослідженні A. Cortez і співавт. було встановлено зв’язок між зростанням СРП та серцево-судинними ускладненнями у пацієнтів з істинною РАГ: підвищення рівня СРП > 3,8 ммоль/л асоціювалось зі зростанням відносного ризику комбінованої кінцевої точки (фатальні або нефатальні серцево-судинні події, смерть від усіх причин та серцево-судинна смерть) на 86 % при 9-річному спостереженні. Автори дійшли висновку, що рівень СРБ є незалежним предиктором погіршення перебігу РАГ, незалежним від показників ДМАТ та нічного підвищення АТ [15].
Аналіз зв’язку між показниками нейрогуморальних систем регуляції АТ та активністю запалення низької градації дозволив встановити пряму асоціацію між КАП та рівнем ІЛ-6 (r = 0,334; p = 0,03); вмістом активного реніну в крові, з одного боку, та ІЛ-6 (r = 0,416; р = 0,01) і ФНП-α (r = 0,323; р = 0,03) — з іншого.
Висновки
1. Пацієнти з РАГ характеризуються вищим рівнем офісного і амбулаторного АТ, великою частотою (до 14 %) порушень добового ритму АТ за типом nigh-peaker та високим ранковим приростом АТ. Для пацієнтів з РАГ характерною рисою є більш висока порівняно з хворими на ПРАГ активність РААС і САС, проте рівень АТ (за даними офісних і амбулаторних вимірювань) корелює лише з концентрацією альдостерону в крові.
2. Для пацієнтів з РАГ порівняно з хворими із псевдорезистентністю характерним є більша частота та вираженість гіпертензивного ураження серця (концентрична ГЛШ в 95 % випадків, більший ІММ ЛШ та більш значні порушення діастолічної функції ЛШ), сонних артерій (наявність атеросклеротичних бляшок у 80 % та зниження швидкісних характеристик кровотоку) і нирок (більш суттєве зниження розрахункової ШКФ, особливо при розрахунку за цистатином С та більша екскреція альбуміну з сечею).
3. Пацієнтам з істинною РАГ притаманні більш виражені ознаки активації системного запалення низької градації, ніж при псевдорезистентності, що засвідчує вищий вміст у крові білків гострої фази запалення (СРП на 17,3 %, фібриногену на 10,6 %) і прозапальних цитокінів (ІЛ-6 на 21,8 %, ФНП-α на 13 %). Зростання активності системного запалення низької градації асоціюється з відносною активацією РААС у пацієнтів з істинною РАГ, на що вказує кореляційний зв’язок концентрації альдостерону в плазмі з рівнем ІЛ-6, а також вмісту активного реніну з рівнем ІЛ-6 і ФНП-ɑ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Willams B., Mancia G. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur. Heart. J. 2018. Vol. 39(33). P. 3021-104 doi: 10.1093/eurheartj/ehy339.
2. Calhoun D.A. Resistant hypertension: diagnosis, evaluation, and treatment: a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research. Circulation. 2008. Vol. 117. P. e510-e526.
3. Pierdomenico S.D. Cardiovascular outcome in treated hypertensive patients with responder, masked, false resistant, and true resistant hypertension. Am. J. Hypertens. 2005. Vol. 18. P. 1422-1428.
4. Whelton P.K., Carey R.M., Aronow W.S. et al. ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018. Vol. 71(6). P. е13-115. doi: 10.1161/HYP.0000000000000065.
5. Vardeny О. Resistant hypertension is associated with an increased risk for incident heart failure in the Аric Study. JACC. 2014. Vol. 63.
6. Gifford R.W. Resistant hypertension: introduction and definitions. Hypertension. 1988. Vol. 11.
7. Frohlich E.D. Classification of resistant hypertension. Hypertension. 1988. Vol. 11. № 3. Suppl. 2. P. 67-70.
8. Mancia G. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J. Hypertens. 2013. Vol. 31(7). P. 1281-1357.
9. Cuspidi C. High prevalence of cardiac and extracardiac target organ damage in refractory hypertension. J. Hypertens. 2001. Vol. 19. № 11. Р. 2063-2070.
10. Persell S.D. Prevalence of resistant hypertension in the United States, 2003–2008. Hypertension. 2011. Vol. 57. P. 1076-1080.
11. Daugherty S.L., Powers J.D., Magid D.J., Tavel H.M., Masoudi F.A., Margolis K.L. et al. Incidence and prognosis of resistant hypertension in hypertensive patients. Circulation. 2012. Vol. 125. P. 1635-1642.
12. Smith S.M. Epidemiology, prognosis, and treatment of resistant hypertension. Pharmacotherapy. 2013. Vol. 33. P. 1071-1086.
13. Duprez D.A. Role of the rennin-angiotensin-aldosterone system in vascular remodeling and inflammation: a clinical review. J. Hypertens. 2006. Vol. 24. P. 983-991.
14. Barbaro N.R., Fontana V., Modolo R., De Faria A.P., Sabbatini A.R., Fonseca F.H., Anhe G.F., Moreno H. Increased arterial stiffness in resistant hypertension is associated with inflammatory biomarkers. Blood Press. 2015. Vol. 24. P. 7-13.
15. Cortez A.F., Muxfeldt E.S., Cardoso C.R., Salles G.F. Prognostic value of C-reactive protein in resistant hypertension. Am. J. Hypertens. 2016. Vol. 29. № 8. P. 992-1000.
16. Tsioufis C. Pathophysiology of resistant hypertension: the role of sympathetic nervous system. Int. J. Hypertens. 2011. 642416.
17. Kario K., Pickering TG., Umeda Y. et al. Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensive patients. A prospective study. Circulation. 2003. Vol. 107. P. 1401-1406
18. Levy D., Garrison R.J., Savage D.D. et al. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Heart Study. N. Engl. J. Med. 1990. Vol. 322. P. 1561-1566.
19. Mancia G. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J. Hypertens. 2013. Vol. 31(7). P. 1281-1357.
20. Williams B., MacDonald T., Morant S., Webb D., Sever P. et al. Spironolactone versus placebo, bisoprolol, and doxazosin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomised, double-blind, crossover trial. Lancet. 2015. Vol. 386(10008). P. 2059-2068.
21. Calhoun D., White W. Effectiveness of the selective aldosterone blocker, eplerenone, in patients with resistant hypertension. J. Am. Soc. Hypertens. 2008. Vol. 2(6). P. 462-468.

/78.jpg)
/79.jpg)