Журнал "Гастроэнтерология" Том 53, №2, 2019
Вернуться к номеру
Зв’язок імунологічних та біохімічних показників у хворих на хронічні дифузні захворювання печінки залежно від етіологічних факторів розвитку стеатозу і фіброзу печінки
Авторы: Діденко В.І., Кленіна І.А., Татарчук О.М., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Мета: визначити взаємозв’язок показників імунітету з основними біохімічними показниками у хворих на хронічні дифузні захворювання печінки (ХДЗП) залежно від етіологічних факторів розвитку стеатозу та фіброзу печінки. Матеріали та методи. Обстежено 120 хворих на ХДЗП віком від 19 до 78 років, із них 77 жінок (64,2 %) та 43 чоловіки (35,8 %). Розподіл хворих на групи відбувався залежно від етіологічного фактора розвитку стеатозу та фіброзу печінки. І групу становили 24 хворі на неалкогольну жирову хворобу печінки (НАЖХП) зі стеатозом, ІІ — 37 пацієнтів із неалкогольним стеатогепатитом (НАСГ), ІІІ — 21 хворий на хронічний вірусний гепатит, асоційований із вірусом С, до ІV групи ввійшли 18 пацієнтів з алкогольною хворобою печінки (АХП), до V групи — 20 пацієнтів із токсичним гепатитом медикаментозного генезу (ТГМ). Контрольну групу становили 30 практично здорових осіб. Для характеристики обміну ліпідів у сироватці крові визначали рівень загального холестерину (ХС), холестерину ліпопротеїнів низької щільності. Оцінку ліпідного спектра сироватки крові проводили шляхом визначення вмісту тріацилгліцеринів (ТГ), ліпопротеїнів високої щільності (ХС ЛПВЩ), розраховували коефіцієнт атерогенності (КА). Процеси фіброзу оцінювали за вмістом оксипроліну вільного (ОПв) й оксипроліну білковозв’язаного, гексозаміну та гіалуронової кислоти. Наявність ендогенної інтоксикації визначали за вмістом середньомолекулярних пептидів (СМП). Визначено вміст основних показників клітинного імунітету, вміст циркулюючих імунних комплексів (ЦІК) та рівень інтерлейкіну (IL)-6, IL-10, фактора некрозу пухлини альфа (TNF-α). Проведено кореляційний аналіз між вивченими біохімічними та імунологічними показниками в обстежених хворих. Результати. Отримані дані у хворих на ХДЗП вказують на активні запальні процеси. Про це свідчило підвищення рівня прозапальних цитокінів (IL-6 та TNF-α), СМП. Гіперпродукція IL-6 супроводжується зниженням загальних фосфоліпідів (ФЛ) у сироватці крові пацієнтів із НАЖХП, НАСГ та ТГМ: виявлено середній кореляційний взаємозв’язок між IL-6 та ФЛ (r = –0,44, р < 0,05; r = –0,45, р < 0,01; r = –0,44, р < 0,05 відповідно в пацієнтів цих груп). У пацієнтів із НАСГ встановлено, що підвищений рівень ЦІК супроводжувався порушенням ліпідного обміну, а саме підвищенням КА сироватки крові — ЦІК/КА (r = +0,39, р < 0,05) та зниженням антиатерогенної фракції ХС ЛПВЩ сироватки крові — ЦІК/ХС ЛПВЩ (r = –0,36, р < 0,05), про що свідчить виявлений середній кореляційний взаємозв’язок. Показано, що підвищення рівня TNF-α паралельно супроводжується явищем ендотоксемії в пацієнтів із НАЖХП, про що свідчив середній кореляційний взаємозв’язок між TNF-α та СМП (r = +0,54, р < 0,05). Підвищення вмісту Т-цитотоксичних лімфоцитів супроводжувалося зниженням рівня ХС ЛПВЩ та ТГ у сироватці крові, що підтверджується середніми кореляційними взаємозв’язками між рівнем СD8+-лімфоцитів та холестерину ліпопротеїдів дуже високої щільності (r = –0,53, р < 0,05) та ТГ (r = –0,53, р < 0,05) відповідно в пацієнтів з АХП. Крім того, у цієї групи пацієнтів була виявлена відсутність активації продукції IL-10 у відповідь на запалення, що супроводжується зниженням деградації зрілих нерозчинних колагенів, про що свідчив середній кореляційний взаємозв’язок між IL-10 та ОПв (r = –0,64, р < 0,01). Висновки. Отримані дані вказують на взаємозв’язок між імунологічними та біохімічними показниками у хворих на ХДЗП залежно від етіологічних факторів розвитку стеатозу і фіброзу печінки.
Цель: определить взаимосвязь показателей иммунитета с основными биохимическими показателями у больных с хроническими диффузными заболеваниями печени (ХДЗП) в зависимости от этиологических факторов развития стеатоза и фиброза печени. Материалы и методы. Обследовали 120 больных с ХДЗП в возрасте от 19 до 78 лет, из них 77 женщин (64,2 %) и 43 мужчины (35,8 %). Распределение больных на группы осуществлялось в зависимости от этиологического фактора развития стеатоза и фиброза печени: І группу составили 24 больных с неалкогольной жировой болезнью печени (НАЖБП), ІІ — 37 пациентов с неалкогольным стеатогепатитом (НАСГ), ІІІ — 21 больной с хроническим вирусным гепатитом, ассоциированным с вирусом С, в ІV группу вошли 18 пациентов с алкогольной болезнью печени (АБП), в V — 20 пациентов с токсическим гепатитом медикаментозного генеза (ТГМ). Контрольную группу составили 30 практически здоровых людей. Для характеристики обмена липидов в сыворотке крови определяли уровень общего холестерина (ХС), холестерина липопротеинов низкой плотности. Оценку липидного спектра сыворотки крови проводили путем определения содержания триацилглицеринов (ТГ), липопротеинов высокой плотности (ХС ЛПВП), рассчитывали коэффициент атерогенности (КА). Процессы фиброза оценивали по содержанию оксипролина свободного (ОПсв) и оксипролина белковосвязанного, гексозамина и гиалуроновой кислоты. Наличие эндогенной интоксикации определяли по содержанию среднемолекулярных пептидов (СМП). Определяли основные показатели клеточного иммунитета, уровень циркулирующих иммунных комплексов (ЦИК) и уровень интерлейкина (IL)-6, IL-10, фактора некроза опухоли альфа (TNF-α). Проведен корреляционный анализ между биохимическими и иммунологическими показателями у обследованных больных. Результаты. Полученные данные у больных с ХДЗП указывают на активные воспалительные процессы. На это указывает повышение уровня провоспалительных цитокинов (IL-6 и TNF-α), СМП. Гиперпродукция IL-6 сопровождается снижением общих фосфолипидов (ФЛ) в сыворотке крови пациентов с НАЖБП, НАСГ и ТГМ: выявлена средняя корреляционная взаимосвязь между IL-6 и ФЛ (r = –0,44, р < 0,05; r = –0,45, р < 0,01; r = –0,44, р < 0,05 соответственно у пациентов этих групп). У пациентов с НАСГ установлено, что повышение уровня ЦИК сопровождается нарушением липидного обмена, а именно повышением КА сыворотки крови — ЦИК/КА (r = +0,39, р < 0,05) и снижением антиатерогенной фракции ХС ЛПВП сыворотки крови — ЦИК/ХС ЛПВП (r = –0,36, р < 0,05), о чем свидетельствует установленная средняя корреляционная взаимосвязь. Показано, что повышение уровня TNF-α параллельно сопровождается явлением эндотоксемии у пациентов с НАЖБП, о чем свидетельствует средняя корреляционная взаимосвязь между TNF-α и СМП (r = +0,54, р < 0,05). Повышение содержания Т-цитотоксических лимфоцитов сопровождалось снижением ХС ЛПВП и ТГ сыворотки крови, что подтверждается средней корреляционной взаимосвязью между уровнем СD8+-лимфоцитов и холестерина липопротеинов очень высокой плотности (r = –0,53, р < 0,05) и ТГ (r = –0,53, р < 0,05) соответственно у пациентов с АБП. Кроме того, у этой группы пациентов отсутствует активация продукции IL-10 в ответ на воспаление, что сопровождается снижением деградации зрелых нерастворимых коллагенов, о чем свидетельствует средняя корреляционная взаимосвязь между IL-10 и ОПсв (r = –0,64, р < 0,01). Выводы. Полученные данные указывают на взаимосвязь между иммунологическими и биохимическими показателями у больных с ХДЗП в зависимости от этиологических факторов развития стеатоза и фиброза печени.
Background. The purpose was to determine the relationship of immunity indicators with the main biochemical parameters in patients with chronic diffuse liver diseases, depending on the etiological factors of steatosis and liver fibrosis. Materials and methods. We examined 120 patients with chronic diffuse liver diseases. They were divided according to the etiological factor of steatosis and liver fibrosis: group I — 24 patients with non-alcoholic fatty liver disease (NAFLD), group ІІ — 37 persons with non-alcoholic steatohepatitis (NASH); group III — 21 people with chronic viral hepatitis associated with C virus; group IV consisted of 18 patients with alcoholic liver disease (ALD), group V — 20 individuals with toxic drug-induced hepatitis (TDIH). To characterize the metabolism of lipids in serum, total cholesterol, low-density lipoproteins were determined. Serum lipids were evaluated by determining the content of triacylglycerols (TG), high-density lipoproteins (HDL), atherogenic index (AI) was calculated. The processes of fibrosis were assessed by the content of hydroxyproline free (HPf) and hydroxyproline protein-bound, hexosamine and hyaluronic acid. The presence of endogenous intoxication was determined by the content of medium molecular peptides (MMP). The content of cellular immunity parameters, the level of circulating immune complexes (CIC), interleukins (IL) 6, 10, tumor necrosis factor α (TNF-α), insulin and HOMA-IR were determined. A correlation analysis was made of biochemical and immunological parameters in the examined patients. Results. The data obtained in patients with chronic diffuse liver disease show active inflammatory processes. This is indicated by increased levels of pro-inflammatory cytokines (IL-6 and TNF-α), MMP. IL-6 overproduction is accompanied by a decrease in total phospholipids (PL) in the blood serum of patients with NAFLD, NASH and TDIH — an average correlation was found between IL-6 and PL (r = –0.44, p < 0.05; r = –0.45, p < 0.01; r = –0.44, p < 0.05, respectively). In patients with NASH, an increase in CIC level is accompanied by impaired lipid metabolism, namely, an increase in serum AI — CIC/AI (r = +0.39, p < 0.05) and a decrease in the anti-atherogenic fraction of CIC/HDL (r = –0.36, p < 0.05), as evidenced by the established average correlation. It was shown that an increase in the level of TNF-α in parallel is associated with phenomenon of endotoxemia in patients with NAFLD, as evidenced by the average correlation between TNF-α and MMP (r = +0.54, p < 0.05). An increase in T-cytotoxic lymphocytes was accompanied by a decrease in serum HDL and TG, as evidenced by an average correlation: between CD8+ lymphocytes and HDL (r = –0.53, p < 0.05) and TG (r = –0.53, p < 0.05), respectively, in patients with ALD. In addition, in this group of patients, there was no activation of IL-10 production in response to inflammation, which was associated with a decrease in the degradation of mature insoluble collagens, as indicated by the average correlation between IL-10 and HPf (r = –0.64, p < 0.01). Conclusions. The data obtained indicate the relationship between immunological and biochemical parameters in patients with chronic diffuse liver diseases depending on the etiological factors of steatosis and liver fibrosis.
хронічні дифузні захворювання печінки; ліпіди; оксипролін; імунітет; цитокіни
хронические диффузные заболевания печени; липиды; оксипролин; иммунитет; цитокины
chronic diffuse liver diseases; lipids; hydroxyproline; immunity; cytokines
Вступ
Патологія печінки посідає провідне місце серед хвороб органів травлення. Кожного року в країнах СНД реєструється від 500 тис. до 1 млн осіб, які страждають від захворювання печінки. В Україні за останні 10 років поширеність захворювань печінки збільшилась на 20,1 % [1]. Серед цих захворювань — хронічні дифузні захворювання печінки (ХДЗП), що перебігають із достатньо неспецифічними клінічними проявами [2]. До етіологічних факторів хронічних дифузних захворювань печінки відносять хронічний вірусний гепатит, захворювання біліарного тракту, зловживання алкоголем, токсичні фактори, в тому числі вживання лікарських засобів [3].
ХДЗП, які пов’язані з гепатотропними вірусами, є важливою проблемою сучасної медицини. В патогенезі хронічних гепатитів (ХГ) та прогресуванні їх у цироз печінки велике значення має порушення внутрішньопечінкової гемодинаміки [4]. Слід відмітити, що при фіброзі печінки відбувається посилений розпад вуглеводно-білкових компонентів сполучної тканини — гексозамінів (ГА), підвищення їх вмісту свідчить про активність запального процесу, тривалість якого призводить до деструкції тканин печінки. Визначення сироваткових маркерів фіброзу необхідно для диференціальної діагностики цирозу та нецирозу печінки, оцінки ступеня фіброзу печінки, моніторингу функції даного органа в період проведення лікувальної терапії [5–7].
При захворюваннях печінки розвивається порушення метаболізму компонентів ліпідного спектра — холестерину (ХС) і його ефірів, тріацилгліцеринів (ТГ), неетерифікованих жирних кислот (НЕЖК) [8, 9]. В дослідженнях останнього часу показано, що центральну роль у патогенезі захворювань печінки відіграють цитотоксичні НЕЖК, які пов’язані з акумуляцією внутрішньопечінкових тріацилгліцеринів. До їх надмірного накопичення в гепатоцитах може призводити пригнічення утворення ліпопротеїдів, фосфоліпідів (ФЛ) — основних транспортних форм ТГ, які сприяють їх виведенню з печінки [10]. Концентрації ТГ у крові надають велике значення як важливому маркеру стеатозу печінки, причому гіпертригліцеринемія більшою мірою, ніж гіперхолестеринемія, сприяє розвитку цієї патології [11]. НЕЖК є субстратом перекисного окиснення ліпідів, продукти якого у великих концентраціях дуже токсичні для клітинних мембран [12].
Цитокінам надають важливу роль у патогенезі гастродуоденальних уражень. За вмістом сироваткових про- та протизапальних цитокінів оцінюють не лише активність генералізованого запального процесу, а й результативність лікування, прогнозують перебіг захворювання, виникнення їх загострень [13]. Вони є невід’ємними учасниками імунних реакцій, оскільки залучені в кожну ланку імунітету і запалення, включаючи диференціювання попередників клітин імунної системи, представлення антигена, клітинну активацію та проліферацію, експресію молекул адгезії, продукцію білків гострої фази [13, 14].
Цитокіни — антигеннеспецифічні чинники. Тому специфічна діагностика за допомогою визначення рівня цитокінів неможлива. Але визначення їх концентрації в крові дає інформацію про функціональну активність різних типів імунокомпетентних клітин, тяжкість запального процесу, його переходу на системний рівень і про прогноз захворювання [15].
До активації системи цитокінів призводить будь-яка реакція системи імунного захисту організму на інфекційну агресію або інші чинники, які викликають запалення гепатоцитів, спричиняють патохімічні та патоморфологічні порушення в організмі хворих. Цитокіни — це низькомолекулярні білкові клітинні медіатори, які беруть участь у процесах міжклітинної регуляції. За даними багатьох авторів, серед медіаторів запалення найбільша роль у патогенезі гепатитів відведена фактору некрозу пухлини альфа (TNF-α). TNF-α — це поліпептидний цитокін, що вважають основним в ініціації багатьох патофізіологічних відповідей організму. Вплив TNF-α на клітини реалізується через рецептори, які розташовані на поверхні більшості клітин людини [16]. Слід відмітити, що експресія й активність як TNF-α, так і його рецепторів (TNFα-RI, TNFα-RIІ) тісно зв’язані з мембранами клітин. Тому реалізація дії цього цитокіну залежить від стану мембрани клітини, насамперед особливостей ліпідного біопрошарку. Взаємодія TNF-α з рецепторами зумовлює активацію факторів транскрипції, які є регуляторами генів широкого спектра медіаторів, таких як інтерлейкіни та фактори росту, серед яких фактор росту гепатоцитів (HGF) є найбільш важливим у регулюванні регенеративних процесів печінки [17, 18].
При гіперінсулінемії, що є наслідком інсулінорезистентності, тривалий час у крові може утримуватися нормальний вміст глюкози (нормоглікемія) при збереженій здатності клітин острівцевого апарату адекватно реагувати на гіперглікемію. Але постійна стимуляція β-клітин і дія підвищеної кількості вільних жирних кислот на них сприяють виникненню секреторної недостатності, зниженій секреції інсуліну з наступним розвитком порушення толерантності до глюкози та виникненням цукрового діабету 2-го типу. Надлишок інсуліну посилює синтез холестерину (ХС), холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) та ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ), а також гальмує процеси ліполізу. Відомо, що порушення ліпідного обміну у вигляді збільшення рівня ХС ЛПНЩ призводять до зниження клітинних імунологічних реакцій. ХС ЛПНЩ та ХС ЛПДНЩ знижують продукцію інсуліну β-клітинами острівців Лангерганса [19].
У фізіологічних умовах конститутивна генерація прозапальних цитокінів (TNF-α та IL-6) відсутня або в печінці рівень її мінімальний. Однак патологічні подразники, такі як накопичення ліпідів, індукують печінкові клітини виробляти ці молекули запалення. Цитокіни відіграють активну роль у розвитку та прогресуванні неалкогольного стеатогепатиту (НАСГ) через стимуляцію печінкового запалення, некрозу й апоптозу клітин і індукцію фіброзу [20, 21].
Мета дослідження: визначити взаємозв’язок показників імунітету з основними біохімічними показниками у хворих на ХДЗП залежно від етіологічних факторів розвитку стеатозу та фіброзу печінки.
Матеріали та методи
Під спостереженням перебували 120 хворих на ХДЗП віком від 19 до 78 років, із них 77 жінок (64,2 %) та 43 чоловіки (35,8 %). Всі хворі були на стаціонарному лікуванні у відділенні захворювань печінки та підшлункової залози ДУ «Інститут гастроентерології НАМН України».
Розподіл хворих на групи відбувався залежно від етіологічного фактора розвитку стеатозу та фіброзу печінки. І групу становили 24 пацієнти з неалкогольною жировою хворобою печінки (НАЖХП) зі стеатозом (без запалення), ІІ — 37 хворих на НАСГ, ІІІ група представлена 21 хворим на ХГС. У ІV групу увійшли 18 пацієнтів з алкогольною хворобою печінки (АХП), в V групу — 20 пацієнтів із токсичним гепатитом медикаментозного генезу (ТГМ). Контрольну групу становили 30 практично здорових осіб.
Для характеристики обміну ліпідів у сироватці крові визначали ХС, холестерин ліпопротеїнів низької щільності. Оцінку ліпідного спектра сироватки крові проводили шляхом визначення вмісту ТГ, ХС ліпопротеїнів високої щільності (ЛПВЩ), розраховували коефіцієнт атерогенності (КА) за Фрідвальдом. Процеси фіброзу оцінювали за вмістом оксипроліну вільного (ОПв), оксипроліну білковозв’язаного (ОПб/з) та ГА. У сироватці крові вміст ХС досліджували, використовуючи набори біотесту Cormey, вміст ГА — за Ремінгтоном, ОПб/з та ОПв — за методом М.А. Осадчука. Рівень ендогенної інтоксикації визначали за вмістом середньомолекулярних пептидів (СМП) за методом В.В. Ніколайчука.
Субпопуляційний склад лімфоцитів визначали за допомогою моноклональних антитіл фірми «Сорбент ТМ» до молекул СD3, СD19, СD4, СD8, СD16. Циркулюючі імунні комплекси (ЦІК) визначали за методом V. Haskova. Вміст інтерлейкінів (IL) — IL-6, IL-10 та фактора некрозу пухлини α (TNF-α) у сироватці крові визначали імуноферментним методом із використанням наборів реактивів фірми «Вектор-БЕСТ» (м. Новосибірськ). Імуноферментний аналіз проводили за допомогою аналізатора Stat Fax 303 Plus (США).
Усі вихідні дані, отримані при виконанні роботи, з метою оптимізації математичної обробки вводились у базу даних, побудовану за допомогою електронних таблиць Microsoft Excel. Для статистичного аналізу даних використовували: М — середнє значення показника, m — помилку визначення середнього, порівняння середніх значень змінних здійснювали за допомогою параметричного методу (t-критерію Стьюдента) за умов нормального розподілу даних ознак, що виражені в інтервальній шкалі. Відповідність виду розподілу ознак закону нормального розподілення перевіряли за допомогою методу Шапіро — Уїлка. В інших випадках використовували непараметричний метод (U-критерій Манна — Уїтні). Статистичну значущість оцінювали на рівні не нижче ніж 95,0 % (р < 0,05). Вираженість взаємозв’язків між змінними оцінювали за допомогою значущих коефіцієнтів кореляції Пірсона (r).
Результати та обговорення
Результати біохімічних досліджень сироватки крові свідчать про вірогідність змін багатьох середньостатистичних біохімічних показників у хворих на ХДЗП (рис. 1).
Малоінвазивний метод оцінки фіброзу тканини/відкладення колагену — це визначення концентрації ОПб/з та ОПв у сироватці крові. Дослідження змін концентрації цих показників дає важливу інформацію про біохімічні та патологічні процеси фіброзу органа. Підвищення рівня ОПб/з свідчить про посилений синтез, утворення молодого незрілого колагену, ОПв — показник деградації колагену.
У 100,0 % хворих на НАЖХП виявлено тенденцію до активації синтезу колагену, про що свідчило підвищення вмісту в сироватці крові ОПб/з у 1,7 раза (рис. 1). Рівень продуктів розпаду сполучної тканини (ОПв) мав тенденцію до зниження у 100 % пацієнтів у 2,4 раза (p < 0,001) (рис. 2).
Аналіз маркерів ендогенної інтоксикації: СМП виявив поглиблення ендотоксикозу у 100,0 % хворих, у яких їх вміст підвищувався в 1,6 раза (p < 0,001), прогресування запального процесу супроводжується вираженою ендогенною інтоксикацією.
Порівняно з пацієнтами із НАЖХП у пацієнтів із НАСГ запальні процеси мали менш виражений характер, вміст СМП залишався підвищеним у 1,5 раза (р < 0,001).
У 95,2 % хворих на ХГС суттєво підвищений вміст ОПб/з — у 2,2 раза (р < 0,001) свідчив про наявність фіброзних змін та супроводжувався підвищенням у 2,4 раза вмісту ОПв у 28,6 % хворих до (20,6 ± 3,5) мкмоль/л. У 61,9 % пацієнтів із ХГС запальні процеси мали менш виражений характер порівняно з хворими на НАЖХП та НАСГ, вміст СМП був підвищеним у 1,4 раза (p < 0,001).
У 55,6 % пацієнтів із АХП виявлені підвищення вмісту СМП у 1,7 раза (p < 0,001) та підвищення синтезу ОПб/з та його вмісту в сироватці крові у 2,4 раза — (308,6 ± 19,9) мкмоль/л (р < 0,001). У хворих цієї ж групи спостерігалося підвищення вмісту ГА в 1,6 раза — до (7,2 ± 0,1) ммоль/л.
У пацієнтів із ТГМ про процеси посилення анаболізму сполучної тканини свідчила тенденція до зростання вмісту ОПб/з у 100,0 % пацієнтів у 2,3 раза, а про зниження катаболізму — зменшення вмісту ОПв у 2,3 раза у 35,0 % пацієнтів відносно контролю. У 80,0 % пацієнтів вміст ГА був без особливостей та становив норму.
Явище ендотоксемії мало місце в 90,0 % пацієнтів, у яких вміст СМП підвищувався в 1,8 раза (p < 0,001).
Таким чином, у всіх пацієнтів із ХДЗП була виявлена наявність ендотоксемії, яка була найбільш виреженою в пацієнтів із НАЖХП та в пацієнтів із токсичним гепатитом медикаментозного генезу. Дисбаланс між процесами анаболізму та катаболізму за рівнем ОПб/з та ОПв у сироватці крові спостерігався у всіх пацієнтів із ХДЗП.
Внутрішньогруповий аналіз вмісту ОПв показав, що в пацієнтів із НАЖХП та НАСГ реєструвалося лише його зниження, тоді як у пацієнтів із ХГС, АХП та ТГМ реєструвалося як його зниження (у 14,3; 22,2 та 15,0 % відповідно), так і підвищення — у 28,6, 33,3 та 35,0 % хворих відповідно, що відображає інтенсивність розкладу зрілих нерозчинних колагенів. У пацієнтів всіх груп виявлено підвищення співвідношення ОПб/з/ОПв у середньому у 2,2 раза порівняно з контролем, що свідчить про переважання процесів синтезу колагену над його деградацією в пацієнтів із ХДЗП.
ХС в організмі обмінюється між різними тканинами, тому його сироваткова концентрація відображає загальний вміст даного ліпіду в організмі, у сироватці крові хворих НАЖХП та НАСГ його вміст підвищувався до (6,20 ± 0,34) ммоль/л та (5,85 ± 0,22) ммоль/л відповідно.
У хворих на ХГС та АХП спостерігалася знижена концентрація ХС у 1,3 раза порівняно з групою контролю. Ці зміни при ураженні печінки свідчать про порушення етерифікації ХС та зниження сироваткової концентрації його ефірів.
Це може бути пов’язано зі зниженням синтезу ХС та його ефірів, зменшенням утворення апопротеїнів або обома факторами.
У 23,8 % хворих на ХГС та 27,8 % — АХП реєструвалися зниження вмісту ТГ у середньому в 1,3 раза й антиатерогенної фракції ХС ЛПВЩ у 33,3 % до (0,71 ± 0,08) ммоль/л та в 55,6 % — до (0,69 ± 0,07) ммоль/л відповідно та мало глибший характер у пацієнтів із ХГС. За рахунок різнонаправлених змін у ліпопротеїновому профілі пацієнтів цих груп спостерігалося підвищення КА у 28,5 та 50 % відповідно. Серед хворих на ХГС та АХП виявлено зниження вмісту ФЛ у 47,7 % до (1,46 ± 0,06) ммоль/л та 28,5 % до (1,5±0,4) ммоль/л відповідно.
У пацієнтів із ТГМ виявлено підвищений вміст ХС у 45,0 % до (6,51 ± 0,44) ммоль/л, зниження вмісту ФЛ у 50 % до (1,73 ± 0,04) мммоль/л. Підвищення КА сироватки крові реєструвалося в 35 % пацієнтів.
Ми вивчили імунологічні показники у хворих на ХДЗП. Встановлено вірогідне зниження середніх значень відносного рівня СD4+-лімфоцитів у групах із НАЖХП та АХП — в 1,4 раза (р < 0,05), у НАСГ — в 1,5 раза (р < 0,05), у групах із ХГС та ТГ — в 1,3 раза (р < 0,05) порівняно з контрольною групою (рис. 4).
Результати кореляційного дослідження показали, що у хворих на ХГС СD4+-клітини стимулюють продукцію антитіл В-лімфоцитами (r = +0,67, р < 0,01) й активують СD8+ Т-клітини (r = +0,81, р < 0,01), специфічні для вірусінфікованих клітин. Цитотоксична імунна відповідь повинна вмикати неспецифічну ланку — СD16+ й антигеннеспецифічну ланку — цитотоксичні лімфоцити, що повинно забезпечувати захист організму від внутрішньоклітинних патогенів, в тому числі від вірусів. У хворих на НАСГ та АХП визначена тенденція до зниження СD16+, тоді як у хворих на НАЖХП, ХГС та ТГМ встановлено вірогідне зниження його рівня (в 1,2, 1,3 та 1,4 раза, р < 0,05) відносно групи контролю відповідно. Крім того, у хворих групи з ТГМ це зниження було вірогідне відносно групи з НАСГ.
Отже, активація В-лімфоцитів вказує на активацію гуморальної ланки імунітету, що, однак, не призводить до елімінації патогена у хворих на ХГС. Надлишок антитіл сприяє посиленню цитотоксичних реакцій і призводить до імунокомплексного ураження печінки. Ліпопротеїнові мембрани гепатоцитів можуть набути властивості чужорідного антигена, що індукує атаку Т-кілерів, що закінчується лізисом клітин-мішеней, тобто паренхіми печінки. Важливе прогностичне значення в перебігу процесу має співвідношення лімфоцитів СD4/СD8 — імунорегуляторний індекс. Порушення (зниження) індексу імунорегуляції встановлено в половини хворих на НАЖХП, у 56,8 % — на НАСГ, у 76,2 % — на ХГС, що вказує на недостатність клітинного імунітету.
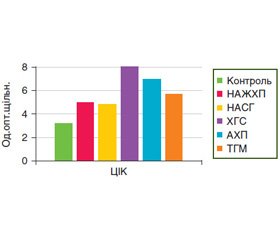
ЦІК — фізіологічний продукт реакції «антиген — антитіло», який є частиною захисних імунних механізмів. Утворення імунних комплексів є інтегральним показником розвитку гуморальної імунної відповіді. Деякий рівень імунних комплексів повинен постійно бути наявним у крові для реалізації фізіологічних процесів підтримки гомеостазу. Більше того, це вказує на адекватну реакцію організму на зовнішній вплив. У 62,5 % хворих на НАЖХП, у 51,4 % — на НАСГ, у 81,0 % — на ХГС, у 66,7 % — на АХП та в 75,0 % — на ТГМ рівень ЦІК був вірогідно підвищений (р < 0,05) (рис. 5).
У хворих на ХГС рівень ЦІК вірогідно підвищений відносно групи хворих на НАСГ (в 1,7 раза, р < 0,05). Але необхідно відзначити, що при надмірному накопиченні ЦІК за рахунок підвищеної продукції або недостатньому їх видаленню з організму можливий перехід у бік патології, який обумовлений підвищенням біологічної активності імунних комплексів, і при особливих умовах вони можуть відігравати важливу роль у патогенезі НАСГ, на що вказує кореляційний зв’язок між рівнем ЦІК та IL-6 (r = +0,37, р < 0,05), та КА (r = +0,38, р < 0,05), та ФЛ (r = –0,45, р < 0,01) та ХС ЛПВЩ (r = –0,36, р < 0,05). Крім того, ЦІК корелював із рівнем Т-хелперів у хворих на НАСГ (r = –0,37, р < 0,05) та у хворих на ХГС (r = –0,52, р < 0,05). У хворих на ХГС установлено позитивний кореляційний зв’язок між рівнем ЦІК та рівнем цитолітичних ферментів: АЛТ (r = +0,47, р < 0,05) та АСТ (r = +0,68, р < 0,01), з ОПб/з (r = +0,60, р < 0,01). У хворих на АХП визначено позитивний помірний зв’язок між рівнем ЦІК та швидкістю осідання еритроцитів (r = +0,49, р < 0,05).
Викликає інтерес вивчення стану прозапальних цитокінів при патології гепатобіліарної системи. Вміст IL-6 був вірогідно підвищеним у хворих на НАСГ до (5,1 ± 1,26) пг/мл (р < 0,05), на ХГС — до (5,10 ± 0,75) пг/мл (р < 0,05), на ТГМ — до (6,2 ± 1,3) пг/мл порівняно із контролем — (2,50 ± 0,43) пг/мл (рис. 6), що вказує на запальний процес та сприяє розвитку стеатогепатиту та фіброзу у хворих на ХДЗП.
Концентрація TNF-α у пацієнтів із НАСГ, ХГС, АХП та ТГМ була вірогідно вищою і становила (5,8 ± 2,5) пг/мл, (6,97 ± 1,7) пг/мл, (4,7 ± 1,2) пг/мл та (4,75 ± 1,59) пг/мл (р < 0,01) відповідно порівняно з групою контролю. Тоді як рівень IL-10 в обстежених хворих на НАЖХП, ХГС та ТГМ статистично не відрізнявся від значень норми.
Установлено підвищення рівня IL-6 у сироватці крові, що вказує на прогресування запальних процесів та сприяє розвитку стеатогепатиту та фіброзу у хворих на ХДЗП.
Установлено кореляційний зв’язок між рівнем IL-6 та TNF-α: у хворих на НАЖХП — (r = +0,53, р < 0,05), НАСГ — (r = +0,37, р < 0,05), АХП — (r = +0,53, р < 0,05). У хворих на НАЖХП установлено позитивний зв’язок між рівнем TNF-α та ТГ (r = +0,63, р < 0,01).
В результаті визначення співвідношення рівня прозапальних та протизапальних цитокінів (TNF-α/ IL-10) було встановлені зміни їх балансу в бік прозапальних цитокінів у хворих на ХДЗП порівняно з групою контролю. Ці зміни найбільш виражені у хворих НАСГ та ХГС.
Отримані дані у хворих на ХДЗП вказують на активні запальні процеси. Про це свідчило підвищення рівня прозапальних цитокінів (IL-6 та TNF-α), СМП. Гіперпродукція IL-6 супроводжується зниженням загальних ФЛ, до складу яких входять поліненасичені жирні кислоти в сироватці крові пацієнтів із НАЖХП, НАСГ та ТГМ: виявлено середній кореляційний взаємозв’язок між IL-6 та ФЛ (r = –0,44, р < 0,05; r = –0,45, р < 0,01; r = –0,45, р < 0,05 відповідно в пацієнтів даних груп) (рис. 7).
У пацієнтів із НАСГ встановлено, що підвищений рівень ЦІК супроводжувався порушенням ліпідного обміну, а саме підвищенням КА сироватки крові — ЦІК/КА (r = +0,39, р < 0,05) та зниженням антиатерогенної фракції ХС ЛПВЩ сироватки крові — ЦІК/ХС ЛПВЩ (r = –0,36, р < 0,05), про що свідчить виявлений середній кореляційний взаємозв’язок.
Показано, що підвищення рівня TNF-α паралельно супроводжується явищем ендотоксемії в пацієнтів із НАЖХП, про що свідчив середній кореляційний взаємозв’язок між TNF-α та СМП (r = +0,54, р < 0,05).
Підвищення вмісту Т-цитотоксичних лімфоцитів супроводжувалося зниженням ХС ЛПВЩ та ТГ сироватки крові, що підтверджується середніми кореляційними взаємозв’язками: між СD8+-лімфоцитами та ХС ЛПДВЩ (r = –0,53, р < 0,05) та ТГ (r = –0,53, р < 0,05) відповідно в пацієнтів з АХП. Крім того, у цієї групи пацієнтів була відсутня активація продукції IL-10 у відповідь на запалення, що супроводжується зниженням деградації зрілих нерозчинних колагенів, про що свідчив середній кореляційний взаємозв’язок між IL-10 та ОПв (r = –0,64, р < 0,01).
Таким чином, у хворих на ХДЗП було виявлено порушення ліпідного обміну: для хворих на НАЖХП та НАСГ характерним було підвищення ХС та ТГ у сироватці крові, тоді як для пацієнтів із ХГС та АХП характерним було як зниження, так і підвищення цих показників; у пацієнтів всіх груп були виявлені зниження вмісту загальних ФЛ у сироватці крові та зниження антиатерогенної фракції ХС ЛПВЩ, що супроводжувалося підвищенням коефіцієнта атерогенності сироватки крові. Виявлені порушення обміну ліпідів можуть бути однією з причин змін у структурі мебран клітин печінки та порушення її синтезуючої функції. Крім того, підвищений рівень прозапальних цитокінів (IL-6 та TNF-α) в крові хворих на ХДЗП не індукує секрецію протизапальних цитокінів (IL-10), що призводить до надмірної активації макрофагів, підтримки запального процесу та прогресування ХДЗП.
Висновки
Для хворих на хронічні дифузні захворювання печінки характерним є порушення ліпідного обміну (зниження вмісту загальних ФЛ та ХС ЛПВЩ, підвищення коефіцієнта атерогенності), недостатність клітинної ланки імунітету, підвищення вмісту циркулюючих імунних комплексів та прозапальних цитокінів (IL-6 та TNF-α). Ці зміни були більш виражені в пацієнтів із НАСГ та ХГС. Зміни показників імунної системи мають вірогідний зв’язок із показниками ліпідного обміну у хворих на хронічні дифузні захворювання печінки залежно від етіологічних факторів розвитку стеатозу і фіброзу печінки.
Перспективою наших подальших досліджень є дослідження ефективності різних терапевтичних комбінацій, які сприятимуть відновленню біохімічних та імунних порушень у хворих на хронічні дифузні захворювання печінки.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Serum fatty acid profiles and potential biomarkers of ankylosing spondylitis determined by gas chromatography – mass spectrometry and multivariate statistical analysis / R. Chen, S. Han, D. Dong et al. // Biomed Chromatogr. — 2014. — Vol. 29 (4). — P. 604-11. — doi: 10.1002/bmc.3321.
2. Serum fatty acid profiles using GC-MS and multivariate statistical analysis: potential biomarkers of Alzheimer's disease / D.C. Wang, C.H. Sun, L.Y. Liu et al. // Neurobiol. Aging. — 2015. — Vol. 33(6). — P. 1057-66. — doi: 10.1016/j.neurobiolaging.
3. Pat. US 9239334 B2, IPC/US2009/056176. Fatty acid C16: 1N7-palmitoleate a lipokine and biomarker for metabolic status / Haiming Cao, Gokhan S. Hotamisligil; Owner. — President And Fellows Of Harvard College. — No. US 13/062,527; Date of Pat. Jan. 19, 2016.
4. Serum metabolic signatures of four types of human arthritis / M. Jiang, T. Chen, H. Feng et al. // J. Proteome Res. — 2015. — Vol. 12(8). — P. 3769-79. doi: 10.1021/pr400415a.
5. Metabolomics identifies changes in fatty acid and amino acid profiles in serum of overweight older adults following a weight loss intervention / A. Perez-Cornago, L. Brennan, I. Ibero-Baraibar et al. // J. Physiol. Biochem. — 2014. — Vol. 70(2). — P. 593-602. doi: 10.1007/s13105-013-0311-2.
6. Lien S.K. Utilization of a deuterated derivatization agent to synthesize internal standards for gas chromatography-tandem mass spectrometry quantification of silylated metabolites / S.K. Lien, H.F. Kvitvang, P. Bruheim // J. Chromatogr. A. — 2012. — Vol. 1247. — P. 118-24. doi: 10.1016/j.chroma.2012.05.053.
7. Stigter E.C. Development and validation of a quantitative LC-tandem MS assay for hexadeca-4,7,10,13-tetraenoic acid in human and mouse plasma / E.C. Stigter, S. Letsiou, N.J. vd Broek, J. Gerrits et al. // J. Chromatogr B Analyt. Technol. Biomed. Life Sci. — 2013. — Vol. 15. — P. 16-19.
8. Nassir F., Ibdah J.A. Role of mitochondria in nonalcoholic fatty liver disease // Int. J. Mol. Sci. — 2014. — № 15. — P. 8713-8742.
9. Диденко В.И. Морфологическая и биохимическая оценка прогрессирования хронического гепатита, ассоциированного с вирусом C / В.И. Диденко, Н.Ю. Ошмянская, И.А. Кленина // Гастроентерологія. — 2014. — № 2. — С. 37-41/
10. Диденко В.И. Современные достижения в оценке стеатоза печени / В.И. Диденко // Гастроентерологія. — № 3(57). — 2015. — С. 94-100.
11. A new index for non-invasive assessment of liver fibrosis / N. Ichino at al. // World Jornal of Gastroenterology. — 2012. — Vol. 16, № 38. — Р. 4809-4816.
12. Gold E.W. The quantitative spectrophotometric estimation of total sulfated glycosaminoglican levels // Biochemica et Biophysica Acta. — 1981. — Vol. 673. — P. 408-415.
13. Алдашева Ж.А. Некоторые цитокины в диагностике неалкогольного стеатоза печени / Ж.А. Алдашева // Цитокины и воспаление. — 2013. — № 3(12). — С. 95-99.
14. Литвинова Л.С. Особенности клеточного иммунитета и цитокинового репертуара у пациентов с метаболическим синдромом / Л.С. Литвинова, Е.В. Кириенкова, Н.Н. Аксенова и др. // Бюллетень сибирской медицины. — 2012. — № 3. — С. 53-57.
15. Цуканов В.В. Новые аспекты неалкогольной жировой болезни печени / В.В. Цуканов, Э.В. Каспаров, Ю.Л. Тонких и др. // РЖГГК. — 2015. — № 2(25). — С. 28-40.
16. Głowacki M.K. Selected apoptotic markers in serum of patients with chronic viral hepatitis C / Głowacki M.K., Cieśla A., Cibor D. et al. // Przegl Lek. — 2014. — Vol. 71(7). — Р. 369-73. https://www.ncbi.nlm.nih.gov/pubmed/25338331.
17. Zhong W. Dietary fat sources differentially modulate intestinal barrier and hepatic inflammation in alcohol-induced liver injury in rats / W. Zhong, Q. Li, G. Xie [et al.] // Am. J. Physiol. Gastrointest. Liver Physiol. — 2013. — № 305(12). — Р. 919-932. doi: 10.1152/ajpgi.00226.2013.
18. Nielsen O.H. Tumor necrosis factor inhibitors for inflammatory bowel disease / O.H. Nielsen, M.A. Ainsworth // N. Engl. J. Med. — 2013. — Vol. 369. — Р. 754-762. doi: 10.1056/NEJMct1209614.
19. Бабінець Л.С. Клініко-патогенетичні аспекти хронічного панкреатиту біліарного генезу та ожиріння / Л.С. Бабінець, К.Ю. Кицай // Гастроентерологія. — 2016. — № 1(59). — С. 86-92. http://nbuv.gov.ua/UJRN/gastro_2016_1_15.
20. Глущенко С.В. Оптимізація діагностики та лікування неалкогольного стеатогепатиту у хворих на цукровий діабет 2 типу шляхом вивчення маркерів мітохондріальної дисфункції: дис… канд. мед. наук: 14.01.02. — Харків, 2015. — С. 18.
21. Татарчук О.М. Імунологічна реактивність у хворих на хронічні дифузні захворювання печінки / О.М. Татарчук, В.І. Діденко, С.Л. Меланіч, В.Є. Кудрявцева // Гастроентерологія. — 2018. — № 4(52). — С. 222-226. doi: 10.22141/2308-2097.52.4.2018.154142.

/52-1.jpg)
/53-1.jpg)
/53-2.jpg)
/54-1.jpg)
/54-2.jpg)
/55-1.jpg)