Резюме
Актуальність. Результати низки контрольованих клінічних досліджень вказують на те, що дефіцит класів/субкласів імуноглобулінів є негативним предиктором клінічного наслідку і біомаркером потенційної відповіді на внутрішньовенний імуноглобулін як імуномодулюючий та протизапальний агент при багатьох імунозапальних хворобах людини, включаючи гострий панкреатит. Мета роботи: вивчити субкласовий склад IgG сироватки крові в пацієнтів із гострим панкреатитом у різні фази патологічного процесу і оцінити потенційну інформативність отриманих результатів для клінічної практики. Матеріали та методи. Досліджувану групу становили 30 пацієнтів із діагнозом гострого панкреатиту, яким здійснювали триразове вимірювання сироваткової концентрації субкласів IgG1–4: у 1-й день, на 7-му і 14-ту добу госпіталізації. Контрольну групу становили 10 осіб, які не страждали від панкреатиту або інших гострих запальних уражень. Вимірювання сироваткової концентрації субкласів IgG здійснювали за допомогою твердофазного імуноферментного аналізу (виробник реактивів Thermo Fisher Scientific Inc., США). Статистичну обробку отриманого матеріалу проводили за допомогою структурного та порівняльного аналізів, а також із застосуванням варіаційного аналізу із розрахунком параметричного критерію Стьюдента та показника довірчої ймовірності р. Результати. Середні величини сироваткової концентрації субкласів IgG були нижчими в пацієнтів із гострим панкреатитом порівняно з особами групи контролю, однак вірогідної різниці не зареєстровано в жодному випадку (р > 0,05), що було пов’язано з гетерогенністю досліджуваної групи за динамікою субкласового складу імуноглобулінів сироватки крові. Для IgG1 був характерним розбалансований вміст із великою питомою вагою знижених значень протягом усього періоду спостереження з тенденцією до переважання гіперпродукції на 14-ту добу, тоді як концентрація IgG4 спочатку була здебільшого низькою зі слабкою тенденцією до нормалізації на 14-ту добу. Загалом близько 60 % пацієнтів мали низьку сироваткову концентрацію класу/субкласу IgG у всі або деякі дні спостереження. Ці пацієнти розцінені як потенційні відповідачі на імуноглобулін. Отримані результати інтерпретовані як наслідок взаємодії процесів імунореактивності, вторинної імуносупресії та особливостей імунного статусу пацієнта до моменту хвороби. Висновки. Визначення сироваткової концентрації субкласів IgG у пацієнтів із гострим панреактитом може бути корисним: а) для виявлення фази імунозапальної реакції, що лежить в основі хвороби; б) оцінки інтенсивності імунного запалення на різних етапах патологічного процесу та в) визначення імунного статусу для діагностики гуморального імунодефіциту, що дозволить точніше оцінити тяжкість стану пацієнта, краще підібрати лікувальні втручання, включаючи внутрішньовенний імуноглобулін, і здійснити якісніше прогнозування подальшого перебігу хвороби.
Результаты ряда контролируемых клинических исследований указывают на то, что дефицит классов/субклассов иммуноглобулинов является негативным предиктором клинического последствия и биомаркером потенциального ответа на иммуноглобулин как иммуномодулирующий и противовоспалительный агент при многих иммуновоспалительных болезнях человека, включая острый панкреатит. Цель работы: изучить субклассовый состав IgG сыворотки крови у пациентов с острым панкреатитом в различные фазы патологического процесса и оценить потенциальную информативность полученных результатов для клинической практики. Материалы и методы. Исследуемую группу составили 30 пациентов с диагнозом острого панкреатита, которым осуществляли трехразовое измерение концентрации в сыворотке крови субклассов IgG1–4: в 1-й день, на 7-е и 14-е сутки госпитализации. Контрольную группу составили 10 человек, не страдавших острым панкреатитом или другими острыми воспалительными заболеваниями. Измерение концентрации в сыворотке крови субклассов IgG осуществляли с помощью твердофазного иммуноферментного анализа (производитель реактивов Thermo Fisher Scientific Inc., США). Статистическую обработку полученного материала проводили с помощью структурного и сравнительного анализов, а также с применением вариационного анализа с расчетом параметрического критерия Стьюдента и показателя доверительной вероятности р. Результаты. Средние величины концентрации в сыворотке крови субклассов IgG были ниже у пациентов с острым панкреатитом по сравнению с лицами группы контроля, однако достоверной разницы не зарегистрировано ни в одном случае (р > 0,05), что было связано с гетерогенностью исследуемой группы по динамике субклассового состава иммуноглобулинов сыворотки крови. Для IgG1 было характерным разбалансированное содержание с большим удельным весом пониженных значений в течение всего периода наблюдения с тенденцией к преобладанию гиперпродукции на 14-е сутки, тогда как концентрация IgG4 сначала была в большинстве случаев низкой со слабой тенденцией к нормализации на 14-е сутки. В целом около 60 % пациентов имели низкую сывороточную концентрацию классов/субклассов IgG во все или некоторые дни наблюдения. Эти пациенты расценены как потенциальные ответчики на иммуноглобулин. Полученные результаты интерпретированы как следствие взаимодействия процессов иммунореактивности, вторичной иммуносупрессии и особенностей иммунного статуса пациента до момента болезни. Выводы. Определение сывороточной концентрации субклассов IgG у пациентов с острым панкреатитом может быть полезным: а) для выявления фазы иммуновоспалительной реакции, лежащей в основе болезни; б) оценки интенсивности иммунного воспаления на различных этапах патологического процесса и в) определения иммунного статуса для диагностики гуморального иммунодефицита, что позволит точнее оценить тяжесть состояния пациента, лучше подобрать лечебные вмешательства, включая внутривенный иммуноглобулин, и осуществить качественное прогнозирование дальнейшего течения болезни.
The results of a number of controlled clinical studies indicate that the deficiency of classes/subclasses of immunoglobulins (Ig) is a negative predictor of clinical outcome and biomarker of potential response to immunoglobulin as an immunomodulatory and anti-inflammatory agent in many human autoimmune diseases, including acute pancreatitis. The purpose was to study the subclass of blood serum IgG in patients with acute pancreatitis in various phases of the pathological process and to evaluate the potential informativeness of the results obtained for clinical practice. Materials and methods. The study group consisted of 30 patients diagnosed with acute pancreatitis, who underwent 3-times measurement of the blood serum concentration of IgG1–4 subclasses: on days 1, 7 and 14 of hospitalization. The control group included 10 people, who did not suffer from acute pancreatitis or other acute inflammatory diseases. Measurement of IgG subclass concentrations in the blood serum was carried out using enzyme-linked immunosorbent assay (Thermo Fisher Scientific Inc., USA). The statistical processing of the obtained data was carried out using structural and comparative analyzes, as well as analysis of variance with the calculation of the Student’s parametric criterion and the index of confidence probability p. Results. The mean serum concentrations of IgG subclasses were lower in patients with acute pancreatitis than in controls, but no significant difference was observed in any of these cases (p > 0.05), which was due to the heterogeneity of the study group in terms of the dynamics of the subclass composition of blood serum immunoglobulins. IgG1 was characterized by a unbalanced content with a high specific gravity of reduced values throughout the observation period with a tendency to predominance of hyperproduction on day 14, whereas the IgG4 concentration was initially low in most cases with a weak tendency to normalize on 14th day. In general, about 60 % of patients had low serum concentrations of IgG classes/subclasses on all or some of the observation days. These patients were considered as potential responders for immunoglobulin. The data obtained are interpreted as a result of the interaction of immunoreactivity, secondary immunosuppression, and peculiarities of the immune status of the patient until the moment of the illness. Conclusions. Determination of the serum concentration of IgG subclasses in patients with acute panreatitis may be useful for (a) determining the phase of the autoimmune reaction underlying the disease, (b) evaluating the intensity of immune inflammation at various stages of the pathological process, and (c) determining the immune status for the diagnosis of humoral immune deficiency, which will allow a more accurate assessment of the severity of the patient’s condition, to choose better the treatment interventions, including immunoglobulin, and to carry out a qualitative prediction of the future course of the disease.
Вступ
Гострий панкреатит — тяжке імунозапальне захворювання, що може зумовити критичний стан пацієнта і стати причиною смерті. Основними стратегіями консервативного лікування гострого панкреатиту є антиферментна та протизапальна терапія. Дефіцити субкласів IgG є одними з найпоширеніших у людській популяції імунними дисфункціями, що призводять до формування інфекційних, автоімунних, алергічних, імунозапальних та онкологічних ускладнень через порушення антигенного гомеостазу та імунної регуляції [1, 2]. Натомість гіперпродукція певних субкласів IgG може опосередковувати розвиток аналогічної автоімунної, алергічної та імунозапальної патології, що розвинулася поза зв’язком із первинним дефіцитом цих імунних чинників [5]. У даний час вивчення субкласового складу IgG сироватки крові використовується для диференціальної діагностики автоімунного панкреатиту [5], однак значення цих показників при гострому запаленні підшлункової залози іншого походження залишається неуточненим. Т. Ueda зі співавт. виявили ознаки вторинної імуносупресії при гострому панкреатиті в людей. Вони показали, що сироваткова концентрація IgG та IgM, активність лімфокінактивованих кілерів та природних кілерних лімфоцитів була низькою в 50,0, 65,0, 45,5 та 42,4 % випадків відповідно [9]. Вторинний дефіцит IgG та IgM у пацієнтів із гострим панкреатитом виявлений у дослідженні J. Hallay зі співавт. Раннє дуоденальне харчування сприяло швидкій нормалізації показників гуморального імунітету [6]. Однак H.U. Schulz зі співавт. не виявили суттєвих порушень із боку сироваткової концентрації імуноглобулінів різних класів у пацієнтів із гострим панкреатитом, установивши, що тільки зниження інтенсивності реакцій сповільненої гіперчутливості було типовим проявом вторинної імуносупресії, яка впливала на наслідки імунозапальної хвороби [8]. B.S. Zaporozhchenko показав відновлення раніше знижених рівнів бласттрансформації Т-лімфоцитів і сироваткової концентрації IgG у пацієнтів із гострим панкреатитом після програмованої релапаратомії [10]. Відповідно до цього V.N. Klimenko зі співавт. у контрольованому клінічному дослідженні показали, що дефіцит гуморального імунітету відзначається щонайменше в 40 % випадків у пацієнтів із гострим панкреатитом, а призначення внутрішньовенного імуноглобуліну в дозі 500 мг/кг дозволяє зменшити тяжкість хвороби, нормалізувати результати загальноклінічних лабораторних даних, зменшити смертність і скоротити термін перебування пацієнта в стаціонарі [7].
/54-1.jpg)
Як відомо, виділяють 4 субкласи IgG, що позначаються арабськими цифрами в порядку зменшення їх вмісту в сироватці крові (IgG1–4) (рис. 1). Субкласи різняться структурою константних ділянок, специфічністю до антигенів та функціональною активністю (рис. 1, табл. 1) [1, 2]. Якщо говорити про послідовність синтезу різних субкласів IgG під час гострої імунної відповіді, то згідно з останньою моделлю, запропонованою A.M. Collins, K.J.L. Jackson, при надходженні антигена спочатку виробляються низько–афінні IgE та IgG3, що є складовими негайної імунної відповіді, потім — високоафінні IgG1 та IgG2, що забезпечують кліренс середовищ від антигена, однак функціонують у певній опозиції один до одного, і зрештою — IgG4, що нарощують специфічність відповіді і реалізують блокуючий ефект щодо прозапальної активності інших імуноглобулінів. IgG1 та IgG2 проявляють певний антагонізм один до одного, разом забезпечуючи цілісну імунну відповідь у період розпалу гострого інфекційного процесу. Якщо IgG1 опосередковують переважно прозапальну відповідь за рахунок активації опсонофагоцитозу та системи комплементу за класичним шляхом, то IgG2, навпаки, здійснюють антизапальний, блокуючий ефект, оскільки, нейтралізуючи розпізнаний антиген, не залучають чинники природженого імунітету [4].
/54-2.jpg)
Мета дослідження: вивчити субкласовий склад IgG сироватки крові у пацієнтів із гострим панкреатитом у різні фази патологічного процесу і оцінити потенційну інформативність отриманих результатів для клінічної практики.
Матеріали та методи
Під клінічним спостереженням перебувало 30 пацієнтів із верифікованим діагнозом гострого панкреатиту, яким здійснювали триразове вимірювання сироваткової концентрації субкласів IgG1–4: перший раз одразу ж після надходження до стаціонару, другий — на 7-му добу госпіталізації, а третій — на 14-ту добу, напередодні виписки з лікарні. Ці пацієнти становили досліджувану групу. Таким же чином були обстежені 10 осіб, які не страждали від панкреатиту або інших гострих запальних уражень, яких включили в групу контролю. Здебільшого це були пацієнти з паховою кістою, які надходили до стаціонару в плановому порядку.
Вимірювання сироваткової концентрації субкласів IgG здійснювали за допомогою твердофазного імуноферментного аналізу (виробник реактивів Thermo Fisher Scientific Inc., США). Використовували такі нормативні інтервали для дорослого пацієнта:
IgG1 = 4,9–11,4 г/л, IgG2 = 1,5–6,4 г/л, IgG3 = 0,5–1,6 г/л, IgG4 = 0,2–1,4 г/л.
Статистичну обробку отриманого матеріалу проводили за допомогою структурного та порівняльного аналізів, а також із застосуванням варіаційного аналізу з розрахунком параметричного критерію Стьюдента та показника довірчої ймовірності р. Підрахунок результатів здійснювали за допомогою комп’ютерної програми Microsoft Excel.
Результати
Результати варіаційного аналізу отриманих даних вказують на те, що середні величини сироваткової концентрації субкласів IgG у пацієнтів досліджуваної групи не виходили за межі діапазону референтних величин протягом усього періоду спостереження, за винятком підкласу IgG4, середня величина концентрації якого виявилася меншою, ніж нижня межа норми, в 1-й день спостереження, однак нормалізувалася на 7-му і 14-ту добу (табл. 2). Якщо порівнювати з даними контрольної групи, то середні сироваткові концентрації субкласів IgG були нижчими в пацієнтів із гострим панкреатитом порівняно з особами без тяжкої імунозапальної патології, однак вірогідної різниці не зареєстровано в жодному випадку (р > 0,05). У 1-шу і на 7-му добу середні величини сироваткової концентрації всіх субкласів були меншими, ніж у контрольній групі, тоді як на 14-ту добу відзначалося зростання вмісту IgG1 і IgG3, однак концентрація IgG2 і IgG4 все ще залишалася нижчою, ніж у групі контролю. Загалом серед пацієнтів із гострим панкретитом відзначался тенденція до поступового зростання сироваткової концентрації субкласів IgG з 1-ї по 14-ту добу спостереження, що відображало процес видужування від гострої імунозапальної хвороби внаслідок природного перебігу патологічного процесу і надання медичної допомоги.
/55-1.jpg)
Завдяки проведенню структурного і порівняльного аналізів отриманої інформації вдалося пояснити результати варіаційного аналізу гетерогенністю досліджуваної групи за динамікою сироваткової концентрації субкласів IgG протягом періоду спостереження.
Результати структурного аналізу даних досліджуваної групи вказують, що в день госпіталізації відзначалися різнонаправлені зміни сироваткової концентрації підкласу IgG1: перевищеня норми спостерігалося в 9 випадках, низкий вміст — в 10, а нормальні значення — в 5. На 7-му добу відзначався аналогічний розподіл, однак напередодні виписки відмічалась тенденція до зростання кількості випадків гіперпродукції підкласу IgG1 (14) за рахунок зменшення питомої ваги нормальних (3) і низьких значень (7) сироваткової концентрації цього субкласу IgG (рис. 2).
/55-2.jpg)
У жодного пацієнта не відзначалася висока сироваткова концентрація підкласу IgG2 при надходженні до стаціонару. У двох третинах випадків спостерігався нормальний вміст цього субкласу імуноглобуліну в сироватці крові, і лише в третині — знижений. Результати 7-ї доби спостереження мало відрізнялися від попередніх, однак при виписці в 3 пацієнтів зареєстрована гіперпродукція субкласу IgG2, хоча співвідношення нормальної (14) і зниженої (7) сироваткової концентрації цього підкласу імуноглобуліну зберігалося на попередньому рівні.
Сироваткова концентрація субкласу IgG3 у пацієнтів досліджуваної групи в 1-й день обстеження була переважно нормальною (13), тоді як знижені (5) і підвищені (6) результати вимірювання цього показника відзначалися значно рідше і майже в однаковій кількості випадків. Зазначене співвідношення майже не змінилося на 7-му і 14-ту добу спостереження з перевагою нормальних значень, що вказує на певну ареактивність із боку сироваткової концентрації підкласу IgG3 щодо гострого імунозапального процесу, що лежав в основі панкреатиту в пацієнтів досліджуваної групи.
Натомість більшість пацієнтів досліджуваної групи мали низьку сироваткову концентарцію підкласу IgG4 на момент першого обстеження (16), причому в жодному випадку не було зареєстровано підвищеного вмісту цього субкласу в сироватці крові. На 7-му і 14-ту добу спостереження відзначалося поступове збільшення питомої ваги нормальних значень сироваткової концентрації субкласу IgG4 (10 і 14 відповідно), що могло вказувати на перехід пацієнтів із фази розпалу імунозапального процесу у фазу видужування, хоча кількість випадків зниженої концентрації IgG4 у сироватці крові при виписці залишалася доволі великою (10), що свідчило про вибірковий дефіцит IgG4 (рис. 3).
/56-1.jpg)
Загалом для підкласу IgG1 був характерним розбалансований вміст із тенденцією до переважання гіперпродукції на 14-ту добу. Імунна відповідь за посередництвом IgG2 і IgG3 характеризувалася меншою реактивністю з переважанням нормальних значень протягом усього періоду спостереження, тоді як концентрація IgG4 спочатку була здебільшого низькою зі слабкою тенденцією до нормалізації на момент виписки зі стаціонару. Ці дані вказують на те, що пацієнти надходили до стаціонару у фазу розпалу імунозапальної реакції, вже після реалізації негайної відповіді, коли провідним субкласом є IgG3. Найбільш ймовірно, це пов’язано з часом розвитку клінічної картини гострого панкреатиту, що була причиною звернення за медичною допомогою і показанням до госпіталізації пацієнта. Негайна запальна відповідь, що характеризується гіперпродукцією IgG3 або, навпаки, різким зниженням сироваткової концентрації цього субкласу внаслідок феномену споживання, реалізовувалася здебільшого до формування розгорнутих клінічних ознак хвороби, що зумовлювали звернення за медичною допомогою і подальшу госпіталізацію. З огляду на зазначену динаміку підклас IgG1 є кращим біомаркером для оцінки інтенсивності імунного запалення при гострому панреатиті в госпіталізованого пацієнта, ніж IgG3. Крім того, відзначено, що у фазу розпалу імунозапальної реакції переважала прозапальная імунна відповідь через гіперпродукцію IgG1 і була слабшою антизапальна, нейтралізуюча імунна відповідь за посередництвом IgG2. Це могло бути причиною тяжкого, агресивного перебігу гострого панкреатиту і виникнення потреби у виконанні хірургічних втручань. Пацієнти з гіперпродукцією IgG1 могли потребувати інтенсивнішої протизапальної терапії, ніж особи з нормальною продукцією цього субкласу. Оскільки продукція IgG4 відзначається в пізню фазу імунозапальної відповіді при видужанні пацієнта, видаються закономірними результати щодо тенденції до зростання вмісту цього субкласу при виписці пацієнта зі стаціонару. Велика кількість пацієнтів із низькою сироватковою концентацією IgG4 на 14-ту добу може вказувати на незавершеність імунозапальної відповіді і необхідність подовження протизапальної терапії, а також на наявність вибіркового дефіциту IgG4 у деяких осіб, що потребує імунокорекції.
Тоді як гіперпродукція субкласів IgG пов’язана з регуляцією інтенсивності запалення, гіпопродукція імуноглобулінів асоційована з підвищеним ризиком інфекційних ускладнень гострого панкреатиту та нагноєнням після виконання хірургічних операцій. Оскільки IgG1 становить основу пулу IgG у сироватці крові людини, дефіцит цього субкласу найсильніше впливає на ризик інфекційних ускланень. Компенсація дефіциту IgG1 за допомогою внутрішньовенного імуноглобуліну може нівелювати інфекційні ризики, пов’язані із зазначеною імунною дисфункцією. Протягом перших 7 діб спостереження 10 із 24 пацієнтів демонстрували патологічну гіпопродукцію субкласу IgG1, що обгруновувало застосування імуноглобуліну із замісною метою в дозі 400–600 мг/кг/міс. При виписці в 7 із 24 пацієнтів була низькою сироваткова концентрація IgG1, що могло стати причиною віддалених інфекційних ускладнень і погіршення результатів реабілітації. Ці пацієнти потребували замісної імуноглобулінотерапії при виписці зі стаціонару. Цілком очевидно, що своєчасне призначення внутрішньовенного імуноглобуліну при надходження до лікарні з огляду на великий період напіврозпаду молекули IgG могло б запобігти випадкам гіпопродукції субкласу IgG1 при виписці пацієнта. Оскільки вибірковий дефіцит IgG4 є найпоширенішим у людській популяції, у досліджуваній групі відзначалося найбільше випадків зниженої концентрації цього субкласу. Дефіцит IgG4 також може впливати на ризик інфекційних ускладнень, хоч і меншою мірою, ніж IgG1, тому також потребує відповідної імунокорекції. Зважаючи на малий природний вміст цього субкласу, такі пацієнти потребуть низькодозової замісної імуноглобулінотерапії (200 мг/кг/міс). Результати зазначеного аналізу вказують, що 60 % пацієнтів досліджуваної групи потребували замісної внутрішньовенної імуноглобулінотерапії, переважно для компенсації дефіцитів субкласів IgG1 і IgG4. Велику питому вагу випадків зниженої сироваткової концентрації певних субкласів IgG, переважно IgG1 і IgG4, можна пояснити вторинною імуносупресією, обумовленою гострим панкреатитом, однак можливий також вплив передіснуючих порушень гуморального імунітету, на тлі яких розвивалася імунозапальна хвороба.
Загалом 1-ша доба спостеження характеризувалася майже однаковою кількістю нормальної і зниженої сироваткової концентрації субкласів IgG (44 і 36 випадків із 96 відповідно). Це вказувало на два імунологічних патерни: ареактивний із нормальним значеннями сироваткової концентрації антитіл і гіпореактивний із дефіцитом певних імуноглобулінів. Із теоретичної точки зору гіперімуноглобулінемія, що відмічалась у 16 із 96 випадків, може спричинити вираженіше як локальне, так і системне запалення при гострому панкреатиті, супроводжується більшим пошкодженням паренхіми підшлункової залози і вираженішим порушенням загального стану хворого, у тому числі інтенсивнішим болем, підвищуючи потребу в протизапальних лікувальних втручаннях, включаючи ургентні хірургічні операції. Натомість гіпореактивна відповідь з аномально низькою продукцією IgG хоча й може опосередковувати більш м’який перебіг гострого пакреатиту як імуно–запальної хвороби, однак зумовлює розвиток інфекційних ускладнень у найближчій і віддаленій перспективах, а також асоційована з гіршим загоєнням хірургічних ран.
Через 7 діб ситуація в досліджуваній групі кардинально не змінилася, оскільки переважали нормальні і знижені значення сироваткової концентрації субкласів IgG (45 і 36 випадків із 96 відповідно). Збереження великої кількості випадків гіпореактивного патерну субкласового складу сироватки крові вказує на персистенцію імунодепресивного стану у великому сегменті досліджуваної групи, що могло опосередковувати ускладнений перебіг панкреатиту, погіршити наслідки хвороби і результати реабілітації пацієнтів. Такі пацієнти, так само як і протягом 1-ї доби обстеження, потребували замісної внутрішньовенної імуноглобулінотерапії для відновлення сироваткового пулу імуноглобулінів.
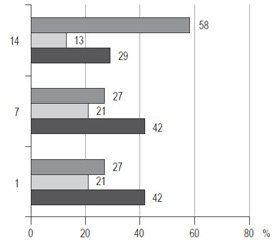
14-та доба спостереження характеризувалася деяким зменшенням кількості нормальних значень сироваткової концентарції IgG із наростанням майже вдвічі питомої ваги гіперреактивного патерну (39 і 27 випадків із 96 відповідно) (рис. 4). Така динаміка, найбільш ймовірно, була пов’язана з усуненням вторинної імуносупресії та формуванням імунної пам’яті до вивільнених антигенів підшлункової залози та мікробних продуктів у разі розвитку інфекційних ускладнень. Проте питома вага гіпореактивного патерну зменшилася незначно (30 випадків порівняно з 36 на 7-му добу) і була суттєвою навіть при виписці пацієнта. Отже, принаймні третина осіб виписується зі стаціонару з ознаками імуносупресії в гуморальній ланці імунітету, що може мати негативне прогностичне значення. Ці пацієнти мають бути направлені до клінічного імунолога і отримувати замісну імуноглобулінотерапію для профілактики подальших імунозапальних ускладнень і покращання результатів реабілітації.
Обговорення
Якщо говорити про визначення фази патологічного процесу зігідно з концепцією Коллінза — Джексона [4], то результати даного аналізу вказують, що пацієнти надходили до стаціонару у фазу розпалу імунозапального процесу, що характеризується переважною продукцією субкласів IgG1 та IgG2. Короткочасна надгостра фаза, під час якої провідним є субклас IgG3, реалізовувался ще до моменту включення пацієнта в дане дослідження. Аналіз динаміки сироваткової концентрації підкласів IgG дозволив продемонструвати перехід на 14-ту добу спостереження багатьох пацієнтів до фази видужання, що характеризується посиленою продукцією IgG4 і супроводжується завершенням патологічного імунозапального процесу.
Якщо говорити про оцінку імунного статусу, то в 60 % пацієнтів досліджуваної групи відзначалася низька сироваткова концентрація одного або кількох підкласів IgG, здебільшого IgG1 і IgG4, у всі або деякі періоди спостереження, що свідчило про наявність імуносупресії, могло негативно вплинути на перебіг хвороби і потребувало проведення замісної внутрішньовенної імуноглобулінотерапії для відновлення сироваткового пулу IgG. Це могли бути потенційні відповідачі на імуноглобулінотерапію, що раніше показала клінічну ефективність при гострому панкреатиті як протизапальна, органопротекторна стратегія.
Своєчасне призначення імунотерапії з 1-ї по 7-му добу спостереження під контролем субкласового складу крові може забезпечити ефективніший вплив на імунозапальний процес, що лежить в основі гострого панкреатиту, і запобігти розвитку ускладнень. Направлення пацієнтів зі збереженням дефіциту субкласів IgG після виписки зі стаціонару до клінічного імунолога може допомогти у виявленні первинних і вторинних гуморальних імунодефицитів і забезпечити профілактику імунозалежних ускладнень у найближчій і віддаленій перспективах за рахунок проведення замісної імуноглобуліно–терапії.
Висновки
1. Пацієнти з гострим панкреатитом є гетерогенною групою за динамікою субкласового складу IgG у сироватці крові, що може опосередковувати неоднакову чутливість для імуноглобулінотерапії як імунозамісної та протизапальної стратегії лікування.
2. Для підкласу IgG1 був характерним розбалансований вміст із великою питомою вагою знижених значень протягом усього періоду спостереження з тенденцією до переважання гіперпродукції на 14-ту добу. Імунна відповідь за посередництвом IgG2 і IgG3 характеризувалася меншою реактив–ністю з переважанням нормальних значень про–тягом усього періоду спостереження, тоді як концентрація IgG4 спочатку була здебільшого низькою зі слабкою тенденцією до нормалізації на 14-ту добу.
3. Співвідношення сироваткових концентарцій IgG1 і IgG2 під час фази розпалу імунозапальної реакції може бути інформативним інструментом для оцінки інтенсивності запалення і необхдності в антизапальних лікувальних втручаннях, що потребує подальшого вивчення.
4. У 60 % випадків при гострому панкреатиті існують показання для призначення імуноглобуліну з імунозамісною метою в середній або малій дозах для компенсації порушень гуморального імунітету, що може бути асоційовано з вираженішою реалізацією протизапального і протимікробного ефектів цього імунотерапевтичного агента. Визначення субкласового складу IgG може допомогти встановити потенційних відповідачів на нормальний імуноглобулін людини як огранопротекторний препарат у загальній групі пацієнтів із гострим панкреатитом, виступаючи як інформативний біомаркер.
5. Вимірювання сироваткової концентрації субкласів IgG у пацієнтів із гострим панреактитом може бути корисним: а) для встановлення фази імунозапальної реакції, що лежить в основі хвороби; б) оцінки інтенсивності імунного запалення на різних етапах патологічного процесу та в) визначення імунного статусу для діагностики гуморального імунодефіциту, що дозволить точніше оцінити тяжкість стану пацієнта, краще підібрати лікувальні втручання і здійснити якісніше прогнозування подальшого перебігу хвороби.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/54-1.jpg)
/54-2.jpg)
/55-1.jpg)
/55-2.jpg)
/56-1.jpg)
/57-2.jpg)