На сьогодні передракові стани шлунка, до яких насамперед відноситься кишкова метаплазія (КМ) [1–3], як і раніше, є пріоритетом для охорони здоров’я в країнах Західної Європи і являють собою епідеміологічну проблему для країн Східної Європи, Центральної і Східної Азії, а також деяких регіонів Південної Америки [1, 4–6].
КМ є результатом неправильного диференціювання шлункових клітин з відхиленням фенотипу в сторону клітин тонкої або товстої кишки і характеризується розвитком залоз з наявністю келихоподібних муцинпродукуючих клітин, клітин Панета і поглинаючих клітин [2, 3]. Було відзначено, що дана патологія частіше зустрічається у чоловіків, ніж у жінок, і має тенденцію прогресувати з віком [6]. Частота КМ коливається в широких межах у різних країнах/континентах і залежить від етнічних особливостей [7]. Деякі автори вважають, що КМ може відігравати певну роль у розвитку карциноми шлунка [6], але останнім часом у літературі термін «передраковий стан» широко критикується, тому що КМ набагато частіше буває пов’язана з розвитком доброякісних новоутворень [7, 8].
Патогенез КМ залишається не до кінця з’ясованим. Згідно з широким колом досліджень, до її розвитку призводить рефлюкс жовчних кислот, вплив на Н2-рецептори, пілоропластика або ваготомія [9]. З іншого боку, КМ вірогідно зменшується після введення цистеаміну [10], що стимулює секрецію шлункового соку, гістаміну або видалення піднижньощелепних залоз [11, 12]. Щодо впливу дуоденогастрального рефлюксу на стан слизової оболонки (СО), то тут вчені не дійдуть єдиного висновку. У відомому дослідженні Л.Й. Аруїна (1998) проводиться аналіз змін, що відбуваються у слизовій оболонці шлунка під впливом дуоденального рефлюксату у пацієнтів із оперованим шлунком [13]. Автор зазначає, що при цьому спостерігаються деструктивні та метапластичні зміни, тому ризик розвитку передракового стану у пацієнтів цієї групи значно підвищений. У той час І.Ю. Колеснікова та ін. (2003) стверджують про захисний механізм виникнення дуоденогастрального рефлюксу, оскільки найчастіше він виявляться при підвищеній секреторній активності шлунка [14]. Тут може мова йти у подальшому про сприяння лужного рефлюксату заселенню слизової оболонки шлунка бактеріями Н.pylori, що, у свою чергу, значно підсилює канцерогенний потенціал змін у слизовій оболонці.
З оглядом на те, що сучасне визначення шлункової атрофії — це «втрата відповідної будови залоз» [7], міжнародна група дослідників патології шлунково-кишкового тракту запропонувала класифікацію гістологічного спектра атрофічних змін. Зменшення площі або повне зникнення залізистих одиниць за умов заміщення розширеною (фіброзованою) власною пластинкою СО призводить до зменшення залозистої маси, але не має на увазі будь-яких змін нативного клітинного фенотипу. Іноді (особливо в умовах H.рylori-асоційованого гастриту) сильне запалення може призвести до зміщення залоз, що робить надійну оцінку атрофії СО неможливою. Такі випадки можуть бути (тимчасово) позначені як «невизначений ступінь атрофії», і остаточне рішення може бути відкладено до регресії запалення (наприклад, після ліквідації інфекції H.рylori). Зменшення площі нативних залоз за рахунок метаплазії не обов’язково супроводжується зменшенням загальної кількості залоз, але метапластична заміна нативних залоз призводить до порушення функції. Така умова узгоджується з визначенням «втрата відповідної будови залоз».
Усе вищезгадане обумовлює актуальність поглибленого вивчення стану проліферативної активності СО шлунка та покращення гістологічної діагностики.
Таким чином, метою нашої роботи було надати морфологічну характеристику кишкової метаплазії та дисплазії у хворих на хронічний рефлюкс-гастрит (ХРГ) в аспекті структурних і функціональних змін слизової оболонки шлунка.
Матеріали та методи
Обстежено 140 осіб, із яких 120 осіб — хворі на хронічний рефлюкс-гастрит (РГ) і 20 осіб — умовно здорові. Матеріалом для вивчення структурних змін у СО шлунка стали гастробіоптати, отримані під час фіброгастроскопії.
Для гістологічних досліджень біоптати СО шлунка фіксували в 10% розчині нейтрального забуференого формаліну, зневоднювали в спиртах висхідної концентрації i заливали в парафін. Гістологічні зрізи товщиною 5 мкм забарвлювали гематоксиліном i еозином, ставили PAS-реакцію, клітини в стані кишкової метаплазії визначались за допомогою забарвлення альціановим синім [15]. Для ідентифікації Hр-інфекції використовували бактеріоскопію відбитків, забарвлених за методом Романовського — Гімзи [15].
Для морфометричного дослідження зрізи, забарвлені гематоксиліном і еозином, фотографувалися за допомогою світлового мікроскопа XSP-139TP (Ulab, Україна), фотоапаратом Canon PowerShot A630 та вимірялися за допомогою програмного забезпечення ImageJ 1.45S [16] (National Institutes of Health, США).
При аналізі результатів використовувалися методи описової статистики [17]: розрахунок середнього значення, 95% інтервалу і стандартної помилки у вибірці, результат записувався як М ± m.
Результати та обговорення
При гістологічному дослідженні СО шлунка в групі умовно здорових людей у 100 % ознаки атрофії були відсутніми, ямки розташовані регулярно, залози в достатній кількості. Незначна кількість лімфоцитів і плазматичних клітин залишалася локалізованою на рівні фовіолярного шару строми. Атрофічні процеси спостерігались у цілому у 88 хворих із 120 (73,3 %; рис. 1А). При цьому наявність атрофії в нашому дослідженні не залежала від етіології рефлюксу. КМ було виявлено у 32 хворих, тобто загальна її частота становила 26,7 % (рис. 1Б).
Із збільшенням віку хворих частота метапластичних змін різко підвищувалася: проведений аналіз показав, що у пацієнтів віком до 30 років КМ І та КМ ІІ виявляється найрідше (6,25 %). У наступній віковій категорії (30–55 років) виявляється збільшення частоти КМ до 31,25 %, тоді як у віковій категорії понад 55 років КМ спостерігається найчастіше, досягаючи частоти 62,5 %, що вірогідно перевищує аналогічний показник у попередніх вікових категоріях (р < 0,05).
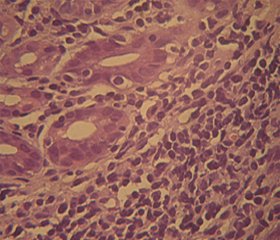
У 15 % випадків на тлі хронічного РГ відмічалася дисплазія шлункових залоз, яка при порівнянні із КМ характеризувалася в першу чергу гіперхромазією та відносним збільшенням ядер клітин при частково збереженій залозистій будові (рис. 2).
Нами було проаналізовано залежність частоти виявлення диспластичних змін від їх віку і також знайдено пряму залежність наведених параметрів. З’ясовано, що дисплазія у пацієнтів віком до 30 років не виявлялась. Для наступної вікової категорії (30–55 років) частота виявлення дисплазії становила 33,3 %, а найвищих значень показники досягли у віковій категорії понад 55 років (66,7 %). Цей факт вказує, що ймовірність розвитку онкопроцесу в СО шлунка у пацієнтів віком старше 55 років більш висока.
Варто також відзначити зв’язок диспластичних змін з інфекцією Н.руlori: серед хворих на дисплазію хелікобактерна інфекція визначалась у 100 %, із них легкий ступінь обсіменіння — лише в 11,1 % (р > 0,05), помірний — у 33 % (р > 0,05), а виражений — у 55,6 % (p < 0,05).
Фовеолярна гіперплазія, що відображає процеси регенерації, характерні для рефлюкс-гастриту, відмічена у 40 %, при цьому у 30,9 % — в антральному відділі, у 25,7 % випадків — у фундальному відділі. Вона характеризувалась значним зменшенням ядерно-цитоплазматичного відношення, супроводжувалась активацією проліферативних процесів, що знайшло відображення в збільшенні кількості мітозів, та розширенням дрібних судин фовіолярного шару строми (рис. 3).
Для встановлення залежності КМ від вираженості власно атрофічних змін СО шлунка було проведено додатковий аналіз частоти виявлення КМ при різних ступенях вираженості атрофії (рис. 4).
Отримані дані показали, що виявлення КМ І та КМ ІІ було чітко пов’язано з вираженістю власне атрофічних змін СО шлунка: у більшості хворих КМ супроводжувалась атрофічними змінами помірного (43,75 %) та вираженого (56,25 %) ступеня, проте при легкому ступені вираженості КМ не зустрічалось (0 %). Також варто відмітити, що в обох випадках КМ І зустрічалась в декілька разів частіше, ніж КМ ІІ.
Беручи до уваги також відому залежність частоти виявлення дисплазії від наявності атрофії, нами було досліджено цей показник залежно від ступеня вираженості атрофічних змін СО шлунка у хворих на ХРГ. У нашому дослідженні наявність дисплазії була вірогідно пов’язана з тяжким ступенем атрофії, оскільки серед усіх хворих із дисплазією вона відмічена у 66,7 %, тоді як легка атрофія виявлялась лише у 1 пацієнта з дисплазією (11,1 %; рис. 5).
Враховуючи морфологічну та функціональну гетерогенність різних відділів шлунка, а також дані, підтверджені статистикою, щодо відмінностей в частоті раку шлунка цих відділів, проведено аналіз частоти виявлення КМ залежно від її локалізації у шлунку (рис. 6А).
Отримані результати свідчать, що у хворих на хронічний РГ КМ найчастіше спостерігалась в антральному відділі шлунка, сумарно 75 проти 25 % (р < 0,001). Для КМ І частота становила 62,5 % в антральному відділі проти 18,75 % у фундальному відділі шлунка (р < 0,001), що свідчить про вірогідно вищу частоту КМ, зокрема КМ І, в антральному відділі. Щодо КМ ІІ, то спостерігалась лише тенденція (р > 0,05) до збільшення частоти. Подібно до цього в антральному відділі дисплазія спостерігалась в 2 рази частіше, ніж у фундальному відділі (рис. 6Б).
Варто відзначити, що дисплазія СО шлунка часто супроводжувала виразкову хворобу шлунка та дванадцятипалої кишки (16,7 %), а також гастрит на тлі постхолецистектомічного синдрому (20 %), що є підставою для більш ретельного морфологічного дослідження у таких хворих.
Ще одним фактором ризику може виступати наявність клітин запалення в СО шлунка. Як відомо, запальні цитокіни можуть впливати на клітини шлункових залоз, а особливо на клітини в осередках КМ, значно посилюючи перебіг атрофічного гастриту [1]. У нашому дослідженні лімфоплазмоцитарна інфільтрація різного ступеня вираженості супроводжувала КМ у 100 % випадків. У меншої кількості хворих визначалась нейтрофільна інфільтрація (54,2 % — в антральному відділі, 41,9 % — у фундальному відділі; рис. 7А), що вказувало на активність процесу. Рідше запалення характеризувалось еозинофільним компонентом (8,5 % — в антральному відділі, 6,8 % — у фундальному відділі; рис. 7Б).
/17.jpg)
Водночас треба зауважити, що є певна неоднозначність цих даних, оскільки при проведенні морфологічних досліджень, зокрема оцінці вираженості диспластичних змін СО шлунка, існують певні складнощі щодо її чіткого розмежування, а також суб’єктивізм дослідника. У поле зору морфолога частіше потрапляють одразу декілька варіантів передракових змін, тому в конкретному морфологічному препараті вони дуже рідко присутні ізольовано в одному варіанті.
Через це вирішено для оцінки передракового потенціалу дослідити сумарну частоту виявлення передракових змін СО шлунка у вигляді такого морфологічного показника, як кишкова метаплазія у поєднанні з дисплазією (КМ + Д).
Отримані нами результати свідчать про те, що морфологічні зміни в групі КМ + Д вірогідно частіше супроводжуються гіперплазією залоз та інфекцією H.руlori (р < 0,05). При цьому серед хворих з КМ ІІ типу та дисплазією.
Аналогічно проведено порівняння рівня гастрину та нітросполук у хворих із кишковою метаплазією та/або дисплазією та без цих змін СО шлунка (табл. 1).
З цих даних виходить, що рівень нітритів був вірогідно підвищеним у хворих з метаплазією та/або дисплазією СО шлунка порівняно із хворими без цих змін (р < 0,05). Різниця у рівні нітратів була лише тенденцією (р > 0,05). Рівень гастрину також було дещо підвищено у групі КМ + Д.
Висновки
1. При гістологічному дослідженні СО шлунка хворих на ХРГ атрофічні процеси спостерігались в цілому у 73,3 % хворих, при цьому у 46,7 % до атрофії приєднувалися більш глибокі ураження: кишкова метаплазія та гіперплазія залоз. У 15 % випадків відмічалася дисплазія шлункових залоз, яка при порівнянні із КМ характеризувалася в першу чергу гіперхромазією та відносним збільшенням ядер клітин при частково збереженій залозистій будові.
2. Частота виявлення дисплазії шлункових залоз у хворих на ХРГ була тісно пов’язана із наявністю хелікобактерної інфекції та її ступенем: легкий ступінь обсіменіння було визначено лише в 11,1 % випадків (р > 0,05), помірний — у 33 % (р > 0,05), а виражений — у 55,6 % (p < 0,05).
3. У зв’язку з більшою частотою виявлення метапластичних і диспластичних змін СО шлунка у хворих на ХРГ підставою для більш ретельного морфологічного дослідження є наявність загострення хронічного гастриту, а також супутні діагнози виразкової хвороби шлунка та дванадцятипалої кишки, а також постхолецистектомічного синдрому.
4. Інтегральний показник «кишкова метаплазія + дисплазія» може слугувати додатковим критерієм оцінки тяжкості передракових змін СО шлунка у хворих на ХРГ, що вірогідно пов’язаний із гіперплазією шлункових залоз, інфекцією H.руlori, підвищенням рівня нітритів та тенденцією до збільшення рівня нітратів і гастрину.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Park Y.H. Review of Atrophic Gastritis and Intestinal Metaplasia as a Premalignant Lesion of Gastric Cancer / Y.H. Park, N. Kim // Journal of Cancer Prevention. — 2015. — № 20. — С. 25-40.
2. Bернигородський С.В. Патоморфологічні критерії в діагностиці різних типів хронічного гастриту / С.В. Bернигородський // Вісник морфології. — 2014. — № 2. — С. 493-496.
3. Lee S.Y. Endoscopic gastritis, serum pepsinogen assay, and Helicobacter pylori infection / Lee S.Y. // Korean J. Intern. Med. — 2016. — № 31(5). — С. 835-844.
4. Rugge M. Staging gastritis: an international proposal / M. Rugge, R.M. Genta // Gastroenterology. — 2005. — № 129. — С. 1807-1808.
5. Lee J.Y. Helicobacter pylori infection with Atrophic Gastritis Is an Independent Risk Factor for Advanced Colonic Neoplasm / J.Y. Lee, H.W. Park та ін. // Gut Liver. — 2016. — № 10(6). — С. 902-909.
6. Распространенность и факторы риска атрофического гастрита / Буторин Н.Н., Васютин А.В., Амельчугова О.С., Новицкая М.И. // Забайкальский медицинский вестник. — 2014. — № 2. — С. 149-152.
7. Clinicopathological features of gastric adenocarcinoma of the fundic gland (chief cell predominant type) by retrospective and prospective analyses of endoscopic findings / T. Chiba, K. Kato та ін. // Dig. Endosc. — 2016. — № 28(7). — С. 722-730.
8. Ohba R., Iijima K. Pathogenesis and risk factors for gastric cancer after Helicobacter pylori eradication / R. Ohba, K. Iijima // World J. Gastrointest. Oncol. — 2016. — № 8(9). — С. 663-672.
9. The induction of intestinal metaplasia in rats by pyloroplasty or pyloroplasty plus vagotomy / I. Fujii, H. Watanabe, M. Naito, K. Kawashima // Pathol. Res. Pract. — 1985. — № 180. — С. 502-505.
10. The effects of ranitidine and cysteamine on intestinal metaplasia induced by X-irradiation in rats / H. Watanabe, M. Kamikawa, Y. Nakagawa, T. Takahashi // Acta Pathol. Jpn. — 1988. — № 38. — С. 1285-1296.
11. Watanabe H. and Influence of gastric pH modifiers on development of intestinal metaplasia induced by X-irradiation in rats / H.Watanabe, T. Okamoto, Y. Fudaba, A. Ito // Jpn. J. Cancer. Res. — 1993. — № 84. — С. 1037-1042.
12. Effects of subtotal resection of the fundus on development of intestinal metaplasia induced by X-ray irradiation in Donryu rats / K. Kinoshita, H. Watanabe, Y. Ando та ін. // Pathol. Int. — 2000. — № 50. — С. 879-883.
13. Аруин Л.И. Морфологическая диагностика болезней желудка и кишечника / Л.И. Аруин, Л.Л. Капуллер, В.А. Исаков. — М.: Триада-Х, 1998.
14. О роли дуоденогастрального рефлюкса в патогенезе язвенной болезни двенадцатиперстной кишки / Волков В.С., Колесникова И.Ю., Беляева Г.С. и др. // Терапевтическая гастроэнтерология. — 2003. — № 1. — С. 12-17.
15. Коржевский Д.Э. Основы гистологической техники / Д.Э. Коржевский, А.В. Гиляров. — СПб.: СпецЛит, 2010.
16. Fererra T. ImageJ: image processing and analysis in Java / Tiago Ferreira, Wayne Rasband. — Bethesda: National Institute of Mental Health, 2012.
17. Myra L.S. Statistics for the Life Sciences (4th еd.) / L.S. Myra, A.W. Jeffrey, S. Andrew. — New York: Pearson, 2012.

/15.jpg)
/16.jpg)
/16_2.jpg)
/17.jpg)
/17_2.jpg)