Журнал «» 2 (40) 2015
Вернуться к номеру
Артеріальна гіпертензія та застосування статинів у світлі нових досліджень та рекомендацій
Авторы: Сіренко Ю.М., Рековець О.Л. — ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, м. Київ
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 23-31
Останні роки характеризуються позитивними результатами в лікуванні хворих з артеріальною гіпертензією (АГ), що виражається у зменшенні частоти виникнення гострих ускладнень та подовженні тривалості життя. Це пов’язано з упровадженням у практику нових лікарських засобів та їх комбінацій і стратегії ведення хворих на основі доказової медицини. Метою лікування хворих на АГ є максимальне зниження ризику розвитку серцево-судинних ускладнень. Відповідно до сучасних рекомендацій, лікуванню підлягають усі фактори ризику, що коригуються, супутні захворювання, такі як цукровий діабет (ЦД), серцева недостатність (СН), хронічна хвороба нирок (ХХН), ішемічна хвороба серця (ІХС) та ін., а також підвищений артеріальний тиск (АТ) як такий. Хворі на АГ мають у 7 разів більшу частоту виникнення інсульту, у 6 разів — СН, у 4 рази — виникнення ІХС, у 2 рази — розвитку ураження периферичних артерій. Ризик виникнення основних серцево-судинних ускладнень збільшується на 30–40 % на кожні 10 мм рт.ст. підвищення систолічного АТ (САТ) у хворих обох статей та всіх вікових категорій. За даними різних метааналізів рандомізованих досліджень, застосування антигіпертензивної терапії дало змогу знизити ризик виникнення інсульту в середньому на 40 % (як фатального, так і нефатального), а коронарних ускладнень — на 20–25 %.
Гіперхолестеринемія є незалежним ризик-фактором розвитку серцево-судинних захворювань (ССЗ), у тому числі й інсульту. Широке застосування статинів розпочалося з 1994 року, коли були оголошені результати дослідження 4S, де було доведено, що 4-річний прийом симвастатину з метою вторинної профілактики у пацієнтів із ІХС порівняно з плацебо зменшував ризик кардіальної смерті на 42 %, загальної смертності — на 30 %, також спостерігали зменшення частоти інсульту та транзиторної ішемічної атаки (ТІА) на 28 %.
Механізми впливу АГ на прогресування атеросклерозу в кровоносних судинах можна розглянути таким чином. При АГ збільшується турбулентність крові в місцях біфуркації артерій, що призводить до ризику розвитку атеросклеротичного ураження судини. Також має місце механічний фактор: ураження медії та ураження ендотелію судини. Ураження медії включає стимуляцію росту гладком’язових клітин судинної стінки та стимуляцію синтезу колагену. Внаслідок ураження ендотелію підвищується проникність судинної стінки для ліпідів та вільних радикалів та відбувається вивільнення судинних факторів росту. Наслідком таких уражень ендотелію та медії є розвиток атеросклеротичних бляшок.
Механізм дії статинів при АГ полягає у зниженні рівня ліпідів крові, зниженні АТ, плейотропних ефектах — протизапальних та антипроліферативних. Основний механізм дії статинів пов’язаний з оборотною блокадою ферменту ГМГ-КоА-редуктази, що забезпечує синтез холестерину (ХС). Зниження внутрішньоклітинної концентрації ХС стимулює функцію клітинних рецепторів і підвищує плазмовий кліренс ХС ліпопротеїдів низької щільності (ЛПНЩ). Терапія статинами сприяє зниженню вмісту ХС ЛПНЩ у сироватці крові на 25–40 %, зниженню тригліцеридів на 15–50 %, підвищенню ХС ліпопротеїдів високої щільності (ЛПВЩ) на 5–15 %. Існують розрахунки, за якими за умови зниження ХС на кожні 0,6 ммоль/л протягом перших двох років терапії статинами ризик розвитку ускладнень (нефатальний інфаркт міокарда (ІМ) та смерть) зменшується на 7 % і ще на 22 % — протягом наступних 3–5 років.
Фармакологічні особливості статинів наведені в табл. 1.
Якій категорії пацієнтів з АГ призначаються статини. Згідно з клінічною настановою «Артеріальна гіпертензія» 2012 р. [2], всі хворі на АГ з установленими серцево-судинними захворюваннями або з ЦД 2-го типу повинні отримувати терапію статинами, спрямовану на зниження рівня загального ХС і ХС ЛПНЩ у крові до < 4,5 ммоль/л (175 мг/дл) і < 2,5 ммоль/л (100 мг/дл) відповідно і до більш низького рівня, якщо це можливо. Хворі з АГ, які не мають серцево-судинних захворювань, але з високим серцево-судинним ризиком (ССР) (≥ 20 % упродовж наступних 10 років) також повинні отримувати терапію статинами, навіть якщо рівень загального ХС або ХС ЛПНЩ у них не підвищений.
Вплив статинів на артеріальний тиск
Метааналіз 20 рандомізованих досліджень застосування статинів із метою первинної профілактики показав невеликий, але достовірний вплив статинів на зниження систолічного АТ та тенденцію до зниження діастолічного АТ (ДАТ). Регресійний аналіз показав, що чим вищий був початковий рівень АТ, тим ефективнішим було зниження АТ на фоні статинів. Дослідження ASCOT довело достовірну різницю в зниженні АТ між групою пацієнтів, які отримували аторвастатин та групою плацебо через 2,5 року лікування з максимальною різницею між групами 1,1/0,7 мм рт.ст. [26]. Схожі результати були отримані в San Diego Statin Study, де в обох групах лікування симвастатином та правастатином було доведено переваги в зниженні АТ над групою плацебо, а максимальна різниця між групами становила 2,8/2,7 мм рт.ст. [14]. Можливі механізми зниження АТ на фоні статинів були вивчені в експериментальних дослідженнях. Так, статини підвищували продукцію NO ендотеліальними клітинами, що сприяло вазодилатації, а також зменшували вивільнення вазоконстриктора ендотеліну-1, покращуючи ендотеліальну функцію. Ці ефекти були ранніми, виникали відразу після прийому статинів і не пов’язані з їх холестеринзнижуючими властивостями.
У рандомізованому дослідженні UCSD вивчали вплив 20 мг симвастатину та 40 мг правастатину на зниження АТ у пацієнтів з АГ протягом 6 місяців. 973 пацієнти (частково з АГ) з рівнем ХС ЛПНЩ 115–190 мг/дл без відомих ССЗ та ЦД було включено в дослідження. Пацієнти не приймали жодних антигіпертензивних препаратів. Статини вірогідно знизили рівень САТ на 2,2 мм рт.ст. (р = 0,02) і на 2,4 мм рт.ст. ДАТ (р < 0,001) [10]. Автори пояснюють такі ефекти статинів їх здатністю активізувати вивільнення оксиду азоту ендотеліальними клітинами та покращувати ендотеліальну функцію, а також здатністю пригнічувати вивільнення ангіотензину II (АТ II). Даний ефект статинів не спостерігався у пацієнтів із цукровим діабетом та низьким початковим рівнем ХС ЛПНЩ.
Васкулопротекторний ефект статинів не викликає сумнівів. Здатність знижувати ризик утворення атеросклеротичної бляшки зумовлена як їх гіполіпідемічною активністю, так і комплексом унікальних плейотропних властивостей. Статини дозволяють не лише покращувати функцію клітин ендотелію, але й зберігати його нормальну морфологічну структуру. Лікування статинами сприяє відновленню необхідного клітинного складу адвентиціального, ендотеліального та м’язового шарів артерії. Збереження їх архітектоніки, насамперед структури м’язового шару, лежить в основі запобігання прогресуванню артеріальної жорсткості й механічному пошкодженню атеросклеротичних бляшок із подальшим розвитком атеротромботичних ускладнень. Наприклад, у дослідженні SHIPAS (Shiga Pravastatin Atherosclerosis Study) 6-місячний прийом статинів у пацієнтів віком 60–65 років з АГ та помірною гіперхолестеринемією (середній рівень загального холестерину — 6,6 ммоль/л) дозволив достовірно зменшити жорсткість артеріальної стінки. Водночас у хворих, які не приймали статинів, навіть за кращих початкових параметрів ліпідного обміну (середній рівень загального холестерину — 4,6 ммоль/л) спостерігали підвищення показників артеріальної жорсткості [21].
Статини показали свій вплив на зменшення жорсткості артерій ще в одному дослідженні. Так, при сімейній гіперхолестеринемії на фоні 12-місячного лікування симвастатином або аторвастатином спостерігалося покращення еластичності стегнової артерії, таких змін у сонній артерії не спостерігалося. Покращення еластичності аорти спостерігалося на фоні 13-місячного лікування правастатином, а радіальної артерії — на фоні 2-річного лікування симвастатином [21]. При сімейній гіперхолестеринемії симвастатин зменшував швидкість поширення пульсової хвилі по а.tibialis, але в той же час по сегменту aorta — a.femoralis вона не змінювалася.
Z. Wang et al. досліджували взаємозв’язок лікування статинами та жорсткості судин у гіпертензивних та нормотензивних пацієнтів із ССЗ та довели зменшення жорсткості судин у пацієнтів із ССЗ в обох групах. Швидкість поширення пульсової хвилі була достовірно меншою у пацієнтів, які лікувалися будь-яким статином (аторвастатином, симвастатином, розувастатином, правастатином), порівняно з групою пацієнтів, які не приймали статини, це стосується як нормотензивних, так і гіпертензивних пацієнтів [38, 39].
Гіпертензивне ремоделювання артерій, поглиблене дисметаболічними змінами (гіперліпідемія, гіперглікемія, інсулінорезистентність тощо), характерне для осіб із високим кардіоваскулярним ризиком, є фактором ризику розвитку атеротромботичних ускладнень. Вони ж, у свою чергу, є актуальними причинами втрати працездатності, інвалідизації та смерті пацієнтів з АГ. Тому фармакотерапія, спрямована на максимальну ангіопротекцію, є найбільш виправданою перспективною стратегією зниження серцево-судинного ризику в цих осіб. Серед лікарських засобів, що мають доведену здатність покращувати структурно-функціональний стан артерій, починаючи з мікроциркуляторного відділу артеріального русла і закінчуючи артеріями середнього й великого калібру, найбільша васкулопротекторна ефективність властива ІАПФ, блокаторам кальцієвих каналів і статинам. Комбінації цих препаратів дозволяють досягати не лише оптимальної антигіпертензивної та найвищої ангіопротекторної дії, але й істотно покращувати прогноз хворих.
Таким чином, у багатьох дослідженнях доведені позитивні ефекти статинів щодо зниження не тільки рівня холестерину, але й АТ, у покращенні еластичності судин та пружно-еластичних властивостей артерій.
Експериментальні дослідження
Прийом статинів зменшує смертність від серцево-судинних захворювань. Цей ефект проявляється завдяки ліпідознижуючим властивостям статинів. Але позитивні ефекти статинів на серцево-судинний ризик були відмічені в пацієнтів без підвищеного рівня холестерину та його фракцій. Існують дослідження, що доводять вплив статинів на зменшення артеріального тиску завдяки їх взаємодії з ренін-ангіотензиновою системою [9]. Статини підвищують антигіпертензивну ефективність блокаторів рецепторів до АТ II (БРА) та інгібіторів ангіотензинперетворюючого ферменту (АПФ). Хоча дані клінічних та експериментальних досліджень досить суперечливі [9]. Механізми, що сприяють контролю АТ, поділяються на короткострокові та довгострокові. Короткострокові механізми, такі як барорефлекторні, мають на меті запобігання раптовим змінам АТ завдяки впливу нервової системи на судинну ємкість та серцевий викид. У той час як довгострокові механізми контролю АТ реалізуються через регуляцію об’єму крові, що регулюється гормональною активністю нирок, а саме ренін-ангіотензиновою системою [13].
A. Drapala et al. в експерименті на щурах досліджували порівняльний вплив статинів, а саме симвастатину та правастатину, на артеріальний тиск, вазоконстрикцію та ефекти АТ II у щурів [9]. Так, після інфузії ангіотензину II в контрольній групі було виявлено значне підвищення середнього АТ на 24,3 мм рт.ст., р < 0,001, тоді як у групі симвастатину підвищення АТ становило 14,3 мм рт.ст., р < 0,001, а в групі правастатину — 6,9 мм рт.ст., р < 0,001. Також було виявлено, що в групах симвастатину та правастатину спостерігався значно менший вазоконстрикторний ефект АТ II порівняно з групою контролю. Лікування симвастатином та правастатином не впливало достовірно на барорефлекторні функції порівняно з контрольною групою. Незважаючи на значну різницю в гемодинамічних та вазоконстрикторних відповідях на АТ II, дослідники не відмітили різниці між рівнями холестерину крові в контрольній групі та групі статинів. Позитивні ефекти статинів у високих дозах на рівень холестерину крові у тварин із нормальним рівнем холестерину було відмічено в деяких дослідників [7, 13, 19, 34].
Деякі клінічні та експериментальні дослідження показали, що коли статини не справляють прямого впливу на АТ самостійно, то вони сприяють антигіпертензивному ефекту інгібіторів АПФ та БРА. Так, у гіпертензивних тварин симвастатин, що призначався разом з еналаприлом, підвищував його антигіпертензивну ефективність [16]. Sposito зі співавт. показали, що в пацієнтів із підвищеним вмістом холестерину додавання статину до інгібітору АПФ сприяло більшому зниженню АТ порівняно з групою монотерапії інгібітором АПФ [28]. Симвастатин зменшує гіпертензивний ефект АТ II завдяки двом механізмам: пригніченню вазоконстрикторного ефекту АТ II та впливу на АТ II як активатора симпатичної нервової системи. Правастатин зменшує гіпертензивну відповідь лише шляхом пригнічення вазоконстрикторного ефекту АТ II [17]. Тому ефект правастатину менш виражений. Tesfamariam зі співавт. встановили, що аторвастатин та симвастатин, але не правастатин зменшували чутливість аорти до АТ II [33]. В іншому дослідженні Sim et al. показано, що лікування статинами підвищувало чутливість судин до АТ II у пацієнтів із гіперхолестеринемією [27]. Правастатин не проникає через гематоенцефалічний бар’єр на відміну від симвастатину. Деякими дослідниками встановлений ефект правастатину та аторвастатину на PPAR-гамма рецептори, подібний до ефекту БРА телмісартану, як один із можливих механізмів зниження АТ [11, 36].
Первинна профілактика
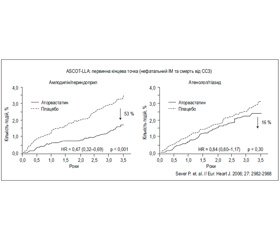
Переваги застосування статинів як засобу первинної профілактики разом з антигіпертензивним лікуванням були чітко доведені в дослідженні ASCOT-LLA [26], що було відмічено в Європейських рекомендаціях із лікування АГ 2007 року. Результати ліпідної гілки дослідження ASCOT-LLA безперечно довели, що застосування аторвастатину додатково до антигіпертензивних препаратів зменшувало ризик розвитку фатального та нефатального інсульту на 27 % (р = 0,024), усіх серцево-судинних ускладнень — на 21 % (р = 0,0005), коронарних подій — на 29 % (р = 0,0005) [26, 30]. Результати дослідження ASCOT підтвердили, що застосування статинів у хворих на АГ високого ризику ефективно запобігає розвитку основних серцево-судинних та цереброваскулярних ускладнень без достовірного впливу на рівень АТ. Результати наведені на рис. 1.
В іншому дослідженні ALLHAT [20], у якому брали участь пацієнти з АГ, показники загальної смертності при застосуванні правастатину порівняно зі звичайною терапією достовірно не відрізнялися і становили 14,9 та 15,3 % відповідно. Частота розвитку ускладнень ІХС також достовірно не відрізнялася та становила 9,3 та 10,4 % відповідно, хоча рівень ХС ЛПНЩ знизився на 17 та 8 % відповідно. Неефективність правастатину в зниженні частоти розвитку ІХС та загальної смертності в дослідженні ALLHAT автори пояснюють відносно незначним зниженням рівня ХС ЛПНЩ.
Важливими стали результати дослідження HPS (2002), у якому брали участь понад 20 тис. хворих на ІХС без попередньої цереброваскулярної патології. Строк спостереження в середньому становив 5,5 року. Симвастатин у дозі 40 мг на добу призначався всім хворим на ІХС без підвищеного рівня загального холестерину. У результаті було доведено, що застосування статину порівняно з плацебо знижувало загальну смертність на 12 %, смертність від серцево-судинних причин — на 17 %, а ризик розвитку інсульту (як ішемічного, так і геморагічного) — на 27 %. Аналіз підгрупи пацієнтів з АГ та без неї продемонстрував однакову ефективність симвастатину в запобіганні інсульту [12].
Позитивний вплив призначення статинів у пацієнтів без серцево-судинних ускладнень було доведено в дослідженні JUPITER, у якому зниження ХС ЛПНЩ на 50 % у хворих із початковим його значенням менше ніж 130 мг/дл (3,4 ммоль/л), але з підвищеним вмістом С-реактивного протеїну (СРП) знижувало ризик серцево-судинних ускладнень на 44 % [22].
На рис. 1 наведені результати потенціювання статином ефективності антигіпертензивного лікування за результатами ASCOT-LLA.
Подальший аналіз результатів дослідження ASCOT показав, що додавання статину до антигіпертензивної терапії на основі амлодипіну сприяло зменшенню частоти розвитку первинної кінцевої точки більш значущо, ніж додавання статину до терапії АГ на основі атенололу [26].
У Європейських рекомендаціях з АГ 2007 року записано положення про необхідність призначення статинів у хворих на АГ з 10-річним ризиком розвитку серцево-судинних ускладнень більше як 20 %. Результати дослідження JUPITER прогнозують, що позитивний вплив статинів може спостерігатися і при помірному серцево-судинному ризику (15 % серцево-судинних ускладнень протягом 10 років) у пацієнтів із підвищеним вмістом СРП [22].
У дослідженні CARDS для первинної профілактики серцево-судинних захворювань у пацієнтів із ЦД 2-го типу вивчали ефективність аторвастатину в дозі 10 мг на добу. Було включено 2838 пацієнтів (68 % чоловіків), середній вік яких становив 62 роки, середня тривалість ЦД — 7,9 року [8]. Середня тривалість дослідження — 3,9 року. Первинними кінцевими точками були розвиток гострого інфаркту міокарда, нестабільної стенокардії, проведення реваскуляризації, розвиток інсульту. Пацієнти, які були включені в дослідження, мали хоча б один із ризик-факторів ССЗ: АТ ≥ 140/90 мм рт.ст. на фоні лікування, ретинопатію, мікроальбумінурію або протеїнурію. Результатом дослідження стало зниження частоти виникнення ішемічного інсульту на фоні лікування аторвастатином на рівні 48 %. Зниження гострих коронарних подій становило 36 %, реваскуляризації — 31 %, зниження загальної смертності — 27 %. Спостерігався помірний позитивний ефект аторвастатину на швидкість клубочкової фільтрації (ШКФ), особливо в пацієнтів із мікроальбумінурією, хоча аторвастатин не впливав на зменшення мікроальбумінурії. Аторвастатин ефективно на 42 % знижував ризик серцево-судинних захворювань у пацієнтів з помірно зниженою ШКФ та без неї та на 61 % знижував ризик розвитку інсульту в даної категорії пацієнтів. Кількість побічних реакцій у групі аторвастатину та плацебо становила 8,9 та 10 % відповідно.
Таким чином, результати дослідження CARDS показали, що аторвастатин у дозі 10 мг на добу є ефективним та безпечним препаратом для зниження ризику первинних серцево-судинних захворювань, включаючи інсульт, у хворих на ЦД 2-го типу без високого рівня ХС ЛПНЩ.
У табл. 2 наведена порівняльна характеристика досліджень ліпідознижуючої терапії як первинної профілактики у пацієнтів із цукровим діабетом. Як видно з табл. 2, дослідження CARDS та HPS доводять достовірний позитивний вплив 10 мг аторвастатину та 40 мг симвастатину на зменшення ризику розвитку ІХС у пацієнтів із ЦД [8, 12].
Одним із можливих побічних ефектів, асоційованих із прийомом статинів, вважали розвиток онкологічних захворювань. F. Taylor, K. Ward, T.H.M. Moore et al. провели аналіз ризику розвитку раку при первинній профілактиці в дослідженнях і виявили, що не було достовірної різниці між групами статинів та плацебо. Ризик розвитку побічних ефектів також не відрізнявся між групами [32].
Розглядаючи гіпотезу, що статини можуть покращувати ендотеліальну функцію та зменшувати жорсткість артерій, що, у свою чергу, впливатиме на центральний аортальний тиск, у дослідженні CAFE-LLA вивчався вплив статинів на жорсткість артерій у пацієнтів з АГ. Пацієнти (891 особа) були рандомізовані в групу аторвастатину 10 мг або плацебо. Виявилося, що аторвастатин не впливав на центральний аортальний тиск та індекс аугментації. Не було виявлено достовірного впливу аторвастатину на жорсткість артерій, визначену як швидкість поширення пульсової хвилі. CAFE-LLA — перше велике плацебо-контрольоване дослідження, що вивчало вплив терапії статинами на взаємозв’язок між АТ, виміряним на плечовій артерії, та центральним аортальним тиском [37]. Позитивні ефекти статинів щодо зниження серцево-судинних подій завдяки їх ліпідознижуючим та плейотропним властивостям мають більше переваг, ніж гемодинамічні ефекти щодо центрального аортального тиску.
Вивчали вплив статинів на серцево-судинні події та побічні реакції залежно від статі. Було проаналізовано 6 досліджень із використанням аторвастатину: IDEAL, TNT, SPARCL, CARDS, ASCOT, ASPEN [4, 6]. Так, розвиток серцево-судинних подій спостерігався у 10,3 % чоловіків та у 9,0 % жінок. Зміни ліпідного спектра в чоловіків та жінок були однаковими. У жінок на відміну від чоловіків високий рівень ХС ЛПНЩ був предиктором розвитку інсульту, а в чоловіків — серцево-судинної смертності. Жінки, які недавно перенесли гостре порушення мозкового кровообігу або ТІА, були старшими за віком, мали вищий рівень САТ та пульсового АТ, більше палили, мали вищий рівень ХС ЛПНЩ порівняно з чоловіками. Не спостерігалося гендерної відмінності в розвитку нових випадків цукрового діабету в 6 дослідженнях. Припинення прийому статинів через розвиток побічних реакцій спостерігалося частіше у жінок — у 4 із 6 досліджень, і лише в одному дослідженні — у чоловіків. Міалгія дещо частіше спостерігалась у жінок [23].
Вторинна профілактика
Метааналіз ефективності статинів для вторинної профілактики ССЗ показав, що статини знижують ризик ІХС. Тривалий час роль статинів у вторинній профілактиці інсульту у пацієнтів без ІХС була невідома. Дослідження SPARCL виявило, що прийом аторвастатину у високій дозі (80 мг на добу) на 16 % знижує ризик повторного інсульту і в першу чергу фатального — на 43 % та інших серцево-судинних ускладнень [4]. Також встановлено, що застосування статинів, а саме аторвастатину, у підгрупах пацієнтів зі стенозами сонних артерій більш ефективне порівняно з пацієнтами без таких стенозів. У дослідження загалом було включено близько 4,5 тис. пацієнтів після перенесеного інсульту або ТІА, термін спостереження — 4,9 року. У дослідженні не було визначено цільовий рівень холестерину для його зниження.
В іншому дослідженні TNT, у яке було включено 10 тис. пацієнтів із ССЗ, хворих рандомізували на дві групи: у групу аторвастатину 80 мг та в групу аторвастатину 10 мг. Аналіз підгрупи пацієнтів, які перенесли аортокоронарне шунтування (АКШ) показав, що прийом аторвастатину в дозі 80 мг на добу асоціювався зі значним зниженням серцево-судинних ускладнень та зменшенням частоти реваскуляризацій порівняно з прийомом аторвастатину 10 мг [3]. Останні настанови АНА/АСС рекомендують високоінтенсивну терапію статинами для більшості пацієнтів із ССЗ, у тому числі і тих, які перенесли АКШ.
Огляд рекомендацій
У листопаді 2013 року були опубліковані рекомендації Американської асоціації серця (АНА) та Американського коледжу кардіологів (АСС) з корекції підвищеного рівня холестерину в дорослих пацієнтів із ризиком атеросклеротичних серцево-судинних захворювань (АССЗ) [29].
Згідно з рекомендаціями, статини для первинної профілактики АССЗ показані всім пацієнтам високого ризику та всім пацієнтам для вторинної профілактики без наявної СН II–IV ФК за NYHA та без гемодіалізу. Показано, що статинотерапія зменшує ризик ССЗ при початковому рівні ХС ЛПНЩ ≥ 1,8 ммоль/л (70 мг/дл) у всіх пацієнтів із наявними АССЗ та без них [3, 29].
Поняття «клінічно значиме АССЗ» включає гострий коронарний синдром, інфаркт міокарда в анамнезі, стабільну або нестабільну стенокардію напруження, реваскуляризацію коронарних чи будь-яких інших судин, інсульт, ТІА, атеросклеротичне захворювання периферичних артерій.
Було введено 4 основні групи пацієнтів, користь від ліпідознижуючої терапії у яких найбільша: перша група — це пацієнти з клінічно значимими АССЗ — як вторинна профілактика; друга група — пацієнти з первинним підвищенням рівня ХС ЛПНЩ ≥ 4,9 ммоль/л (≥ 190 мг/дл) — як первинна профілактика; третя група — пацієнти віком 40–74 роки з рівнем ХС ЛПНЩ ≥ 1,8 ммоль/л (≥ 70 мг/дл) із цукровим діабетом але без клінічно значимого АССЗ — як первинна профілактика; четверта група — пацієнти без клінічно значимого АССЗ або ЦД з рівнем ХС ЛПНЩ ≥ 1,8 ммоль/л (≥ 70 мг/дл) та 10-річним СС-ризиком ≥ 7,5 % — як первинна профілактика [18].
У даних рекомендаціях відмовилися від титрування дози статинів як для первинної, так і для вторинної профілактики АССЗ до досягнення цільових рівнів ХС та ХС ЛПНЩ. Було виділено три режими статинотерапії (високо-, помірно- та низькоінтенсивний режим) залежно від здатності знижувати рівень ХС ЛПНЩ. Була виявлена відсутність достовірних відмінностей між різними статинами та дозами статинів щодо впливу на ризик АССЗ як для первинної, так і для вторинної профілактики.
Високоінтенсивна терапія: щоденне застосування статину знижує рівень ХС ЛПНЩ ≥ 50 % (аторвастатин — у дозі 40–80 мг, розувастатин — у дозі 20–40 мг).
Помірноінтенсивна терапія: щоденне застосування статину знижує рівень ХС ЛПНЩ на 30–50 %: аторвастатин — 10–20 мг, розувастатин — 5–10 мг, симвастатин — 20–40 мг, пітавастатин — 2–4 мг, правастатин — 40–80 мг, ловастатин — 40 мг, флувастатин — 40 мг.
Низькоінтенсивна терапія: щоденне застосування статину знижує рівень ХС ЛПНЩ < 30 %: симвастатин — 10 мг, пітавастатин — 1 мг, правастатин — 10–20 мг, ловастатин — 20 мг, флувастатин — 20–40 мг.
Інтенсивність терапії статинами має визначатися на нижчезазначених засадах.
Для вторинної профілактики:
1. Високоінтенсивна терапія статинами (як терапія першої лінії) має бути розпочата або продовжена для дорослих чоловіків і жінок ≤ 75 років із клінічно значимими АССЗ (рівень доказовості I, A).
2. Якщо в пацієнтів із клінічно значимими АССЗ неможливе проведення високоінтенсивної терапії, тоді рекомендовано застосування помірноінтенсивної статинотерапії (рівень доказовості I, A).
3. У пацієнтів із клінічно значимим АССЗ > 75 років, якщо користь переважає над побічними ефектами від терапії, рекомендована помірноінтенсивна терапія або терапія в максимально переносимій дозі (рівень доказовості IIa, B).
Для первинної профілактики у пацієнтів віком ≥ 21 рік з рівнем ХС ЛПНЩ ≥ 4,9 ммоль/л(≥ 190 мг/дл):
1. Пацієнти віком ≥ 21 рік з первинним рівнем ХС ЛПНЩ ≥ 4,9 ммоль/л (≥ 190 мг/дл) мають отримувати високоінтенсивну терапію статинами або терапію в максимально переносимій дозі (при непереносимості високоінтенсивної терапії) (рівень доказовості I, B). Терапія має сприяти як мінімум 50% зниженню рівня ХС ЛПНЩ (рівень доказовості IIa, B). Після лікування має бути оцінений рівень ХС ЛПНЩ і за необхідності можуть бути додані інші (нестатинові) ліпідознижуючі препарати (рівень доказовості IIб, С).
Для первинної профілактики у пацієнтів із цукровим діабетом та рівнем ХС ЛПНЩ ≥ 70 мг/дл (≥ 1,8 ммоль/л):
1. Пацієнти віком 40–75 років із ЦД повинні приймати помірноінтенсивну терапію статинами (рівень доказовості I, A).
2. Високоінтенсивна терапія статинами пацієнтам віком 40–75 років із ЦД рекомендована, якщо 10-річний ризик розвитку АССЗ ≥ 7,5 % за відсутності протипоказань (рівень доказовості IIa, B).
3. У хворих на ЦД < 40 років чи > 75 років або рівнем ХС ЛПНЩ < 1,8 ммоль/л (< 70 мг/дл) для вирішення питання про призначення або продовження терапії статинами, а також для вибору інтенсивності режиму терапії необхідно оцінити співвідношення «ризик/користь» (рівень доказовості IIа, С).
Для первинної профілактики у пацієнтів без цукрового діабету та рівнем ХС ЛПНЩ ≥ 70 мг/дл (≥ 1,8 ммоль/л):
1. Дорослим пацієнтам віком 40–75 років без клінічно значимих АССЗ та з оцінкою 10-річного ризику АССЗ ≥ 7,5 % призначається високо- та помірноінтенсивна терапія статинами (рівень доказовості I, А).
2. Якщо в цих пацієнтів 10-річний ризик АССЗ від 5 до < 7,5 %, рекомендована помірноінтенсивна терапія статинами (рівень доказовості IIа, В).
Згідно з рекомендаціями Європейського товариства кардіологів (ESC, 2013), цільовими рівнями гіполіпідемічної терапії є зниження ХС ЛПНЩ до < 1,8 ммоль/л (70 мг/дл) або на > 50 % від початкового рівня [30, 31]. Стосовно пацієнтів, яким заплановано проведення стентування, рекомендована високоінтенсивна терапія аторвастатином.
АГ часто поєднується з цукровим діабетом. У 2014 році вийшли нові рекомендації Американської асоціації з цукрового діабету (ADA, 2014), згідно з якими терапію статинами при ЦД слід призначати всім пацієнтам незалежно від початкового рівня ліпідів крові, якщо [3, 15]:
— у пацієнта є клінічно значиме ССЗ;
— у пацієнтів без клінічно значимого ССЗ віком понад 40 років за наявності хоча б одного фактора ризику (АГ, дисліпідемія, паління, сімейний анамнез ССЗ, наявність альбумінурії).
— у пацієнтів із ЦД без клінічно значимого ССЗ віком менше 40 років, якщо рівень ХС ЛПНЩ > 2,5 ммоль/л (100 мг/дл), або за наявності декількох факторів ризику.
У Британських рекомендаціях NICE для пацієнтів із ЦД 2-го типу, якщо 10-річний ризик розвитку ССЗ ≥ 10 %, з метою первинної профілактики рекомендовано застосування аторвастатину в дозі 20 мг. Для вторинної профілактики рекомендована високодозова терапія аторвастатином 80 мг [3, 24].
Якщо в пацієнта є хронічна хвороба нирок, то в міжнародному керівництві KDIGO рекомендації щодо ліпідознижуючої терапії виглядають таким чином [3, 5, 25, 35].
Пацієнтам ≥ 50 років із ХХН та рівнем ШКФ ≥ 60 або < 60 мл/хв рекомендоване призначення статинів.
Пацієнтам віком 18–49 років із ХХН рекомендовано призначення терапії статинами за наявності одного з факторів ризику:
— задокументована ІХС (ІМ чи коронарна реваскуляризація);
— ЦД;
— інсульт в анамнезі;
— 10-річний ризик ССЗ > 10 %.
У пацієнтів, які знаходяться на гемодіалізі та не отримували статини, розпочинати терапію статинами не рекомендовано, але якщо пацієнт уже отримував статини, то рекомендовано продовжити терапію.
У пацієнтів із ХХН при ШКФ < 60 мл/хв рекомендована доза аторвастатину 20 мг, розувастатину 10 мг, симвастатину 40 мг, пітавастатину 2 мг, правастатину 40 мг, флувастатину 80 мг.
У пацієнтів із ХХН при ШКФ ≥ 60 мл/хв рекомендована терапія статинами на загальних принципах.
У Європейських рекомендаціях ESC (2012) при ХХН рекомендують використовувати статини для зниження темпів втрати ниркової функції [30]. З огляду на позитивний вплив статинів на протеїнурію їх застосування рекомендоване для пацієнтів із 2–4-ю стадією ХХН. При помірно вираженій або тяжкій ХХН статини можуть призначатися як монотерапія і в комбінації з метою зниження рівня ХС ЛПНЩ < 1,8 ммоль/л (< 70 мг/дл). Пацієнтам із ХХН рекомендовано призначення препаратів, що метаболізуються переважно печінкою, у тому числі аторвастатину.
У Британських рекомендаціях NICE для первинної та вторинної профілактики ССЗ у пацієнтів із ХХН рекомендують застосовувати дозу аторвастатину 20 мг [24].
Відповідно до рекомендацій стосовно дисліпідемій Асоціації кардіологів України 2011 року для визначення цільових рівнів у лікуванні дисліпідемій використовують рівень ХС ЛПНЩ як індикатор відповіді на терапію [1].
— У пацієнтів із дуже високим ССР (встановлене ССЗ, ЦД 2-го та 1-го типу з ураженням органів-мішеней, помірна або тяжка ХХН чи ризик за шкалою SCORE > 10 %) слід досягнути цільового рівня ХС ЛПНЩ < 1,8 ммоль/л (< 70 мг/дл) і/або зниження > 50 %, якщо досягнути цільових рівнів не вдалося.
— У пацієнтів із високим ССР (значне підвищення одного фактора ризику, ризик за шкалою SCORE становить > 5–10 %) необхідно досягнути цільового рівня ХС ЛПНЩ < 2,5 ммоль/л (< 100 мг/дл).
— У пацієнтів із помірним ССР (ризик за шкалою SCORE становить > 1–5 %) варто досягнути цільового рівня ХС ЛПНЩ < 3,0 ммоль/л (< 115 мг/дл).
За неможливості визначення ХС ЛПНЩ слід використовувати такі цільові рівні загального ХС згідно з Європейськими рекомендаціями (2007): < 5 ммоль/л — для загальної популяції; < 4,5 ммоль/л — для пацієнтів із високим ризиком і < 4,0 ммоль/л — для пацієнтів із дуже високим ризиком.
Висновок
Розглядаючи підходи до лікування хворих на АГ за останні роки, ми стали свідками перетворення концепції гіпотензивної терапії на антигіпертензивну терапію. На сьогодні починає домінувати стратегія лікування пацієнта з АГ та ризиком розвитку серцево-судинних ускладнень. На даному етапі розвитку знань залежно від конкретного ступеня ризику в конкретного пацієнта слід розглядати три напрями у фармакотерапії: антигіпертензивні препарати (бажано з органопротекторними властивостями), антиагреганти та антигіперхолестеринемічні засоби (статини).
Виявлення ознак атеросклеротичного ураження мозкових судин як за наявністю атеросклеротичних бляшок, так і за збільшеною товщиною комплексу інтима-медіа у хворих на АГ означає необхідність призначення холестеринознижуючої терапії та досягнення цільових рівнів холестерину в сироватці крові. На даний момент доречність застосування статинів для первинної профілактики у хворих на АГ не підлягає сумнівам. Метааналіз багатоцентрових досліджень останніх років показує можливість зменшення загальної смертності з 9 до 30 % та ризику розвитку інсульту з 19 до 31 % на фоні терапії статинами [2–6, 10].
Незважаючи на значні досягнення медицини в лікуванні інсульту та реабілітації після нього, профілактичний підхід у цьому питанні буде набагато ефективнішим та значно дешевшим. Оскільки результати останніх досліджень дають дедалі більше доказів на користь такого підходу, то необхідність його впровадження в практику системи охорони здоров’я України не викликає сумніву.
Наявні дані доказової медицини на сьогодні свідчать, що застосування статинів у хворих з ІХС, у тому числі з супутньою АГ, навіть у пацієнтів із невисоким рівнем загального холестерину в сироватці крові, сприяє зниженню ризику виникнення первинного інсульту всіх типів на 20–30 % і, відповідно, зменшенню ризику серцево-судинної смертності — на 17–42 %.
Наведені дані багатьох досліджень свідчать, що застосування статинів як для первинної, так і для вторинної профілактики серцево-судинних захворювань та ускладнень у пацієнтів з АГ є необхідним компонентом та доведеним фактом.
Надруковано за підтримки представництва
«Файзер Ейч. Сі. Пі. Корпорейшн»
в Україні
WUKLIP0315049
1. Дисліпідемії: діагностика, профілактика та лікування. Методичні рекомендації Асоціації кардіологів України. — К., 2011.
2. Настанова та клінічний протокол надання медичної допомоги «Артеріальна гіпертензія». — К., 2012.
3. Medicine review. Кадиологический альманах. Спецвып. Достижения в диагностике, лечении и профилактике сердечно-сосудистых заболеваний. — 2014. — С. 293.
4. Amarenco P., Callahan A. 3rd, Campese V.M., Goldstein L.B., Hennerici M.G., Messig M., Sillesen H., Welch K.M., Wilson D.J., Zivin J.A. Effect of high–dose atorvastatin on renal function in subjects with stroke or transient ischemic attack in the SPARCL trial // Stroke. — 2014. — Vol. 45. — P. 2974–2982.
5. Baigent C., Landray M.J., Reith C., Emberson J., Wheeler D.C., Tomson C., Wanner C., Krane V., Cass A., Craig J., Neal B., Jiang L., Hooi L.S., Levin A., Agodoa L., Gaziano M., Kasiske B., Walker R., Massy Z.A., Feldt-Rasmussen B., Krairittichai U., Ophascharoensuk V., Fellström B., Holdaas H., Tesar V., Wiecek A., Grobbee D., de Zeeuw D., Grönhagen-Riska C., Dasgupta T., Lewis D., Herrington W., Mafham M., Majoni W., Wallendszus K., Grimm R., Pedersen T., Tobert J., Armitage J., Baxter A., Bray C., Chen Y., Chen Z., Hill M., Knott C., Parish S., Simpson D., Sleight P., Young A., Collins R.; SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial // Lancet — 2011. — Vol. 25, 377(9784). — P. 2181–2192.
6. Bangalore S., Fayyad R., Hovingh G.K., Laskey R., Vogt L., DeMicco D.A., Waters D.D.; Treating to New Targets Steering Committee and Investigators. Statin and the risk of renal-related serious adverse events: Analysis from the IDEAL, TNT, CARDS, ASPEN, SPARCL, and other placebo–controlled trials // Am. J. Cardiol. — 2014. — Vol. 15. — P. 2018–2020.
7. Bezerra D.G., Mandarim-de-Lacerda CA. Beneficial effect of simvastatin and pravastatin treatment on adverse cardiac remodelling and glomeruli loss in spontaneously hypertensive rats // Clin. Sci. (Lond). — 2005. — Vol. 108. — P. 349–355.
8. Colhoun H.M., Betteridge D.J., Durrington P.N., Hitman G.A., Neil H.A., Livingstone S.J., Thomason M.J., Mackness M.I., Charlton-Menys V., Fuller J.H.; CARDS investigators. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicentre randomised placebo-controlled trial // Lancet. — 2004. — Vol. 21–27, № 364(9435). — 685–696.
9. Drapala A., Sikora M., Ufnal M. Statins, the renin-angiotensin-aldosterone system and hypertension — a tale of another beneficial effect of statins // J. Renin. Angiotensin. Aldosterone Syst. — 2014. — Vol. 15. — P. 250–258.
10. Golomb B.A., Dimsdale J.E., White H.L., Ritchie J.B., Criqui M.H. Reduction in blood pressure with statins: results from the UCSD Statin Study, a randomized trial // Arch. Intern Med. — 2008. — Vol. 14. — P. 721–727.
11. Grip O., Janciauskiene S., Lindgren S. Atorvastatin activates PPAR-gamma and attenuates the inflammatory response in human monocytes // Inflamm. Res. — 2002. — Vol. 51. — P. 58–62.
12. Heart Protection Study Collaborative Group, Bulbulia R., Bowman L., Wallendszus K., Parish S., Armitage J., Peto R., Collins R. Effects on 11-year mortality and morbidity of lowering LDL cholesterol with simvastatin for about 5 years in 20,536 high-risk individuals: a randomised controlled trial // Lancet. — 2011. — Vol. 10. — P. 2013–2020.
13. Kassan M., Montero M.J., Sevilla M.A. Chronic treatment with pravastatin prevents early cardiovascular changes in spontaneously hypertensive rats // Br. J. Pharmacol. — 2009. — Vol. 158. — P. 541–547.
14. Kawut S.M., Bagiella E., Lederer D.J., Shimbo D., Horn E.M., Roberts K.E., Hill N.S., Barr R.G., Rosenzweig E.B., Post W., Tracy R.P., Palevsky H.I., Hassoun P.M., Girgis R.E.; ASA-STAT Study Group Randomized clinical trial of aspirin and simvastatin for pulmonary arterial hypertension: ASA–STAT// Circulation. — 2011. — Vol. 28. — P. 2985–93.
15. Krader C.G. American Diabetes Association. Diabetes clinical practice recommendations focus attention on individualization of care // Med. Econ. — 2014. — Vol. 25. — P. 22–24.
16. Ledingham J.M., Laverty R. Effect of simvastatin given alone and in combination with valsartan or enalapril on blood pressure and the structure of mesenteric resistance arteries and the basilar artery in the genetically hypertensive rat model // Clin. Exp. Pharmacol. Physiol. — 2005. — Vol. 32. — P. 76–85.
17. Leenen F.H. Actions of circulating angiotensin II and aldosterone in the brain contributing to hypertension // Am. J. Hypertens. — 2014. — Vol. 27. — P. 1024–1032.
18. Lopez-Jimenez F., Simha V., Thomas R.J., Allison T.G., Basu A., Fernandes R., Hurst R.T., Kopecky S.L., Kullo I.J., Mulvagh S.L., Thompson W.G., Trejo-Gutierrez J.F., Wright R.S. A summary and critical assessment of the 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular disease risk in adults: filling the gaps // Mayo. Clin. Proc. — 2014. — Vol. 89. — P. 1257–1278.
19. Lunder M., Ziberna L., Janić M., Jerin A., Skitek M., Sabović M., Drevenšek G. Low-dose atorvastatin, losartan, and particularly their combination, provide cardiovascular protection in isolated rat heart and aorta // Heart Vessels. — 2013. — Vol. 28. — P. 246–254.
20. Mancia G. The ALLHAT study: contributions, limitations and prospectives // Ital. Heart J. Suppl. — 2003. — Vol. 4 — P. 77–84.
21. Mancini G.B, Tashakkor A.Y., Baker S., Bergeron J., Fitchett D., Frohlich J., Genest J., Gupta M., Hegele R.A., Ng D.S., Pearson G.J., Pope J. Diagnosis, prevention, and management of statin adverse effects and intolerance: Canadian Working Group Consensus update // Can. J. Cardiol. — 2013. — Vol. 29. — P. 1553–1568.
22. Mora S., Ridker P.M. Justification for the Use of Statins in Primary Prevention: an Intervention Trial Evaluating Rosuvastatin (JUPITER) — can C-reactive protein be used to target statin therapy in primary prevention? // Am. J. Cardiol. — 2006. — Vol. 16(2A). — P. 33A–41A.
23. Priscilla Y. Hsue, Vera A. Bittner, John Betteridge, Rana Fayyad, Rachel Laskey, Nanette K. Wenger, David D. Waters Impact of Female Sex on Lipid Lowering, Clinical Outcomes, and Adverse Effects in Atorvastatin Trials // Am. Journal of Cardiol. — 2015. — Vol. 115. — P. 447–453.
24. Rabar S., Harker M., O’Flynn N., Wierzbicki A.S.; Guideline Development Group. Lipid modification and cardiovascular risk assessment for the primary and secondary prevention of cardiovascular disease: summary of updated NICE guidance // BMJ. — 2014. — Vol. 17. — 349.
25. Sarnak M.J., Bloom R., Muntner P., Rahman M., Saland J.M., Wilson P.W., Fried L. KDOQI US Commentary on the 2013 KDIGO Clinical Practice Guideline for Lipid Management in CKD // Am. J. Kidney Dis. — 2015. — Vol. 65. — P. 354–366.
26. Sever P.S., Poulter N.R., Dahlöf B., Wedel H., Collins R., Beevers G., Caulfield M., Kjeldsen S.E., Kristinsson A., McInnes G.T., Mehlsen J., Nieminen M., O’Brien E., Ostergren J. Reduction in cardiovascular events with atorvastatin in 2,532 patients with type 2 diabetes: Anglo–Scandinavian Cardiac Outcomes Trial-lipid-lowering arm (ASCOT-LLA) // Diabetes Care. — 2005. — Vol. 28. — P. 1151–1157.
27. Sim J.S., Dick J.B., Struthers A.D. Statin therapy increases vascular sensitivity to angiotensin II in hypercholesterolaemic patients // J. Renin. Angiotensin. Aldosterone Syst. — 2004. — Vol. 5. — P. 109–113.
28. Spösito A.C., Mansur A.P., Coelho O.R., Nicolau J.C., Ramires J.A. Additional reduction in blood pressure after cholesterol-lowering treatment by statins (lovastatin or pravastatin) in hypercholesterolemic patients using angiotensin-converting enzyme inhibitors (enalapril or lisinopril) // Am. J. Cardiol. — 1999. — Vol. 15, 83. — P. 1497–1499, A8.
29. Stone N.J., Robinson J.G., Lichtenstein A.H., Bairey Merz C.N., Blum C.B., Eckel R.H. et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines // J. Am. Coll Cardiol. — 2014. — Vol. 1. — P. 2889–2934.
30. Task Force Members, Montalescot G., Sechtem U., Achenbach S., Andreotti F., Arden C., Budaj A., Bugiardini R., Crea F., Cuisset T., Di Mario C., Ferreira J.R., Gersh B.J., Gitt A.K., Hulot J.S., Marx N., Opie L.H., Pfisterer M., Prescott E., Ruschitzka F., Sabaté M., Senior R., Taggart D.P., van der Wall E.E., Vrints C.J.; ESC Committee for Practice Guidelines, Zamorano J.L., Achenbach S., Baumgartner H., Bax J.J., Bueno H., Dean V., Deaton C., Erol C., Fagard R., Ferrari R., Hasdai D., Hoes A.W., Kirchhof P., Knuuti J., Kolh P., Lancellotti P., Linhart A., Nihoyannopoulos P., Piepoli M.F., Ponikowski P., Sirnes P.A., Tamargo J.L., Tendera M., Torbicki A., Wijns W., Windecker S.; Document Reviewers, Knuuti J., Valgimigli M., Bueno H., Claeys M.J., Donner-Banzhoff N., Erol C., Frank H., Funck-Brentano C., Gaemperli O., Gonzalez-Juanatey J.R., Hamilos M., Hasdai D., Husted S., James S.K., Kervinen K., Kolh P., Kristensen S.D., Lancellotti P., Maggioni A.P., Piepoli M.F., Pries A.R., Romeo F., Rydén L., Simoons M.L., Sirnes P.A., Steg P.G., Timmis A., Wijns W., Windecker S., Yildirir A., Zamorano J.L. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology // Eur. Heart J. — 2013. — Vol. 34. — P. 2949–3003.
31. Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC); European Association for the Study of Diabetes (EASD), Rydйn L., Grant P.J., Anker S.D., Berne C., Cosentino F., Danchin N., Deaton C., Escaned J., Hammes H.P., Huikuri H., Marre M., Marx N., Mellbin L., Ostergren J., Patrono C., Seferovic P., Uva M.S., Taskinen M.R., Tendera M., Tuomilehto J., Valensi P., Zamorano J.L. ESC guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD — summary // Diab. Vasc. Dis. Res. — 2014. — Vol. 11. — P. 133–173.
32. Taylor F., Ward K., Moore T.H., Burke M., Davey Smith G., Casas J.P., Ebrahim S. Statins for the primary prevention of cardiovascular disease // Cochrane Database Syst. Rev. — 2013. — 1. — CD004816.
33. Tesfamariam B., Frohlich B.H., Gregg R.E. Differential effects of pravastatin, simvastatin, and atorvastatin on Ca2+ release and vascular reactivity // J. Cardiovasc. Pharmacol. — 1999. — Vol. 34. — P. 95–101.
34. Ufnal M., Drapala A., Sikora M., Szczepanska-Sadowska E. Oral simvastatin reduces the hypertensive response to air-jet stress // Clin. Exp. Pharmacol. Physiol. — 2012. — Vol. 39. — P. 350–356.
35. Wanner C., Tonelli M.; Kidney Disease: Improving Global Outcomes Lipid Guideline Development Work Group Members. KDIGO Clinical Practice Guideline for Lipid Management in CKD: summary of recommendation statements and clinical approach to the patient // Kidney Int. — 2014. — Vol. 85. — P. 1303–1309.
36. Zelvyte I., Dominaitiene R., Crisby M., Janciauskiene S. Modulation of inflammatory mediators and PPARgamma and NFkappaB expression by pravastatin in response to lipoproteins in human monocytes in vitro // Pharmacol. Res. — 2002. — Vol. 45. — P. 147–154.
37. Williams B., Lacy P.S., Cruickshank J.K., Collier D., Hughes A.D., Stanton A., Thom S., Thurston H.; CAFE and ASCOT Investigators. Impact of statin therapy on central aortic pressures and hemodynamics: principal results of the Conduit Artery Function Evaluation-Lipid-Lowering Arm (CAFE–LLA) Study // Circulation. — 2009. — Vol. 6. — P. 53–61.
38. Wang P., Liu Y., Wang Z., Wang Z., Zhao N., Ye H., Ren L. Effects of rosuvastatin on arterial stiffness in hyperlipidemia patients // Zhonghua Yi Xue Za Zhi. — 2014. — Vol. 19. — P. 2452–2454.
39. Wang Z.G., Chen B.W., Li N.Q., Cheng Y.M., Dang A.M. Relationships between use of statins and arterial stiffness in normotensive and hypertensive patients with coronary artery disease // Chin. Med. J. (Engl). — 2013. — Vol. 126. — P. 3087–3092.

/24/24.jpg)
/26/26.jpg)
/27/27.jpg)