Журнал «» 1 (39) 2015
Вернуться к номеру
Метаболічні та гемодинамічні особливості артеріальної гіпертензії у підлітків залежно від маси тіла
Авторы: Коренєв М.М., Богмат Л.Ф., Ніконова В.В., Носова О.М., Бессонова І.М. — ДУ «Інститут охорони здоров’я дітей та підлітків НАМН України», м. Харків
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Останніми роками особливу увагу зосереджено на проблемах, що пов’язані з розвитком метаболічних порушень, ролі провідних факторів ризику несприятливого прогнозу перебігу артеріальної гіпертензії (АГ), але таких досліджень серед дітей і підлітків недостатньо. Проведено комплексне обстеження 142 юнаків з АГ з уперше встановленим діагнозом у віці 13–18 років. У контрольну групу включений 21 практично здоровий підліток з нормальними артеріальним тиском (АТ) та масою тіла. Фізичний розвиток оцінювався з урахуванням антропометричних параметрів та індексу маси тіла. Виділено три підгрупи підлітків з АГ з огляду на індекс маси тіла. Проведено добове моніторування артеріального тиску, ехокардіографію, вивчалися параметри вуглеводного та ліпідного обміну та рівень сечової кислоти. Статистична обробка матеріалу проведена на IBM PC/Pentium 4 з використанням пакета прикладних програм SPSS 17.0.
Показники добового профілю АТ дещо відрізнялись за типами, але лише в підлітків з АГ й ожирінням реєструвалися всі відомі патологічні типи добового профілю АТ. При оцінці індексу часу гіпертензії залежно від маси тіла виявлено, що в пацієнтів із групи з АГ з нормальною масою тіла як удень, так і вночі реєструвався лабільний характер систолічної та діастолічної гіпертензії. У юнаків з АГ та надлишковою масою тіла (НМТ) у денний час показники часу гіпертензії знаходились у межах норми, а вночі відбувалось підвищення до лабільних значень, така сама тенденція була характерна і для підлітків з АГ та ожирінням.
Аналіз морфофункціональних характеристик серця в підлітків з АГ та надлишковою масою тіла встановив достовірне потовщення міокарда лівого шлуночка (ЛШ), як задньої стінки (р < 0,01), так і міжшлуночкової перегородки (р < 0,05), істотне збільшення діаметра аорти (р < 0,05). Порожнини ЛШ, правого шлуночка і лівого передсердя також були розширеними порівняно з аналогічними розмірами юнаків контрольної групи та підлітків з АГ та нормальною масою тіла. У юнаків з АГ та ожирінням були ще більші розміри лівого та правого шлуночків (р < 0,001 та р < 0,01), кореня аорти (р < 0,01), а також найбільший показник індексу маси міокарда лівого шлуночка (р < 0,01). При вивченні показників загальної гемодинаміки у юнаків з АГ залежно від маси тіла виявлено тенденції до формування гіпокінетичного варіанта гемодинаміки за рахунок зниження хвилинного об’єму та підвищення загального судинного опору як у пацієнтів з АГ та НМТ, так і в підлітків з АГ й ожирінням.
При вивченні ліпідного спектра крові в юнаків з АГ встановлено, що рівень загального холестерину, тригліцеридів та коефіцієнт атерогенності в підлітків з АГ і НМТ, а також ожирінням суттєво зростав порівняно зі значеннями групи контролю та юнаків з АГ та нормальною масою тіла (р < 0,05; р < 0,01). А показники холестерину ліпопротеїдів високої щільності були істотно знижені. У цих же групах підлітків встановлено підвищення рівня імунореактивного інсуліну, до того ж його рівень збільшувався зі зростанням маси тіла. Інсулінорезистетнність різного ступеня виявлялась значно частіше у підлітків із НМТ (67,3 %) та ожирінням (77,5 %) і значно рідше — у підлітків з АГ та нормальною масою тіла (40,0 %) (р < 0,01). У пацієнтів з АГ з нормальною та надлишковою масою тіла середні значення урикемії достовірно не відрізнялись (р > 0,1), але в юнаків з АГ й ожирінням показники були достовірно вищі порівняно з такими в осіб з АГ й надлишковою масою тіла (р < 0,05).
Вважають, що порушення метаболізму пуринів, вуглеводів та ліпідного спектра крові як в осіб з АГ, так і з АГ та ожирінням необхідно розглядати з позицій формування дисфункції ендотелію. Процент приросту діаметра артерії після реактивної гіперемії в підлітків з АГ і нормальною масою тіла досяг 14,2 %, що відповідає нормальним значенням, але в 40,9 % підлітків цей показник був нижчим за 10 %. При проведенні проби з нітрогліцерином встановлено, що діаметр плечової артерії через 5 хвилин після його прийому в групі з АГ й нормальною масою тіла становив 0,52 см, що відповідало 23,8 % приросту, у пацієнтів з АГ і НМТ — 0,50 см, тобто 11,1 % приросту від вихідних значень, а у юнаків з АГ і ожирінням — 0,52 см, що становило лише 15,5 % приросту. Крім того, через 10 хвилин після проби з нітрогліцерином у пацієнтів з АГ і НМТ продовжувався приріст діаметра плечової артерії (+4,05 %) на відміну від юнаків з АГ і нормальною масою тіла та з АГ і ожирінням, у яких відбувалось зменшення діаметра плечової артерії (на –5,81 та –3,83 % відповідно), що є нормальною реакцією на виведення нітрогліцерину з кровообігу.
Таким чином, у підлітків з АГ при підвищенні індексу маси тіла збільшується частота та глибина ендотеліальної дисфункції (у пробах ендотелійзалежної та ендотелійнезалежної вазодилатації), що тісно корелює з порушеннями в ліпідному спектрі крові, вуглеводному та пуриновому обміні. Виділено компоненти, що є найбільш значущими у формуванні ендотеліальної дисфункції у підлітків з АГ та надмірною масою тіла й ожирінням, а саме порушення метаболізму ліпідів, пуринів та інсулінорезистентність.
В последние годы особое внимание сосредоточено на проблемах, связанных с развитием метаболических нарушений, роли ведущих факторов риска неблагоприятного прогноза течения артериальной гипертензии (АГ), но таких исследований среди детей и подростков недостаточно. Проведено комплексное обследование 142 юношей с АГ с впервые установленным диагнозом в возрасте 13–18 лет. В контрольную группу включен 21 практически здоровый подросток с нормальными артериальным давлением (АД) и массой тела. Физическое развитие оценивалось с учетом антропометрических параметров и индекса массы тела. Выделены три подгруппы подростков с АГ с учетом индекса массы тела. Проведены суточное мониторирование артериального давления, эхокардиография, изучались параметры углеводного и липидного обмена и уровень мочевой кислоты. Статистическая обработка материала проведена на IBM PC/Pentium 4 с использованием пакета прикладных программ SPSS 17.0.
Показатели суточного профиля АД несколько отличались по типам, но только у подростков с АГ и ожирением регистрировались все известные патологические типы суточного профиля АД. При оценке индекса времени гипертензии в зависимости от массы тела обнаружено, что у пациентов из группы с АГ и нормальной массой тела как днем, так и ночью регистрировался лабильный характер систолической и диастолической гипертензии. У юношей с АГ и избыточной массой тела (ИМТ) в дневное время показатели времени гипертензии находились в пределах нормы, а ночью происходило повышение до лабильных значений, такая же тенденция была характерна и для подростков с АГ и ожирением.
Анализ морфофункциональных характеристик сердца у подростков с АГ и избыточной массой тела установил достоверное утолщение миокарда левого желудочка (ЛЖ), как задней стенки (р < 0,01), так и межжелудочковой перегородки (р < 0,05), существенное увеличение диаметра корня аорты (р < 0,05). Полости ЛЖ, правого желудочка и левого предсердия также были расширенными по сравнению с аналогичными размерами юношей контрольной группы и подростков с АГ и нормальной массой тела. У юношей с АГ и ожирением были еще большие размеры левого и правого желудочков (р < 0,001 и р < 0,01), корня аорты (р < 0,01), а также самый большой показатель индекса массы миокарда левого желудочка (р < 0,01). При изучении показателей общей гемодинамики у юношей с АГ в зависимости от массы тела выявлены тенденции к формированию гипокинетического варианта гемодинамики за счет снижения минутного объема и повышения общего сосудистого сопротивления как у пациентов с АГ и ИМТ, так и у подростков с АГ и ожирением.
При изучении липидного спектра крови у юношей с АГ установлено, что уровень общего холестерина, триглицеридов и коэффициент атерогенности у подростков с АГ и ИМТ, а также ожирением существенно возрастал по сравнению со значениями в группе контроля и юношей с АГ и нормальной массой тела (р < 0,05; р < 0,01). А показатели холестерина липопротеидов высокой плотности были существенно снижены. В этих же группах подростков установлено повышение уровня иммунореактивности инсулина, к тому же его уровень увеличивался с ростом массы тела. Инсулинорезистентность разной степени выявлялась значительно чаще у подростков с ИМТ (67,3 %) и ожирением (77,5 %) и значительно реже — у подростков с АГ и нормальной массой тела (40,0 %) (р < 0,01). У пациентов с АГ с нормальной и избыточной массой тела средние значения урикемии достоверно не отличались (р > 0,1), но у юношей с АГ и ожирением показатели были достоверно выше по сравнению с таковыми у лиц с АГ и избыточной массой тела (р < 0,05).
Считают, что нарушение метаболизма пуринов, углеводов и липидного спектра крови как у лиц с АГ, так и с АГ и ожирением необходимо рассматривать с позиций формирования дисфункции эндотелия. Процент прироста диаметра артерии после реактивной гиперемии у подростков с АГ и нормальной массой тела достиг 14,2 %, что соответствует нормальным значениям, но у 40,9 % подростков этот показатель был ниже 10 %. При проведении пробы с нитроглицерином установлено, что диаметр плечевой артерии через 5 минут после его приема в группе с АГ и нормальной массой тела составил 0,52 см, что соответствовало 23,8 % прироста, у пациентов с АГ и НМТ — 0,50 см, то есть 11,1 % прироста от исходных значений, а у юношей с АГ и ожирением — 0,52 см, что составило лишь 15,5 % прироста. Кроме того, через 10 минут после пробы с нитроглицерином у пациентов с АГ и НМТ продолжался прирост диаметра плечевой артерии (+4,05 %) в отличие от юношей с АГ и нормальной массой тела и с АГ и ожирением, у которых происходило уменьшение диаметра плечевой артерии (на –5,81 и –3,83 % соответственно), что является нормальной реакцией на выведение нитроглицерина из кровообращения.
Таким образом, у подростков с АГ при повышении индекса массы тела увеличивается частота и глубина эндотелиальной дисфункции (в пробах эндотелийзависимой и эндотелийнезависимой вазодилатации), что тесно коррелирует с нарушениями в липидном спектре крови, углеводном и пуриновом обмене. Выделены компоненты, которые являются наиболее значимыми в формировании эндотелиальной дисфункции у подростков с АГ и избыточной массой тела и ожирением, а именно нарушение метаболизма липидов, пуринов и инсулинорезистентность.
In recent years, the special attention has been concentrated on problems related to metabolic violations, the role of leading risk factors of prognosis for arterial hypertension (AH) course, but there is a lack of such researches among children and adolescents. A comprehensive survey of 142 young males with AH newly diagnosed at the age of 13–18 years has been carried out. Control group included 21 apparently healthy adolescents with normal blood pressure (BP) and body weight. Physical development was assessed based on anthropometric parameters and body mass index (BMI). Three subgroups of adolescents with AH were pointed out taking into account BMI. 24-hour blood pressure monitoring, echocardiography were carried out, parameters of carbohydrate and lipid metabolism and uric acid levels were studied. Statistical analysis of the material was held on the IBM PC/Pentium 4 using application package SPSS 17.0.
Indicators of diurnal BP profile differed a little by type, but only adolescents with AH and obesity reported all known pathological types of circadian BP profile. When assessing hypertension time index depending on body weight it was found that patients with AH and normal body weight both in the day time and in the night time recorded labile nature of systolic and diastolic hypertension. In young males with AH and overweight (OW) rates of hypertension during the day were within normal limits, and at night there was an increase to labile values, the same trend was characteristic of adolescents with AH and obesity.
Analysis of the morphological characteristics of the heart in adolescents with AH and overweight established a reliable thickening of left ventricular myocardium, both in posterior wall (p < 0.01) and interventricular septum (p < 0.05), a significant increase in aorta diameter (p < 0.05). Left ventricular, right ventricular, left atrial cavities were also dilated compared with the same in controls and adolescents with AH and normal body weight. In young males with AH and obesity, left and right ventricles (p < 0.001 and p < 0.01), aortic root (p < 0.01) were even larger, as well as left ventricular mass index was biggest (p < 0.01). When studying general hemodynamic performance in young males with AH depending on body weight, it was noted a trend to formation of hypokinetic hemodynamics due to reduced cardiac output and increased general vascular resistance both in patients with AH and OW and in adolescents with AH and obesity.
During the study of blood lipids in young males with AH, it was found that the level of total cholesterol, triglycerides and atherogenic index in adolescents with AH and OW, as well as with obesity significantly increased compared to the values in controls and young males with AH and normal body weight (p < 0.05; p < 0.01). And parameters of high density lipoprotein cholesterol were significantly reduced. In the same groups of adolescents we have detected an increase in immunoreactive insulin, besides, its level raised with increasing body weight. Insulin resistance of varying degrees has been detected significantly more often in adolescents who had OW (67.3 %) and obesity (77.5 %) and much less often in adolescents with AH and normal body weight (40.0 %) (p < 0.01). In patients with AH and normal body weight and overweight, mean values of uricemia did not differ significantly (p > 0.1), but in young males with AH and obesity significantly exceeded the rates in patients with AH and overweight (p < 0.05).
It is believed that disorders of purine, carbohydrate metabolism and blood lipids both in patients with AH and AH with obesity should be considered from the standpoint of endothelial dysfunction. Percentage of artery diameter increase after reactive hyperemia in adolescents with AH and normal body weight reached 14.2 % that corresponded to normal values, but in 40.9 % of adolescents this figure was below 10 %. When conducting tests with nitroglycerin, it was found that brachial artery diameter 5 minutes after its measurement in the group with AH and normal weight was 0.52 cm, corresponding to 23.8% growth, in patients with AH and OW — 0.50 cm, respectively 11.1% increase from baseline values, and in young males with AH and obesity — 0.52 cm, which was only 15.5% increase. Furthermore, 10 minutes after the test with nitroglycerin, in patients with AH and OW growth of the brachial artery diameter (+4.05 %) continued, in contrast to boys with AH and normal body weight and with AH and obesity, in whom reduction in brachial artery diameter (–5.81 and –3.83 %, respectively) was noted, which is a normal reaction to nitroglycerin elimination from bloodflow.
Thus, in adolescents with AH at raised body mass index, the prevalence and depth of endothelial dysfunction (in tests of endothelium-dependent and endothelium-independent vasodilation) increased that is closely correlated with the disturbances in blood lipids, carbohydrate and purine metabolism. There were pointed out the components which are most important for endothelial dysfunction in adolescents with AH and overweight and obesity, namely disorders in lipid metabolism, purine and insulin resistance.
підлітки, артеріальна гіпертензія, вуглеводний обмін, ліпідний спектр, гіперурикемія.
подростки, артериальная гипертензия, углеводный обмен, липидный спектр, гиперурикемия.
adolescents, arterial hypertension, carbohydrate metabolism, lipid profile, hyperuricemia.
Статья опубликована на с. 36-44
Формування і прогресування артеріальної гіпертензії (АГ) обумовлене складною взаємодією нейрогуморальних, гемодинамічних, метаболічних і генетичних факторів [1–3]. Останніми роками особливу увагу зосереджено на проблемах, що пов’язані з розвитком метаболічних порушень у цієї категорії хворих, ролі провідних факторів ризику несприятливого прогнозу перебігу АГ, але таких досліджень серед дітей і підлітків проводиться недостатньо [4–6].
Доведено, що тяжкість клінічних проявів і прогноз хворих на АГ визначаються не лише ступенем підвищення артеріального тиску (АТ), але й ураженням органів-мішеней, у першу чергу наявністю гіпертрофії міокарда лівого шлуночка серця (ГЛШ) [7–9]. Встановлено, що у хворих на АГ з ознаками метаболічного синдрому формуються більш виражені структурні і функціональні зміни серця і нирок, що пов’язують як із більш високими рівнями артеріального тиску, так і з впливом різноманітних метаболічних порушень [10–12]. Тому важливо на найбільш ранніх етапах розвитку патології виділити підлітків з АГ, яка тісно асоціюється з високим ризиком серцево-судинних ускладнень, для подальшої ефективної профілактики. З цією метою необхідно встановити особливості метаболічних порушень та їх зв’язок із морфофункціональними параметрами серця в підлітків з АГ залежно від індексу маси тіла (ІМТ).
Обсяг і методи дослідження
Проведено комплексне обстеження 142 юнаків з АГ з уперше встановленим діагнозом у віці 13–18 років. До контрольної групи включений 21 практично здоровий підліток із нормальними артеріальним тиском та масою тіла.
Діагноз АГ, її ступінь і стадію встановлювали індивідуально кожному пацієнтові згідно з класифікацією первинної АГ у дітей (2006), що прийнята на III Конгресі педіатрів України, та відповідно до рекомендацій Української асоціації кардіологів із профілактики і лікування АГ (2013) [28]. Діти з вторинним характером АГ (симптоматична АГ) у дослідження не включались.
Фізичний розвиток оцінювався з урахуванням антропометричних параметрів (зріст, маса тіла, окружність талії та стегон — ОТ та ОС) та за значеннями індексу маси тіла (кг/м2). ІМТ оцінювали за перцентильними номограмами з урахуванням віку і статі. Нормальним вважався ІМТ, що знаходився між 15-м і 85-м перцентилями. Значення ІМТ між 85-м і 97-м перцентилями розцінювалися як надлишок маси тіла (НМТ), а вище 97-го перцентиля — як ожиріння. Критерієм абдомінального ожиріння вважалася ОТ ≥ 94 см для юнаків старше 16 років і > 90-го перцентиля — для дітей до 15 років (IDF, 2007).
Виділено три підгрупи підлітків з АГ з урахуванням ІМТ. У першу увійшли 48 підлітків з АГ та нормальною масою тіла, у другу — 35 підлітків із АГ та надлишковою масою тіла, у третю — 59 осіб з АГ та ожирінням
Всім підліткам проведено добове моніторування артеріального тиску (ДМАТ). ДМАТ проводили на апараті АВРМ-04 (Угорщина), при цьому визначали середні значення в денний і нічний час систолічного (САТ), діастолічного (ДАТ), пульсового АТ та індекс часу гіпертензії.
Функціональний стан серцево-судинної системи вивчався за допомогою ультразвукового дослідження серця в М- і В-режимах із використанням датчика 3,5 мГц на апараті Sonoline-SL1 фірми Siеmens за стандартною методикою, що рекомендована Асоціацією спеціалістів з ехокардіографії.
Аналізувалися: діаметр кореня аорти (ДА), розміри лівого передсердя (ЛП), товщина міокарда задньої стінки лівого шлуночка (ТМзсЛШ), товщина міжшлуночкової перегородки (ТМШП), кінцевий діастолічний і кінцевий систолічний розміри ЛШ (КДР, КСР), кінцевий діастолічний і кінцевий систолічний об’єми ЛШ (КДО, КСО), фракція викиду (ФВ) ЛШ.
Розраховувалися також маса міокарда ЛШ (ММЛШ) за формулою Troy (1977): ММЛШ = 0,8 х{1,04 • ([КДР + ТМ + ТМШП]3 — КДР3)} + 0,6 та індекс маси міокарда ЛШ (ІММЛШ) за формулою: ІММЛШ = ММЛШ / ПТ (г/м2), де ПТ — площа поверхні тіла. Відносну товщину задньої стінки лівого шлуночка (ВТСЛШ) визначали за формулою: ВТСЛШ = ТМзсЛШ(д) / КДР • 2.
Тип загальної гемодинаміки визначався за такими показниками: ударний об’єм (УО), хвилинний об’єм (ХО) та загальний периферичний судинний опір (ЗПСО).
Для оцінки стану вуглеводного обміну визначали рівень глікемії натщесерце у венозній крові, показники перорального глюкозотолерантного тесту, рівень базального імунореактивного інсуліну (ІРІ) та інсулінорезистентність (ІР) натще за індексом HOMA-IR. ІР оцінювали за непрямими показниками: рівнем базальної інсулінемії та значеннями індексу HOMA-IR, що обчислювали за формулою D.R. Matthews та співавт.:
ІР = рівень глікемії натщесерце (ммоль/л) х рівень інсуліну натщесерце (мкОД/мл) / 22,5.
Критерієм високої ІР вважали рівень індексу HOMA-IR понад 3,6; середнім (граничним) ступенем ІР — рівень HOMA-IR від 2,77 до 3,59; збереження чутливості до інсуліну (відсутність ІР) діагностували при рівні HOMA-IR менше 2,77.
Ліпідний спектр крові визначали за рівнем загального холестерину (ЗХС), тригліцеридів (ТГ) і холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) фотометричним методом на фотометрі Cormay Multi (Cormay dіagnostica, Польща). Холестерин ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ) розраховували у ммоль/л за формулою: ХС ЛПДНЩ = ТГ / 2,2.
Холестерин ліпопротеїнів низької щільності (ХС ЛПНЩ) визначали за формулою: ХС ЛПНЩ = ЗХС – (ХС ЛПДНЩ + ХС ЛПВЩ), а коефіцієнт атерогенності (КА) — за формулою: КА = (ЗХC – ХC ЛПВЩ) / ХC ЛПВЩ.
Визначення рівня сечової кислоти в сироватці крові проводили ензиматичним, колориметричним методом з іриказою та пероксидазою з використанням діагностичних наборів Liquick Cor-UA (PZ Cormay S.A., Польща).
Усі дослідження проводили до початку лікування через 2–3 дні перебування хворого у стаціонарі в умовах вільного режиму.
Статистична обробка матеріалу проведена на IBM PC/Pentium 4 з використанням пакета прикладних програм SPSS 17.0.
Результати та їх обговорення
Оцінюючи клінічну симптоматику підлітків з АГ у виділених групах, необхідно відзначити, що більшість із них скарги не пред’являли, а підвищення АТ було встановлено при профілактичних оглядах. Однак при поглибленому опитуванні майже половина підлітків з АГ і нормальною масою тіла (47,8 %) скаржились на головні болі з вираженою метеочутливістю, болі в ділянці серця на тлі значних психоемоційних та фізичних навантажень, погане самопочуття. У групі підлітків з АГ та надлишковою масою тіла і в групі з АГ та ожирінням таких хворих було значно більше (64,3 та 72,8 % відповідно; р < 0,01). Як правило, скарги виникали та посилювались у періоди підвищення артеріального тиску.
Відомо, що добовий профіль артеріального тиску у підлітків є найбільш об’єктивним його показником. Середні значення АТ протягом доби в підлітків досліджуваних груп були ідентичними, показники ж добового профілю АТ дещо відрізнялись за типами, але лише у підлітків з АГ та ожирінням реєструвалися усі відомі патологічні типи добового профілю АТ (табл. 1).
При оцінці індексу часу гіпертензії залежно від маси тіла виявлено, що в пацієнтів із групи з АГ з нормальною масою тіла як удень, так і вночі реєструвався лабільний характер систолічної та діастолічної гіпертензії. У юнаків з АГ та надлишковою масою тіла в денний час показники часу гіпертензії знаходились у межах норми, а вночі відбувалось підвищення до лабільних значень, така ж тенденція була характерна і для підлітків з АГ та ожирінням (табл. 2).
Отже, у підлітків з АГ і нормальною масою тіла щільність гіпертензії протягом доби була найвищою, але всі патологічні типи добових профілів АТ реєструвалися лише в групі з ожирінням.
/39/39.jpg)
Аналіз морфофункціональних характеристик серця в підлітків з АГ виявив суттєві відмінності як від показників контрольної групи, так і у виділених підгрупах.
Як зазначається в табл. 3, у пацієнтів з АГ та надлишковою масою тіла зареєстровано достовірне потовщення міокарда лівого шлуночка як задньої стінки (ТМзс) (р < 0,01), так і міжшлуночкової перегородки (ТМШП) (р < 0,05), істотне збільшення діаметра аорти (р < 0,05). Порожнини ЛШ, ПШ і ЛП також були розширеними порівняно з аналогічними розмірами юнаків контрольної групи та підлітків з АГ та нормальною масою тіла (табл. 3).
В юнаків з АГ та ожирінням морфофункціональні параметри серця виявились аналогічними до хворих на АГ з надлишковою масою тіла, проте звертали на себе увагу ще більші розміри лівого та правого шлуночків (р < 0,001 та р < 0,01 відповідно), кореня аорти (р < 0,01), а також найбільший показник ІММЛШ (р < 0,01), тобто показник, що істотно впливає на прогноз у хворих на АГ.
Встановлені зміни морфофункціональних параметрів серця в підлітків з АГ як із НМТ, так і з ожирінням свідчать про його бівентрикулярне ремоделювання. Розширення порожнини лівого передсердя можна трактувати як ознаку формування в цих юнаків діастолічної дисфункції лівого шлуночка серця.
При індивідуальній оцінці параметрів серця виявлено, що концентрична гіпертрофія лівого шлуночка зареєстрована лише у 3,3 % підлітків з АГ і нормальною масою тіла, у 17,4 % юнаків з АГ та НМТ, у 14,9 % з АГ та ожирінням ексцентрична гіпертрофія ЛШ виявлена у 13,1 % осіб з АГ з НМТ та у 23,4 % — з АГ з ожирінням (рис. 1).
Найбільш часто реєструвалось розширення порожнини ЛШ, яке виявлено у 28,1 % хворих з АГ і нормальною масою тіла, у 60,9 % — з АГ і НМТ та у 46,8 % юнаків з АГ й ожирінням. Подібне розширення порожнини ЛШ у підлітків з АГ супроводжувалось збільшенням ММЛШ та ІММЛШ. Ці дані свідчать про формування так званого концентричного типу ремоделювання міокарда ЛШ у цієї категорії хворих (рис. 1).
При вивченні параметрів загальної гемодинаміки в юнаків з АГ по групі в цілому показники УО статистично не відрізнялись від контрольних значень, а середні показники хвилинного об’єму серця достовірно перевищували значення здорових однолітків (р < 0,01), що відбувалось за рахунок суттєвого збільшення ЧСС (р < 0,05), але середній показник загального периферичного судинного опору достовірно не змінювався (табл. 4).
При вивченні показників загальної гемодинаміки у юнаків з АГ залежно від маси тіла виявлено тенденції до формування гіпокінетичного варіанта гемодинаміки за рахунок зниження ХО та підвищення ЗПСО як у пацієнтів з АГ та НМТ, так і в підлітків з АГ і ожирінням (табл. 4).
При цьому насосна функція серця у хворих зазначених груп достовірно знижувалась, про що свідчать не лише достовірно менші середні показники ФВ у пацієнтів з АГ та НМТ і з ожирінням, а й зареєстрований обернений кореляційний зв’язок між масою тіла хворих та ФВ (r = –0,317; p < 0,001).
Таким чином, у підлітків з АГ і НМТ, а особливо з ожирінням, відбувається бівентрикулярна перебудова серця як за рахунок ексцентричної гіпертрофії міокарда лівого шлуночка, але найбільше — за рахунок концентричного ремоделювання. В обох цих групах підлітків з АГ (із НМТ та ожирінням) реєструються також ознаки діастолічної і систолічної дисфункції міокарда ЛШ.
Вивчення ліпідного спектра крові у юнаків з АГ залежно від маси тіла виявило певні відмінності, що віддзеркалюють особливості формування метаболічних порушень (табл. 5). Так, рівень ЗХС у підлітків з АГ і НМТ, а також ожирінням суттєво зростав порівняно зі значеннями групи контролю та юнаків з АГ та нормальною масою тіла (р < 0,05; р < 0,01).
Паралельно з цим показники ХС ЛПВЩ були істотно знижені не тільки у підлітків з АГ та ожирінням, але і в групі з НМТ, наслідком чого було значне підвищення у них КА. Крім того, у підлітків з АГ та ожирінням встановлено підвищення рівня ТГ та їх транспортних форм — ХС ЛПДНЩ (табл. 5).
Таким чином, зміни в ліпідному та ліпопротеїдному спектрах крові атерогенної спрямованості виникають у підлітків з АГ вже за наявності надлишкової маси тіла і досягають істотних значень при ожирінні.
У групі підлітків з АГ та ожирінням суттєво переважала і частота порушень окремих показників ліпідного спектра крові (табл. 6).
Так, у пацієнтів з ожирінням в 16,85 % випадків реєструвався підвищений рівень ТГ та ХС ЛПДНЩ, а у 20,2 % — підвищення рівня ХС ЛПНЩ, що значно перевищувало їх частоту в підлітків з АГ і нормальною масою тіла (р < 0,01; р < 0,01). У третини обстежених пацієнтів з ожирінням (31,46 %) рівень ХС ЛПВЩ був зниженим, що також значно перевищувало частоту у пацієнтів з АГ та нормальною масою тіла (р < 0,01).
Таким чином, у підлітків з АГ досліджуваних груп виявлено зміни в ліпідному та ліпопротеїдному спектрах крові, але найбільш значущими вони були у юнаків з АГ та ожирінням. В юнаків з АГ встановлено наявність різних за складом дисліпопротеїдемій, їх частота збільшувалась у підлітків з АГ зі зростанням маси тіла (від 17,0 % — у юнаків із нормальною масою тіла до 59,0 % — у підлітків із НМТ та до 77,0 % — у пацієнтів з ожирінням; р < 0,05; р < 0,01).
Аналіз частоти й характеру порушень вуглеводного обміну в підлітків з АГ з урахуванням наявності чи відсутності НМТ та ожиріння не виявив підвищення рівня глікемії натще в капілярній крові як у підлітків з АГ і НМТ, так і з АГ та ожирінням. Разом із тим у цих групах підлітків встановлено підвищення рівня ІРІ, до того ж його рівень збільшувався із зростанням маси тіла. Саме підвищення рівня ІРІ у підлітків з ожирінням і НМТ свідчить про розвиток ІР і підтверджується істотним збільшенням індексу HOMA-IR (табл. 7).
ІР різного ступеня виявлялась значно частіше у підлітків, які мали НМТ (67,3 %) та ожиріння (77,5 %), і значно рідше у підлітків з АГ та нормальною масою тіла (40,0 %) (р < 0,01) (табл. 8).
Таким чином, у підлітків з АГ при підвищенні індексу маси тіла збільшується глибина і частота порушень вуглеводного обміну та формування ІР.
У підлітків з АГ визначено середні значення сечової кислоти сироватки крові, що коливалися в межах від 0,202 до 0,645 ммоль/л і становили в середньому по групі 0,376 ± 0,009 ммоль/л, достовірно перевищуючи контрольні показники, що знаходились на рівні 0,292 ± 0,009 ммоль/л (р < 0,001) і в діапазоні від 0,226 до 0,352 ммоль/л.
У пацієнтів з АГ з нормальною та надлишковою масою тіла середні значення урикемії достовірно не відрізнялись (0,365 ± 0,013 та 0,354 ± 0,014 ммоль/л; р > 0,1), але в юнаків з АГ і ожирінням досягали 0,392 ± 0,014 ммоль/л, достовірно перевищуючи показники осіб з АГ та надлишковою масою тіла (р < 0,05).
Частота гіперурикемії у підлітків з АГ становила 53,9 %, суттєво не відрізняючись залежно від маси тіла (відповідно у 50,0 % з нормальною, у 50,0 % з надлишковою масою і у 57,6 % з ожирінням; р > 0,1).
Вважають, що порушення метаболізму пуринів, вуглеводів та ліпідного спектра крові як в осіб з АГ, так і з АГ та ожирінням необхідно розглядати з позицій формування дисфункції ендотелію як за рахунок порушень вивільнення NO, проліферації ендотеліальних клітин, так і стимуляції продукції медіаторів запалення.
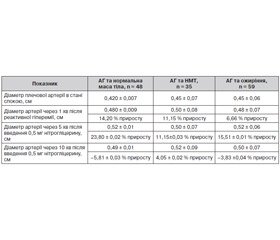
Аналіз вихідних показників діаметра плечової артерії в підлітків з АГ не виявив суттєвих відмінностей залежно від маси тіла (табл. 9).
Процент приросту діаметра артерії після реактивної гіперемії у підлітків з АГ і нормальною масою тіла досяг 14,2 %, що відповідає нормальним значенням, але у 40,9 % підлітків цей показник був нижчим за 10 %.
У пацієнтів з АГ і НМТ середній діаметр плечової артерії був 0,50 ± 0,08 см, процент його приросту в більшої частини також перевищував 10 % і в середньому становив 11,1 %, але в 48,6 % підлітків цієї групи не досягнуто адекватного приросту.
У групі юнаків з АГ та ожирінням діаметр плечової артерії в пробі з реактивною гіперемією по групі в цілому досяг 0,48 ± 0,03 см, але процент приросту в них становив лише 6,6 % і порушення ендотелійзалежної вазодилатації зареєстровано вже в 70,0 % осіб даної групи (табл. 9).
При проведенні проби з нітрогліцерином (стимульована ендотелійнезалежна вазодилатація) встановлено, що діаметр плечової артерії через 5 хвилин після прийому нітрогліцерину в підлітків з АГ і нормальною масою тіла становив 0,52 см, що відповідало 23,8 % приросту, у пацієнтів з АГ і НМТ — 0,50 см, відповідно 11,1 % приросту від вихідних значень, а в юнаків з АГ і ожирінням — 0,52 м, що становило лише 15,5 % приросту (табл. 9).
Отже, процент приросту діаметра артерії на ендотелійнезалежний стимул у підлітків з АГ і ожирінням та в осіб із АГ і НМТ був значно нижчим від нормальних значень. У 47,7 % підлітків з АГ та нормальною масою тіла відмічено зниження цього показника, а в групах пацієнтів із НМТ та ожирінням це відбувалося в 62,1 % випадків (р < 0,1). Крім того, через 10 хвилин після проби з нітрогліцерином у пацієнтів з АГ і НМТ продовжувався приріст діаметра плечової артерії (+4,05 %) на відміну від юнаків з АГ і нормальною масою тіла та з АГ і ожирінням, у яких відбувалось зменшення діаметра плечової артерії (на –5,81 та –3,83 % відповідно), що є нормальною реакцією на виведення нітрогліцерину з кровообігу (табл. 9).
Отже, найбільш виражені порушення ендотелійзалежної вазодилатації встановлено в підлітків з АГ й ожирінням, у той час як ендотелійнезалежна вазодилатація (стимульована нітрогліцерином) була недостатньою в групах з АГ як із надмірною масою тіла, так і з ожирінням.
Таким чином, у підлітків з АГ при підвищенні індексу маси тіла збільшується частота та глибина ендотеліальної дисфункції (у пробах ендотелійзалежної та ендотелійнезалежної вазодилатації), яка тісно корелює з порушеннями в ліпідному спектрі крові, вуглеводному та пуриновому обміні. Виділено компоненти, що є найбільш значущими у формуванні ендотеліальної дисфункції у підлітків з АГ та надмірною масою тіла й ожирінням, а саме порушення метаболізму ліпідів, пуринів і ІР.
1. Структура факторов риска поражения органов-мишеней и метаболических изменений у больных артериальной гипертензией в различных возрастных группах [Текст] / С.А. Бойцов [и др.] // Кардиология. — 2009. — № 4. — С. 19–24.
2. Радченко Г.Д. Гіпертрофія лівого шлуночка: визначення, методи оцінки, можливості регресування [Текст] / Г.Д. Радченко, Ю.М. Сіренко // Артериальная гипертензия. — 2010. — № 4 (12). — С. 82–90.
3. Особенности поражения органов–мишеней у больных артериальной гипертензией с наличием и в отсутствие метаболического синдрома [Текст] / Г.Х. Шарипова [и др.] // Тер. архив. — 2009. — № 6. — С. 67–73.
4. Метаболический синдром у детей и подростков. Консенсус Международной диабетической федерации [Текст] // Междунар. эндокрин. журн. — 2008. — № 2 (14). — С. 100–103.
5. Коваль С.Н. Современные представления о возможности прогнозирования течения артериальной гипертензии при метаболическом синдроме [Текст] / С.Н. Коваль, В.В. Божко, И.А. Снегурская // Артериальная гипертензия. — 2012. — №6(26). — С. 34–39.
6. Кайдашев И.П. Эволюция понятия «метаболический синдром» и его современное значение [Текст] / И.П. Кайдашев // Укр. мед. часопис. — 2012. — № 2 (88), III–IV. — С. 23–29.
7. Клінічні рекомендації з артеріальної гіпертензії Європейського товариства гіпертензії (ESH) та Європейського товариства кардіологів (ESH) [Текст] // Артеріальна гіпертензія. — 2013. — № 4 (30) — С. 160.
8. Европейское общество гипертензии и Европейское общество кардиологов. Рекомендации по лечению артериальной гипертензии. — Милан. — 2007. — 83 с.
9. Горбась І.М. Епідеміологічні та медико-соціальні аспекти артеріальної гіпертензії [Текст] / І.М. Горбась // Збірник доповідей наукового симпозіуму «Артеріальна гіпертензія у підлітків: проблеми та перспективи». — Харків, 2011. — С. 11–19.
10. Волкова Н.И. Артериальная гипертензия и метаболические нарушения [Текст] / Н.И. Волкова, И.С. Джериева // Клиническая медицина. — 2010. — № 2. — С. 4–8.
11. Болотова Н.В. Особенности формирования метаболического синдрома у детей и подростков [Текст] / Н.В. Болотова, С.В. Лазебникова, А.П. Аверьянов // Педиатрия. — 2007. — Т. 86, № 3. — С. 35–39.
12. Индивидуальное прогнозирование риска развития ишемической болезни сердца в рамках первичной профилактики. [Текст] / Л.Л. Берштейн [и др.] // Кардиология. — 2012. — № 8. — С. 65–74.

/38/38.jpg)
/39/39_2.jpg)
/40/40.jpg)
/41/41.jpg)
/42/42.jpg)