Международный эндокринологический журнал 7 (63) 2014
Вернуться к номеру
Современная лабораторная диагностика остеопороза
Авторы: Климова Ж.А., Зафт А.А. — ООО «Синэво Украина»; Зафт В.Б. — ГНУ «Научно-практический центр профилактической и клинической медицины» Государственного управления делами, г. Киев
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
В статье представлены некоторые аспекты проблемы остеопороза, а также современные методы лабораторной диагностики остеопороза, которые применяются в лаборатории ООО «Синэво Украина».
У статті представлені деякі аспекти проблеми остеопорозу, а також сучасні методи лабораторної діагностики остеопорозу, які застосовуються в лабораторії ТОВ «Сінево Україна».
The article presents some aspects of osteoporosis, as well as modern methods of laboratory diagnosis of osteoporosis, which are being used in the laboratory of «Synevo Ukraine» LLC.
остеопороз, лабораторная диагностика.
остеопороз, лабораторна діагностика.
osteoporosis, laboratory diagnosis.
Статья опубликована на с. 75-84
Остеопороз (ОП) — это метаболическое заболевание костей, которое характеризуется снижением костной массы и микроструктурной перестройкой костной ткани, в связи с чем снижается прочность кости и повышается риск переломов [1].
По мнению экспертов Всемирной организации здравоохранения (ВОЗ), остеопороз сегодня — одно из наиболее распространенных заболеваний, которое наряду с инфарктом миокарда, инсультом, раком и внезапной смертью занимает ведущее место в структуре заболеваемости и смертности населения.
По данным ВОЗ, остеопороз является второй по значимости после сердечно-сосудистых заболеваний проблемой здравоохранения. Во всем мире примерно каждая третья женщина и каждый восьмой мужчина старше 50 лет когда-либо в течение своей жизни имели переломы костей, связанные с остеопорозом (рис. 1). Из-за постоянного старения населения Земли ожидается, что количество случаев переломов шейки бедра увеличится с 1,7 миллиона в 1990 году до 6,3 миллиона в 2050 году.
/75/75.jpg)
Потеря массы костной ткани происходит исподволь и часто диагностируется только после переломов. По мере увеличения продолжительности жизни женщин риск развития остеопороза и переломов возрастает.
У каждой второй женщины и каждого восьмого мужчины старше 50 лет возникнет такой перелом. Ежегодно у 80 тыс. мужчин происходит перелом шейки бедра, и каждый третий из них умирает в течение года. Расходы на лечение остеопороза и обусловленные им переломы составляют в США 14 млрд долларов в год (стационарное лечение и сестринский уход на дому).
После наступления менопаузы у женщин отмечается максимальная скорость потери костной массы, которая достигает 2–5 % в год. В итоге женщина к 70 годам теряет от 30 до 50 % массы костной ткани. У мужчин эти потери составляют от 15 до 30 %. Смертность в результате осложнений после перелома шейки бедра в популяции белых женщин старше 50 лет составляет 2,8 %. Такой же процент смертности среди женщин с раком молочной железы.
Классификация остеопороза
А. Первичный остеопороз:
1. Постменопаузальный остеопороз (1-го типа).
2. Сенильный остеопороз (2-го типа).
3. Ювенильный остеопороз.
4. Идиопатический остеопороз.
Б. Вторичный остеопороз:
1. Заболевания эндокринной системы.
2. Ревматические заболевания.
3. Заболевания органов пищеварения.
4. Заболевания почек.
5. Заболевания крови.
6. Другие заболевания и состояния.
7. Генетические нарушения.
8. Медикаменты.
В Международной классификации болезней Х пересмотра различают остеопороз с патологическими переломами костей и остеопороз без патологических переломов.
По морфологическим критериям выделяют:
1. Трабекулярный остеопороз.
2. Кортикальный остеопороз.
3. Смешанный остеопороз.
По метаболической активности:
1. Остеопороз с высоким костным обменом.
2. Остеопороз с низким уровнем метаболизма костной ткани.
3. Остеопороз с нормальными показателями костного метаболизма.
Среди всех форм остеопороза преобладающей является первичный остеопороз (постменопаузальный и сенильный), составляющий 85 % всех случаев. Среди вторичного остеопороза наиболее распространены стероидный остеопороз, остеопороз при эндокринных и ревматологических заболеваниях.
Этиология
Факторы риска остеопороза:
1. Немодифицируемые:
— низкая минеральная плотность кости;
— женский пол;
— возраст старше 65 лет;
— европеоидная раса;
— семейный анамнез остеопороза и переломы при минимальной травме у родственников (мать, отец, сестры) в возрасте старше 50 лет;
— гипогонадизм;
— системный прием глюкокортикоидов более трех месяцев;
— предшествующие переломы;
— иммобилизация.
2. Модифицируемые:
— индекс массы тела < 20 кг/м2 или масса тела < 57 кг;
— курение;
— низкая физическая активность;
— склонность к падениям;
— недостаточное потребление кальция;
— дефицит витамина D;
— злоупотребление алкоголем.
Патогенез
Остеопороз сегодня широко используется как модель фундаментальных исследований в изучении молекулярных механизмов межклеточного взаимодействия. Остеопороз — многофакторное заболевание, в основе которого лежат процессы нарушения костного ремоделирования с повышением резорбции костной ткани и снижением костеобразования (рис. 2, 3). Ремоделирование костной ткани начинается с резорбции, осуществляемой в процессе остеокластогенеза с образованием полости резорбции. Остеобласты (ОБ) «атакуют» полость резорбции, где строят новый костный матрикс для последующей минерализации. Оба процесса костеобразования тесно связаны. Образование кости превышает резорбцию в течение роста скелета, и наоборот, резорбция превалирует в течение последующего периода жизни человека. Оба процесса костеобразования являются результатом тесного клеточного взаимодействия ОБ и остеокластов (ОК), которые берут начало от предшественников различных клеточных линий, а именно: ОБ — из мезенхимальных стволовых клеток, ОК — из макрофагально-моноцитарных клеток крови.
Кость формируется остеобластами. Основная их функция — синтез остеоида (протеинового матрикса), который на 90–95 % состоит из коллагена 1-го типа, на 5 % — из белка остеокальцина и впоследствии минерализуется кальцием и фосфатом из внеклеточной жидкости. ОБ содержат фермент щелочную фосфатазу, несут рецепторы к паратиреоидному гормону (ПТГ) и кальцитриолу и способны к пролиферации. Минеральная часть кости состоит из гидроксиапатита и аморфного фосфата кальция, которые нековалентно связаны с белками органического матрикса.
Резорбция кости осуществляется остеокластами. Это подвижные клетки. Выделяя протеолитические ферменты и кислую фосфатазу, они вызывают деградацию коллагена, разрушение гидроксиапатита и выведение минералов из матрикса. Имеется корреляция между активностью тартратрезистентной кислой фосфатазы в сыворотке крови и выраженностью резорбтивных процессов в кости.
В норме оба процесса — образование и разрушение — уравновешены (рис. 4).
Клиническая картина
Наиболее постоянный симптом — боли в поясничном и крестцовом отделах позвоночника, в области тазобедренных суставов; возможны боли в области голеностопных суставов, в ребрах, костях таза. Боли усиливаются при физической нагрузке, перемене атмосферного давления и погоды.
Боли в спине усиливаются по мере усугубления остеопороза позвоночника и при прогрессировании кифоза, в дальнейшем боли становятся постоянными в связи с перенапряжением мышц спины и связок позвоночника. В период возникновения перелома позвонков или ребер появляется острая боль соответственно локализации перелома.
Особенности клинической картины:
1. Чувство тяжести в межлопаточной области, общая мышечная слабость.
2. Снижение роста; при этом размах рук более чем на 3 см превышает длину тела.
3. Болезненность при пальпации и поколачивании позвоночника, напряжение длинных мышц спины.
4. Изменение осанки больного (появление сутулости, «позы просителя»; при наличии деформированных позвонков усиливается кифоз грудного отдела позвоночника, развивается «вдовий горб» или «горб престарелых дам»; возможно усиление поясничного лордоза).
5. Уменьшение расстояния между нижними ребрами и гребнем подвздошной кости (за счет уменьшения длины позвоночника) и появление мелких кожных складок по бокам живота.
6. Переломы костей — наиболее демонстративный симптом остеопороза. При постменопаузальном остеопорозе наблюдается преимущественно потеря трабекулярной (губчатой) костной массы. Чрезвычайно характерны переломы тел позвонков. При I типе системного остеопороза (постменопаузальном) компрессионные переломы тел позвонков возникают в течение 10 лет после менопаузы и их частота достигает максимума к 60–65 годам. Наиболее часто наблюдаются переломы с VI грудного до III поясничного позвонка. Диагноз перелома тела позвонка ставится на основании появления острой боли в соответствующем отделе позвоночника, резко усиливающейся при движениях и перкуссии позвоночника, а также рентгенографии позвоночника в двух проекциях.
Характерны также переломы луча в типичном месте — в дистальном отделе (переломы Коллеса), частота этих переломов увеличивается у женщин старше 45 лет.
В более поздних стадиях остеопороза часто наблюдаются переломы проксимального отдела бедренной кости (шейки бедра).
При стероидном остеопорозе часто возникают множественные переломы ребер.
При системном остеопорозе II типа (сенильном) наблюдаются потери как трабекулярной, так и кортикальной костной массы. Особенно характерны переломы проксимальных отделов бедра. Переломы шейки бедра связаны с кортикальным остеопорозом, а межвертельные — с потерей трабекулярного вещества.
Классическая клиническая триада остеопороза включает: боли в костях; переломы костей; изменение осанки и деформацию скелета.
Диагностика
Начальный этап диагностики остеопороза — это выявление факторов риска на основе данных пациента:
— низкое содержание кальция в рационе;
— дефицит витамина D;
— заболевания желудочно-кишечного тракта (снижение всасываемости кальция);
— ранняя менопауза;
— длительные периоды иммобилизации;
— длительный прием глюкокортикоидов, гормонов щитовидной железы;
— заболевания щитовидной железы, надпочечников, почек, печени;
— низкий индекс массы тела;
— вредные привычки (курение, алкоголь);
— низкая физическая активность.
Рентгенологические методы являются наиболее доступными и широко используются в клинической практике при исследовании костей. Однако при рентгенографии можно обнаружить наличие остеопении только при потере более 30 % костной массы, поэтому с помощью данного метода чаще выявляют поздние признаки остеопороза — деформацию позвонков или переломы трубчатых костей.
Золотым стандартом диагностики остеопоротических изменений является рентгеновская денситометрия. Денситометрия — измерение плотности костной ткани, основано на измерении минерального компонента костной ткани — кальция.
В настоящее время для ранней диагностики остеопороза используют различные методы костной денситометрии, позволяющие выявить уже 2–5 % потери массы кости, оценить динамику плотности костной ткани в процессе развития заболевания или эффективность лечения. Применяются изотопные методы (моно- и двухфотонная абсорбциометрия), рентгеновские (моно- и двухэнергетическая абсорбциометрия, количественная компьютерная томография) и ультразвуковые. Наиболее универсальным является применение двухэнергетической рентгеновской абсорбциометрии — золотого стандарта, позволяющего измерять содержание костного минерала в любом участке скелета, а также определять содержание солей кальция, жира и мышечной массы во всем организме. Стандартными (автоматическими) программами для таких денситометров являются программы для поясничных позвонков, проксимальных отделов бедра, костей предплечья и программа «все тело». Отсутствие всеобщей доступности дорогостоящего оборудования заставляет использовать альтернативные способы диагностики нарушений костного обмена.
С целью оценки метаболизма костной ткани применяются лабораторные методы диагностики.
Цель лабораторной диагностики — исключение заболеваний, проявлением которых может быть остеопения (остеомаляция, болезнь Педжета, костные метастазы, миеломная болезнь и др.), установление причин вторичного ОП, а также метаболическая характеристика ОП. Последняя важна не только для постановки диагноза, но и для выбора метода адекватной терапии и оценки ее эффективности.
Основная цель ранней биохимической диагностики остеопороза состоит в оценке интенсивности костного метаболизма. Для этого используются специальные биохимические маркеры, которые можно разделить на три группы.
Маркеры формирования костной ткани
1. Остеокальцин — основной неколлагеновый белок костного матрикса, который синтезируется остеобластами. Синтез остеокальцина зависит от витаминов К и D, что до некоторой степени снижает чувствительность и специфичность определения остеокальцина как маркера метаболизма костной ткани. Именно его концентрация в крови отражает метаболическую активность остеобластов костной ткани, поскольку остеокальцин крови — результат нового синтеза, а не высвобождения его при резорбции кости. Он синтезируется остеобластами во внеклеточное пространство кости, часть попадает в кровоток, где он и может быть проанализирован. Высокий уровень ПТГ подавляет выработку белка остеобластами, в результате чего снижается его концентрация в костной ткани и крови. По мнению многих авторов, этот показатель рассматривается как возможный прогностический индикатор усиления заболевания костей. При первичном ОП выявляется как нормальный, так и слегка повышенный уровень остеокальцина. Повышенное его содержание при первичном ОП обнаруживают у лиц с высоким уровнем костного обмена [2, 3]. Повышенный уровень декарбоксилированного остеокальцина может свидетельствовать об увеличении риска возникновения переломов бедра при сенильном ОП [2, 4].
2. Кальцитонин продуцируется парафолликулярными клетками щитовидной железы и оказывает следующее влияние на костную ткань и метаболизм кальция и фосфора:
— ингибирует деятельность остеокластов и тем самым — резорбцию костной ткани;
— стимулирует деятельность остеобластов, синтез костного матрикса и отложение кальция в костях;
— снижает содержание кальция в крови, стимулируя поступление его в кости;
— стимулирует поглощение костями фосфора и снижает содержание фосфатов в крови;
— увеличивает экскрецию с мочой кальция, фосфора, натрия, магния, калия, воды;
— стимулирует превращение в почках неактивной формы витамина D3 в биологически активную — 1,25(ОН)2D3 (кальцитриол) совместно с ПТГ [4].
3. Костный фермент щелочной фосфатазы (остаза) — показатель состояния костной ткани. Основные показания к применению: болезнь Педжета, опухоли кости и метастазы в костях, остеопороз [4].
Показания к назначению исследования:
— диагностика обменных заболеваний кости;
— контроль эффективности лечения остеопороза.
Повышение активности остазы:
— патология костной ткани (с повышением активности остеобластов или распадом костной ткани): болезнь Педжета (деформирующий остеит), остеомаляция, болезнь Гоше с резорбцией костей;
— гиперпаратиреоз;
— рахит;
— заживление переломов;
— остеосаркомы и метастазы злокачественных опухолей в кости;
— нарушения питания (недостаток кальция и фосфатов в пище);
— физиологическое: у недоношенных, у детей в период быстрого роста, у женщин в последнем триместре беременности и после менопаузы.
Снижение активности остазы:
— гипотиреоз;
— наследственная гипофосфатаземия (рецессивное аутосомальное заболевание, характеризующееся нарушением кальцификации кости);
— нарушения роста кости (ахондроплазия, дефицит аскорбиновой кислоты);
— недостаток цинка и магния в пище.
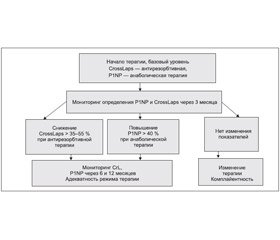
Маркер формирования костного матрикса (Total P1NP)
Это маркер активности метаболизма костной ткани в организме человека. Костный матрикс представляет собой систему, состоящую на 90 % из коллагена 1-го типа, который образуется из проколлагена 1-го типа, синтезирующегося фибробластами и остеобластами. Total P1NP высвобождается в межклеточное пространство и кровоток в процессе образования коллагена 1-го типа и встраивания его в матрикс кости, отражая таким образом активность формирования костной ткани [5].
Основные показания к назначению анализа:
1. Оценка эффективности анаболической терапии остеопороза.
2. Оценка эффективности антирезорбтивной терапии остеопороза.
3. Оценка эффективности терапии других видов патологии костной ткани.
Интерпретация результатов
Повышенный уровень:
1. Остеопороз.
2. Сенильный остеопороз.
3. Остеомаляция.
4. Несовершенный остеогенез.
5. Болезнь Педжета.
6. Почечная остеодистрофия.
7. Метастатические поражения костной ткани.
Интерферирующие факторы: интерпретацию результатов у пациентов с нарушенной функцией почек следует проводить с осторожностью, поскольку может происходить снижение экскреции маркера с мочой и, следовательно, увеличение его уровня в сыворотке.
Маркеры состояния обмена
1. Паратгормон оказывает свое регулирующее влияние на ремоделирование костной ткани, точками приложения его действия являются кость, почки, желудочно-кишечный тракт (в присутствии витамина D3 паратгормон усиливает всасывание кальция). Главным показанием к исследованию ПТГ является наличие гиперкальциемии или пониженное содержание фосфора в крови. При постменопаузальном ОП уровень ПТГ чаще нормальный или пониженный, а при сенильном и стероидном ОП, наоборот, немного повышен.
2. Кальций. При первичном ОП уровень кальция в крови, как правило, в пределах нормы, хотя имеются отдельные сообщения о тенденции к его повышению при постменопаузальном ОП с высоким показателем костного обмена. Гиперкальциемия возможна у больных сенильным ОП при длительной иммобилизации после перелома шейки бедра. При первичном ОП гиперкальциурия характерна для тех его вариантов, которые характеризуются повышенным костным обменом.
3. Фосфор. При первичном ОП уровень фосфора в крови в большинстве случаев нормальный. Тенденция к его снижению отмечена у пожилых людей при сочетании ОП с остеомаляцией (остеопоромаляция). Для оценки почечной реабсорбции фосфора определяют его концентрацию в утренней моче.
4. Витамин D общий. Показатель, отражающий статус витамина D в организме. 25(OH)D — основной метаболит витамина D, присутствующий в крови. Он образуется преимущественно в печени, при первой ступени гидроксилирования витамина D, обладает умеренной биологической активностью. 25(OH)D в крови переносится в комплексе с транспортным белком, может депонироваться в жировой ткани. Небольшая часть 25(OH)D подвергается гидроксилированию в почках с образованием более активного метаболита — 1,25(OH)D. Паратгормон повышает образование в почках 1,25(OH)D при снижении альтернативного, биологически неактивного продукта гидроксилирования — 24,25(OH)D. Две основных формы 25(OH)D — холекальциферол (витамин D3) и эргокальциферол (витамин D2). D3 образуется главным образом в коже под действием ультрафиолетовых лучей, в то время как источником D2 служит только пища. Важно, что концентрация 25(OH)D отражает вклад двух этих компонентов, обе формы витамина D в данном исследовании измеряются эквимолярно. Уровень 25(OH)D считается лучшим индикатором статуса витамина D в организме. Основная роль витамина D в организме связана с регуляцией кальциевого обмена. Уровень витамина D может варьировать в зависимости от возраста (у пожилых людей чаще наблюдается его снижение), сезона (выше в конце лета, ниже зимой), характера принимаемой пищи, этнической и географической популяции, наблюдается снижение содержания в крови витамина D при беременности. Помимо известной роли витамина D в кальциевом обмене, в исследованиях последних лет продемонстрировано, что при достаточном количестве витамина D снижается риск развития ряда онкологических заболеваний, сахарного диабета, рассеянного склероза, сердечно-сосудистых заболеваний, туберкулеза [3–5].
Гормональная регуляция уровня кальция в кости
Паратиреоидный гормон стимулирует резорбцию кости, опосредованно воздействуя на остеокласты; кальцитонин снижает количество остеокластов и тормозит их активность; эстрогены подавляют активность остеокластов; андрогены стимулируют пролиферацию остеоцитов и усиливают процессы костного синтеза.
Гормон роста и инсулиноподобный фактор роста 1 (соматомедин-С) активируют процесс синтеза кости за счет стимуляции остеобластов; инсулин стимулирует синтез костного матрикса; тироксин стимулирует остеокласты, усиливая резорбцию костной ткани; кортикостероиды замедляют синтез коллагена в костной ткани.
Из вышеперечисленного следует, что изучение уровня этих гормонов и маркеров костного ремоделирования на ранней стадии развития остеопении, особенно при вторичном ОП, позволит спрогнозировать и оценить вероятность дальнейшей резорбции костной ткани, провести профилактику ОП, назначить лечение.
Маркеры резорбции костной ткани
Для оценки эффективности лечения остеопороза используют, как правило, маркеры резорбции, поскольку их снижение под влиянием терапии начинается уже через 2–3 недели и достигает плато через 3–6 месяцев. Выявление нормального или значительно повышенного уровня маркера резорбции при однократном определении уже имеет диагностическое значение.
1. Вeta-CrossLaps — С-концевые телопептиды, образующиеся при деградации коллагена 1-го типа, который составляет более 90 % органического матрикса кости. Измерение beta-CrossLaps позволяет оценить темпы деградации относительно «старой» костной ткани. В норме малые фрагменты коллагена, образующиеся при его деградации, поступают в кровь и выводятся почками с мочой. У пациентов со сниженной функцией почек содержание beta-CrossLaps в сыворотке крови возрастает вследствие снижения экскреции. При патологическом увеличении резорбции костной ткани (пожилой возраст, остеопороз) коллаген 1-го типа деградирует в большом объеме, что приводит к увеличению уровня фрагментов коллагена в крови.
В настоящее время появляется все больше данных о влиянии полиморфизма генов на минеральную плотность костной ткани (МПКТ). Группой ученых из ГУ «Институт ревматологии РАМН» были получены данные о влиянии полиморфизма гена ВМР4 на минеральную плотность костной ткани и маркеры костного ремоделирования в группах женщин в постменопаузе, имеющих остеопороз. Обнаружена значимая ассоциация полиморфизма этого гена (6007СТ полиморфизма 4-го экзона) с МПКТ поясничного отдела и маркерами костного ремоделирования. При этом средний уровень щелочной фосфатазы был снижен, а уровень CrossLaps был высоким. Эти данные свидетельствуют о более низкой интенсивности процессов костеобразования и более высокой интенсивности процессов костной резорбции.
Изучение аллельного полиморфизма сети генов костного ремоделирования является перспективным направлением для выявления генотипов предрасположенности к остеопорозу.
Таким образом, определение уровня биохимических маркеров резорбции и ремоделирования кости позволяет:
— при профилактическом обследовании выявить пациентов с метаболическими нарушениями процессов ремоделирования и резорбции костной ткани;
— оценить и прогнозировать уровень потери костной массы;
— оценить эффективность проводимой терапии уже через 2–3 месяца.
Прогностическая значимость
Уровни маркеров резорбции костей, превышающие норму в 2 раза, связывают с двукратным увеличением риска переломов; пациенты с остеопорозом, у которых уровни маркеров резорбции костей превышают норму в 3 раза, имеют другую метаболическую костную патологию (включая злокачественную). Таким образом, показаниями к исследованию маркеров метаболизма костной ткани являются:
— определение риска развития остеопороза;
— мониторинг в период мено- и постменопаузы;
— мониторинг при проведении гормональной заместительной терапии;
— оценка эффективности терапии антирезорбционными препаратами.
2. Bone TRAP 5b
Кислые фосфатазы — широко распространенные ферменты. На сегодняшний день известны изоформы 1–5, из которых изоформа 5 не ингибируется тартратом.
Изофермент 5 встречается в двух вариантах — 5а и 5b. Тартратрезистентная кислая фосфатаза типа 5b (костная ТРКФ 5b, EC 3.1.3.2, Mr 36.357; 323 аминокислоты (немодифицированный прекурсор), генное происхождение — хромосома 19p13.3–p13.2) синтезируется исключительно в остеокластах. Поэтому возможно установить степень активности остеокластов при помощи определения фермента ТРКФ 5b. Так как элиминация ТРКФ 5b происходит через печень, а не через почки, то у пациентов с почечной недостаточностью этот фермент является хорошим маркером резорбции кости.
Показания:
— определение степени резорбции кости (болезнь Педжета, остеопороз, метастазы в кости, почечная остеопатия);
— мониторинг антирезорбтивной терапии (например, бифосфонатами или заместительной гормональной терапии).
Генетические исследования остеопороза
Определение молекулярно-генетических причин остеопороза является достаточно сложной задачей, так как остеопороз — мультифакториальное заболевание. Развитие остеопороза обусловлено влиянием множества генов, проявление которых, в свою очередь, зависит от воздействия различных факторов внешней среды. Тем не менее существует подход, который состоит в определении степени сцепления между мутациями в гене-кандидате (априорно выбранном исследователем, который учитывает его важность в метаболизме, например, костной ткани) и болезнью. С помощью этого метода можно выявлять первостепенность (ассоциацию) вовлеченного в патогенез заболевания специфического полиморфизма гена-кандидата. Преимущество этого подхода в том, что он может давать информацию об относительной роли каждой мутации (полиморфизма) отдельно взятого гена-кандидата в патогенезе заболевания. Также важно отметить, что очевидность ассоциации между мутациями в гене-кандидате не подразумевает, что они являются причиной самого заболевания. Скорее всего, они могут быть просто маркерами для других мутаций, которые ассоциированы с процессами, вызывающими заболевание, локализованы в этом же гене или в локусе поблизости при неравновесном сцеплении (Ralston, 1998; Ralston, 1999).
Наиболее интенсивные исследования в последние годы были посвящены определению степени ассоциации между аллельными вариантами гена рецептора витамина D (Моrrissоn et al., 1994; Wood et al., 1998; Furuya et al., 1999; Audi et al., 1999) и МПКТ, а также между мутацией в сайте связывания транскрипционного фактора Sp1 в регуляторной области гена коллагена 1-го типа альфа-1 (Col1a1) и массой и прочностью костей (Liden et al., 1998; Hampson et al., 1998; Keen et al., 1999; Alvarez, 1999; Hustmyer et al., 1999; Sainz et al., 1999).
1. Исследование гена COL1A1 имеет прогностическое значение, позволяющее определить риск развития остеопороза. Ген COL1A1 кодирует аминокислотную последовательность альфа-1-цепи белка коллагена 1-го типа. Коллаген представляет собой белковую основу соединительных тканей, в том числе костной. Молекулы коллагена состоят из трех полипептидных цепей, закрученных в спирали. Для первичной структуры молекул коллагена характерна частая повторяемость последовательности «глицил — пролил — оксипролил». Благодаря коллагену костная ткань сочетает твердость и прочность с гибкостью и эластичностью.
Полиморфизм 2046 GT гена COL1A1 представляет собой точечную замену нуклеотида гуанина тимином, что приводит к нарушению сайта связывания для фактора транскрипции гена COL1A1 в области первого интрона. У носителей варианта Т данного полиморфизма наблюдается нарушение нормального соотношения субъединиц в молекуле коллагена, что приводит к ухудшению его механических свойств. Вследствие этого носители варианта Т, особенно женщины в постменопаузе, гомозиготные по данному варианту, подвержены остеопорозу, костным переломам [6–8].
Показания к назначению анализа:
— оценка генетических факторов предрасположенности к остеопорозу.
2. Витамин D3, ген рецептора VDR
Ген рецептора витамина D3 (VDR3) локализован на хромосоме 12 в области 12q13–14 и состоит из 60 тыс. пар нуклеотидов, в его структуру входит 8 кодирующих и 3 альтернативных 5’-некодирующих экзона. 1,25-дигидроксивитамин D3 (1,25(ОН)2D3) — активная форма витамина D, участвующая в регуляции метаболизма кальция и стимулирующая клеточно-опосредованный иммунитет. Свое действие витамин D оказывает через рецептор (VDR), расположенный на поверхности моноцитов и активированных Т- и В-лимфоцитов. Поскольку при минерализации костной ткани важную роль играет витамин D3, то рецептору этого витамина (VDR) принадлежит в данном случае ключевая роль. В настоящее время представляется, что его различные аллельные гены лучше всего подходят для прогнозирования плотности кости. Эти аллели коррелируют с эндонуклеазными рестрикторными пунктами для Bam-1, Apa-1 и Tag-1, из которых отрезок Bam-1 VDR-гена имеет наибольшую информативность. На вопрос о значении надежного прогноза в отношении развития остеопороза в будущем отвечает большое число страдающих этим заболеванием. Поскольку сегодня профилактика остеопороза возможна, то предсказание потери плотности кости имеет большое клиническое значение.
Возможны три варианта аллельных генов VDR: отсутствие предрасположенности к остеопорозу (bb); умеренная предрасположенность (bB); высокая предрасположенность (ВВ). Целью исследования было выявить корреляцию между ограниченной плотностью кости и видами аллельных генов VDR впервые у больных остеопорозом, а не так, как делалось до сих пор, — у здоровых индивидуумов [6–8].
Процесс костного ремоделирования регулируется многими системными гормонами, цитокинами, факторами роста, идентифицированы многие локальные факторы костного ремоделирования. При изучении ОП важна оценка параметров минерального кальций-фосфор-магниевого обмена (уровень общего и ионизированного кальция, фосфора, магния, меди, цинка, витаминов С и К), которые вовлечены в процесс костеобразования.
Лабораторные показатели при остеопорозе [5]
Лабораторные показатели при остеопорозе представлены в табл. 1.
Сегодня каждый из вас может выполнить современную и качественную диагностику остеопороза в лаборатории ООО «Синэво Украина».
Выводы
Основным при лабораторной диагностике остеопороза является обнаружение повышенной резорбции костей (исследование двух маркеров — дезоксипиридинолина и beta-CrossLaps) в дополнение к анамнезу, клиническим данным и исследованию плотности костей методом денситометрии. Очень важно также определение концентрации 25-OH-витамина D в сыворотке, чтобы обнаружить дефицит витамина D, и концентрации паратгормона в плазме для выявления вторичного гиперпаратиреоза. Эти исследования должны быть повторены в течение периода времени между январем и апрелем, потому что дефицит витамина D, вторичный гиперпаратиреоз и увеличенная резорбция костей часто обнаруживаются только в этот промежуток. Важно также исследовать концентрацию эстрадиола в сыворотке крови: низкий уровень эстрадиола повышает чувствительность костей к действию паратгормона [9].
Все эти исследования проводятся в лаборатории «Синэво» на современном оборудовании с использованием тест-систем ведущих мировых производителей. Мы рады вам помочь в диагностике остеопороза и контроле лечения ваших пациентов.
Таким образом, проведение вышеперечисленных лабораторных исследований позволяет:
— при профилактическом обследовании выявить пациентов с метаболическими нарушениями процессов ремоделирования и резорбции костной ткани;
— оценить и прогнозировать уровень потери костной массы;
— оценить эффективность проводимой терапии уже через 2–3 месяца.
1. Consensus Development Conference. Diagnosis, prophylaxis, and treatment of osteoporosis // American Journal of Medicine. — 1993. — Vol. 94. — P. 646–650.
2. Поворознюк В.В. Захворювання кістково-м’язової системи в людей різного віку: У 3 т. — Т. 3. — К., 2009. — 664 с.
3. Calvo S., Eyre D.R., Gundberg C.M. Molecular basis and clinical application of biological markers of bone turnover // Endocrine Rev. — 1996. — Vol. 17(4). — P. 333–363.
4. Delmas P.D., Garnero P. Biological markers of bone turnover in osteoporosis // Osteoporosis / Eds. J. Stevenson, R. Lindsay. — London: Chapman & Hall Medical, 1998. — Р. 117–136.
5. Guder W.G., Nolte J. (Editor). Das Laborbuch für Klinik und Praxis. — München; Jena: Urban & Fischer, 2005.
6. Mann V., Ralston S.H. Meta-analysis of COL1A1 Sp1 polymorphism in relation to bone mineral density and osteoporotic fracture // Bone. — 2003. — Vol. 32, № 6. — P. 711–717.
7. Grant S.F., Reid D.M., Blake G. et al. Reduced bone density and osteoporosis associated with a polymorphic Sp1 binding site in the collagen type I alpha 1 gene // Nat. Genet. — 1996. — Vol. 14, № 2.
8. База OMIM *120150 http://www.ncbi.nlm.nih.gov/entrez/dispomim.cgi?id=120150
9. Lee J. et al. // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91. — P. 1069–1075.

/76/76.jpg)
/77/77.jpg)
/80/80.jpg)
/82/82.jpg)
/83/83.jpg)