Журнал «» 5 (37) 2014
Вернуться к номеру
Проблема судинної деменції в загальній лікарській практиці: раціональна антигіпертензивна терапія як пріоритетний напрямок профілактики
Авторы: Соломенчук Т.М. - д.м.н., професор кафедри сімейної медицини ФПДО Львівського національного медичного університету імені Данила Галицького
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 9-14
Внаслідок прогресивного постаріння населення планети зростає й актуальність медико-соціальних проблем, пов’язаних з віком людини. Однією з них є деменція — порушення когнітивних функцій у людей літнього віку. Часто її поява є наслідком тривало перебігаючої артеріальної гіпертензії (АГ) та одним із проявів ураження головного мозку як органа-мішені. Частота виникнення деменції становить від 5 до 20 % в осіб віком понад 60 років та сягає майже 50 % в людей віком старше 85 років. Її ризик подвоюється кожні десять років після досягнення 65-літнього віку. В даний час у світі налічується близько 24–25 млн пацієнтів із деменцією. За прогнозами експертів ВООЗ, їх кількість у 2025 році може збільшитись у 1,7 раза (порівняно з початком століття) і досягти 35 млн осіб. У 2040 році очікується понад 80 млн хворих із тяжкими розладами когнітивних функцій [1–5]. Розвиток деменції значно погіршує якість життя хворих та оточуючих їх осіб, знижує соціальну активність, істотно збільшує витрати на лікування і майже у 2,5–3 рази підвищує смертність. Крім того, деменція займає третє місце за витратами на лікування і догляд за пацієнтами. Так, наприклад, у США вартість лікування одного хворого на деменцію становить 40 тис. доларів на рік [2, 3].
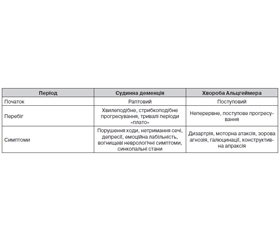
Деменція є найбільш тяжким клінічним проявом когнітивної дисфункції в літньому віці. Відомо понад 100 нозологічних форм, що можуть призвести до її розвитку. В даний час виділяють два основних патогенетично відмінних види деменції: судинну деменцію (СД) та хворобу Альцгеймера. Найбільш поширеною клінічною формою деменції (понад 40 % випадків) є хвороба Альцгеймера. В основі її розвитку лежить накопичення в мозку патологічного білка β-амілоїду, якому притаманні нейротоксичні властивості. Друге місце за частотою займає СД, для якої встановлений тісний зв’язок із віком, АГ та перенесеними інсультами [2, 3, 5, 6]. За даними деяких авторів, питома вага СД становить від 10 до 39 % [7]. Частота цих двох форм в окремих країнах має розбіжності. Наприклад, у США переважає деменція, що виникає на ґрунті хвороби Альцгеймера. В той же час у Швеції деменція альцгеймерівського типу та СД поширені практично однаково [5]. У країнах, де тривалість життя знижується, а тягар факторів високого кардіоваскулярного ризику зростає, особливої актуальності набуває проблема розвитку саме СД. Наприклад, у Росії, де частота СД у загальній популяції досягає 5,4 %, вона вважається найпоширенішим видом деменцій [7]. Останнім часом велика увага фахівців приділяється змішаній деменції (10–15 % серед усіх деменцій), що виникає внаслідок поєднання судинних та альцгеймерівских мозкових змін. При дослідженні тканин мозку померлих хворих зі змішаною формою деменції знаходять як ознаки інфарктного ураження внаслідок ускладненого артеріоло- та атеросклерозу, так і нейродегенеративні зміни, характерні для хвороби Альцгеймера [5, 8].
Фактори ризику СД
Серед чинників, що призводять до виникнення деменції, найбільше значення мають вік, АГ, цукровий діабет, куріння, миготлива аритмія, серцева недостатність, перенесений ішемічний інфаркт мозку, фізична пасивність та інтелектуальна дисфункція в анамнезі [1, 2, 8, 9].
Найважливішим фактором ризику розвитку і прогресування СД, а також незалежним чинником виникнення деменції в усіх вікових групах є АГ [5, 6, 10–13]. Зокрема, у дослідженні Honolulu-Asia Aging Study, в якому взяли участь 3735 осіб віком 45–50 років, підвищений рівень артеріального тиску (АТ) у середньому віці асоціювався з когнітивною дисфункцією в старості. Підвищення систолічного АТ (САТ) на кожні 10 мм рт.ст. збільшувало ризик помірних когнітивних порушень у майбутньому на 7 %, тяжких — на 9 %. Найбільший ризик деменції мали неліковані пацієнти [10]. Подібні результати отримані і в інших дослідженнях [14–16]. Відносний ризик деменції зростає майже втричі при рівні САТ ≥ 160 мм рт.ст. у 50-літньому віці, приблизно вдвічі — при ДАТ ≥ 95 мм рт.ст. або рівні загального холестерину ≥ 5 ммоль/л [5]. Спостереження за хворими з найбільшим ризиком розвитку СД, тобто людьми похилого віку (старше 70 років), засвідчило суттєво більшу частоту її розвитку після 79 років в осіб із початково вищим рівнем АТ (178/101 мм рт.ст.) порівняно з хворими на АГ із нижчими стартовими значеннями АТ (164/92 мм рт.ст.) [11].
Більшість досліджень підтверджують, що ризик розвитку СД асоціюється насамперед із рівнем систолічного АТ [17, 18]. Істотне значення мають його високий середній і максимальний рівень, а також циркадний ритм. Доведено, що коливання САТ упродовж доби у цих хворих більші, ніж у пацієнтів з іншими видами цереброваскулярних порушень та у здорових людей. Крім того, на відміну від здорових осіб, у цих пацієнтів АТ уночі не знижується [7, 19]. Слід зауважити, що у похилому віці АГ діагностується у понад 80 % випадків [7], а найчастішою клінічною формою гіпертензії є ізольована систолічна АГ, при якій спостерігається підвищення саме САТ (САТ > 140 мм рт.ст., ДАТ < 90 мм рт.ст.).
Патоморфологічні типи СД
Тривало перебігаюча або неадекватно лікована АГ стає причиною як функціональних, так і структурних змін у судинах церебрального русла. Зокрема, лише в третині випадків у хворих із цереброваскулярною патологією на тлі АГ спостерігається нормальна цереброваскулярна реактивність (за даними проби з нітрогліцерином). У решті випадків реакція судин може бути фізіологічно зниженою (до 20 %), різноспрямованою (до 25 %), неадекватною (до 15 %) або взагалі відсутньою (10 %). Такі функціональні порушення пов’язані насамперед з підвищенням жорсткості артеріальних стінок, при якій коливання АТ призводять до порушення перфузії й ураження тканин головного мозку [2].
Найбільш значущі функціональні та морфологічні зміни при АГ відбуваються в інтрацеребральних артеріях діаметром 70–500 мкм та мікроциркуляторному руслі [20]. Ліпогіаліноз та артеріолосклероз судин головного мозку в подальшому стає підґрунтям для виникнення мікроінфарктів мозку — одного з морфологічних субстратів когнітивних порушень у пацієнтів з АГ. Провідну роль при цій патології відіграє ураження не лише кори, а й білої речовини мозку — переважно лобних відділів, які при цьому втрачають зв’язки з іншими структурами центральної нервової системи [2, 5, 7, 8]. За визначенням МКХ-10, СД — це результат інфарктів головного мозку внаслідок ураження церебральних судин при АГ. Інфаркти, що виникають, як правило, невеликі, але їх наслідки кумулюються і сприяють розвитку СД [2, 8, 21].
На особливу увагу заслуговує стан когнітивних функцій у кардіологічних хворих. Одним із основних механізмів хронічного ураження головного мозку вважається кардіогенна гемодинамічна церебральна ішемія, зумовлена персистуючим зниженням серцевого викиду [3, 22]. Не менше значення має виражене атеро– або артеріосклеротичне ураження артерій головного мозку, що призводить до поступового прогресуючого погіршення церебральної гемодинаміки та перфузії. У хворих на ішемічну хворобу серця (ІХС) симптоми ішемії мозку спостерігаються часто. Маркером ураження інтрацеребральних артерій при ІХС є потовщення комплексу інтима-медіа та атеросклеротичні бляшки (навіть поодинокі), виявлені в сонних і хребетних артеріях при дуплексному скануванні. Фібриляція передсердь (ФП) також істотно погіршує когнітивні функції хворого як самостійно (провокуючи епізоди кардіогенної ішемії мозку), так і внаслідок перенесених кардіоемболічних інсультів. У ряді досліджень продемонстрована пряма кореляція між ФП і ризиком деменції. Постійна форма ФП достовірно асоціюється зі зниженням когнітивних функцій незалежно від освітнього рівня, соціального статусу, показників добового моніторування АТ, наявності діабету, перенесеного великого інсульту і стану скоротливості лівого шлуночка [3, 23].
Частим проявом ураження головного мозку при АГ є хронічна гіпертензивна енцефалопатія, формування якої пов’язане з погано контрольованим рівнем САТ та зумовленим цим порушенням кровообігу в мозкових судинах, що виникає внаслідок плазматичного й геморагічного просочування, некрозу стінок артерій із наступним їх стоншенням, але в подальшому — з адаптивним потовщенням та виникненням змін за типом гіпертонічної ангіоенцефалопатії [5, 13].
Щодо розвитку деменції змішаного типу, то нерідко спостерігається поєднання механізмів розвитку СД з елементами патогенезу хвороби Альцгеймера. При цьому β-амілоїд може відкладатись не лише в тканинах мозку, але й у судинній стінці, що призводить до розвитку амілоїдної мікроангіопатії [1, 7, 8]. Остання поглиблює недостатність мозковового кровообігу при АГ, патогенетично поєднуючи між собою розвиток хвороби Альцгеймера та СД.
У багатьох роботах деменцію, що розвивається у відносно короткі терміни після гострого порушення церебрального кровообігу, розглядають як окремий варіант СД. Деменція виникає у 10–17 % пацієнтів, які перенесли інсульт. Мозковий артеріотромбоз збільшує ризик виникнення СД у 4–12 разів і вважається безпосередньою причиною деменції приблизно у 50 % постінсультних хворих із когнітивними розладами. Проблема постінсультної деменції особливо активно вивчається протягом двох останніх десятиліть. Множинні, іноді безсимптомні або малосимптомні атеротромботичні інсульти можуть призводити до розвитку так званої мультиінфарктної деменції. З іншого боку, навіть невеликий одиничний інфаркт мозку може мати такі ж несприятливі функціональні наслідки, як і множинні церебральні інфаркти. У хворих віком понад 60 років ризик виникнення деменції в перші три місяці після інсульту в 9 разів вищий, ніж в осіб без інсульту. У цей період вона виникає у кожного четвертого постінсультного хворого. Наявність деменції на третину підвищує смертність хворих, які перенесли інсульт, і значно знижує якість їх відновного лікування [2, 8, 24].
Таким чином, враховуючи різноманітність етіологічних чинників та патогенетичних механізмів розвитку когнітивної дисфункції в осіб похилого віку, сьогодні вирізняють декілька патоморфологічних форм СД [1, 2, 7, 8, 13]:
1. Артеріосклеротичну або хронічну церебральну ішемію — прямий наслідок гіпертензивного ремоделювання артерій церебрального русла.
2. СД після перенесеного інсульту в стратегічно важливій зоні (таламус, гіпокамп, хвостате ядро) — інфаркту мозку.
3. Мультиінфарктну коркову деменцію — результат малих «німих» інфарктів кори мозку внаслідок ремоделювання та мікротромбозів мікроциркуляторного русла.
4. Субкортикальну судинну деменцію — наслідок мікротромбозів інтрацеребральних артеріол (глибоких відділів білої речовини мозку).
5. Змішану СД — поєднання кортикальних та субкортикальних змін.
Клінічні прояви СД
Одним із перших симптомів виникнення СД є прогресивне зниження пам’яті: труднощі запам’ятовування нового матеріалу та відтворення раніше засвоєної інформації. При СД порушення пам’яті має тенденцію до стрибкоподібного прогресування, що може бути не лише поступовим, але й раптовим. Часто спостерігається часовий зв’язок з попереднім гострим порушенням мозкового кровообігу. У подальшому до порушення пам’яті приєднуються розлади мислення (планування, організації і переробки інформації) та мови (дизартрія), знижується критика й виконавча функція, спостерігаються депресія та емоційна лабільність. Когнітивний дефіцит формується за 3–10 років, що тягне за собою необоротні порушення соціальної і професійної діяльності людини. Поступово хворий втрачає базові тілесні навики, свою незалежність і самостійність. Можуть спостерігатися запаморочення, епізоди непритомності (синкопе) та вогнищеві неврологічні симптоми. Нерідко пацієнт потребує стороннього догляду [1, 2, 8].
Для верифікації деменції використовують питальник MMSE (Mini-Mental State Examination) з тридцяти питань, за допомогою яких можна оцінити орієнтацію хворих у часі та просторі, короткочасну пам’ять та здатність мислення. Результат опитування менше 23 балів (по 1 балу за кожну правильну відповідь) свідчить про деменцію та необхідність подальшого обстеження хворого з метою уточнення її походження [5, 8]. Для більш глибокого дослідження хворих застосовують нейровізуалізаційні методи, зокрема комп’ютерну, магнітно-резонансну та однофотонну емісійну томографію. При цьому в більшості хворих одночасно верифікують два і більше патоморфологічні типи СД. Вираженість клінічних проявів деменції не завжди порівнянна із розмірами вогнищ мозкового ураження. Частіше вона зумовлена їх локалізацією [1].
Клінічні критерії деменції згідно з МКХ-10 [2, 8, 21]:
— Порушення пам’яті (коротко- і довготривалої).
— Порушення принаймні ще однієї з нижчеперелічених вищих мозкових функцій: праксису, гнозису, мови, здатності до узагальнення або абстрагування, регуляції довільної діяльності.
— Виявлені розлади спостерігаються за ясної свідомості хворого та виражені настільки, що призводять до значних труднощів у його професійній сфері чи побуті.
— Тривалість симптомів не менша за 6 місяців.
Раціональна антигіпертензивна терапія як засіб профілактики СД
Первинна профілактика СД насамперед полягає у вчасній корекції факторів ризику (АГ, цукрового діабету, гіперліпідемії, куріння та ожиріння), проведенні когнітивного тренінгу та підвищенні фізичної активності.
Враховуючи те, що основним фактором ризику розвитку СД є АГ, адекватна церебропротективна антигіпертензивна терапія залишається основним засобом зниження ризику цереброваскулярних подій приблизно на 30–40 % та попередження розвитку когнітивної дисфункції [25]. Навіть невелике зниження рівня АТ упродовж року (САТ — на 10 мм рт.ст., ДАТ — на 5 мм рт.ст.) призводить до суттєвого скорочення частоти розвитку інсультів та інших цереброваскулярних ускладнень АТ [26, 27].
Цільовий рівень АТ у пацієнтів із СД або її ризиком. У даний час не існує єдиної думки щодо оптимального рівня АТ у хворих на АГ із клінічними проявами цереброваскулярної патології. Згідно з рекомендаціями Європейського товариства кардіологів та Європейського товариства з вивчення АГ (2007, 2009) [28–30], цільовим тиском у хворих на АГ повинен бути рівень < 140/90 мм рт.ст. При цьому в низці рандомізованих досліджень, у яких вивчалась ефективність антигіпертензивної терапії у хворих із перенесеними епізодами порушення мозкового кровообігу, була продемонстрована лінійна залежність зменшення частоти повторних цереброваскулярних подій від інтенсивності зниження рівня АТ. Більше того, в субаналізі дослідження SPARCL найменша кількість повторних інсультів була зареєстрована в осіб, АТ яких утримувався на рівні < 120/80 мм рт.ст. [27]. У той же час, згідно з результатами низки міжнародних епідеміологічних досліджень, при рівні АТ 110–120/70–80 мм рт.ст. ризик розвитку деменції також достовірно менший, ніж при недостатньому контролі АГ [8].
Однак у результаті проведення декількох інших великих рандомізованих досліджень було встановлено наявність J-подібної кривої збільшення судинних ускладнень та смертності при зниженні САТ < 120 мм рт.ст., ДАТ < 80 мм рт.ст. [27]. Особливе значення виявлена закономірність має для осіб похилого віку, в яких надмірне і/або швидке зниження рівня АТ може призвести до суттєвої гіпоперфузії мозку та розвитку (або поглиблення) цереброваскулярних проблем, зокрема когнітивної дисфункції. Нормалізації АТ слід досягати послідовно і поступово — протягом декількох місяців. На думку експертів у галузі неврології, підтримка АТ на рівні 140–150/80 мм рт.ст. у хворих старечого віку зі стартовими рівнями САТ понад 180–200 мм рт.ст. запобігає наростанню у них психічних та рухових розладів. При цьому важливою особливістю фармакотерапії АГ у таких осіб є уникнення епізодів гіпотензії як у нічний, так і в денний час. Крім того, на стадії появи виражених когнітивних порушень і вогнищевих неврологічних симптомів не рекомендується знижувати АТ менше за «робочий» рівень у конкретного пацієнта, оскільки це може збільшити церебральну ішемію і спровокувати прогресування СД [1, 7, 8].
Вибір лікарського засобу (ЛЗ) для ефективного зниження ризику СД. Хоча, згідно з сучасними поглядами, адекватне зниження АТ супроводжується зменшенням ризику деменції [25], здатність покращувати когнітивну функцію у пацієнтів з АГ доведена лише для окремих антигіпертензивних лікарських засобів. Зокрема, у дослідженні SHEP лікування діуретиками не привело до зменшення деменції порівняно з плацебо. Недостатньо ефективною щодо зниження частоти когнітивної дисфункції виявилася також і монотерапія інгібіторами ангіотензинперетворюючого ферменту (ІАПФ). Не встановлено відмінності щодо профілактики деменції між групами бета-блокатора, діуретика і плацебо у дослідженні MRC [6, 31, 32]. У міжнародному дослідженні SCOPE [33], метою якого якраз і була оцінка впливу антигіпертензивної терапії на збереження когнітивних функцій у 4964 хворих похилого віку з помірно вираженою АГ та індексом деменції за шкалою MMSE ≥ 24, кандесартан не продемонстрував переваг щодо профілактики та корекції порушень мислення, хоча виявився достатньо ефективним щодо зниження ризику нефатального інсульту (на 27,8 %).
Лише у дослідженні PROGRESS [25] поряд із позитивним ефектом комбінації ІАПФ та діуретика у профілактиці повторного інсульту вдалось отримати зниження частоти окремих типів когнітивної дисфункції. Зокрема, це стосувалось лише деменції, пов’язаної з перенесеним інсультом (на 34 %, р = 0,03). Зменшення кількості випадків інших видів деменції (на 12 %) виявилось недостовірним. У дослідженні MOSES, присвяченому вторинній профілактиці інсульту, когнітивні порушення були більш вираженими, а середній вік пацієнтів — старшим, ніж у дослідженні PROGRESS. Упродовж 4 років лікування епросартаном або нітрендипіном не було зареєстровано помітного погіршення когнітивних розладів у постінсультних хворих згідно з тестуванням за питальником MMSE, незважаючи на постаріння включених у дослідження осіб. Вважають, що порівнювані між собою ліки (сартан та антагоніст кальцію) справляють подібний позитивний церебропротективний ефект, пов’язаний з активацією рецепторів до ангіотензину ІІ типу [34, 35].
Проте, на відміну від епросартану, нітрендипін довів свій потужний антидементний ефект у великому дослідженні Syst-Eur [36], в якому взяли участь 2800 недементних пацієнтів віком понад 60 років з ізольованою систолічною АГ. Хворі отримували або плацебо, або дигідропіридиновий антагоніст кальцію II покоління нітрендипін із можливим додаванням інгібітора АПФ і/або тіазидного діуретика для досягнення рівня САТ < 150 мм рт.ст. Виявилось, що антигіпертензивна терапія нітрендипіном у пацієнтів із АГ достовірно знижує частоту розвитку деменції на 55 % порівняно з плацебо (7,4 проти 3,3 випадка на 1000 пацієнто-років). Важливо відзначити, що отриманий ефект стосувався всіх видів деменції: судинної, постінсультної та альцгеймерівської [5, 6, 36].
У зв’язку з цим було висловлено припущення, що антагоністу кальцію нітрендипіну, окрім антигіпертензивної дії, притаманні особливі ней–ропротективні властивості. Вважають, що він здатен попереджувати кальцієві механізми загибелі нейронів, накопичуючись у ділянках мозку (корі, таламусі, гіпокампі), де часто виникає апоптоз клітин унаслідок порушення регуляції внутрішньоклітинного кальцію; проникати через гематоенцефалічний бар’єр і стимулювати синтез нейротрансмітерів, дефіцит яких спостерігається при деменції. Крім того, нітрендипін зменшує ризик деменції, що пояснюється його здатністю знижувати активність тромбоцитів, які вважаються основним джерелом амілоїду та β-амілоїду, та пригнічувати продукцію тромбіну — одного з головних компонентів каскаду тромбоутворення [5].
В опублікованому пізніше (у 2010 році) post hoc аналізі дослідження Syst-Eur продемонстровано, що комбінація нітрендипіну з еналаприлом (n = 871) забезпечує ще кращі результати у зниженні ускладнень ізольованої систолічної АГ в осіб похилого віку, ніж лікування лише антагоністом кальцію (n = 1552). Поряд зі зниженням показника загальної смертності на 46 % (р = 0,0002), серцево-судинної смертності — на 35 % (р = 0,039), всіх кардіоваскулярних подій — на 28 % (р = 0,02) спостерігалось зменшення частоти фатального і нефатального інсультів на 46 % (р = 0,02) і, відповідно, пов’язаних із цим когнітивних порушень [37].
Згідно з настановами ESH/ESC [28, 29], комбінована терапія має декілька суттєвих переваг. Насамперед комбінація антигіпертензивних ліків у менших дозах дозволяє впливати на різні ланки патогенезу АГ та ремоделювання судин, запобігати розвитку дозозалежних побічних реакцій, скорочувати час до досягнення цільового АТ, покращувати прихильність до тривалої терапії та найважливіше — суттєво покращувати прогноз. Доведено, що поєднання двох-трьох препаратів у половинних дозах порівняно з монотерапією ЛЗ у максимальному дозуванні при однаковому зниженні рівнів АТ у хворих на АГ призводить до півтора–дворазового зменшення частоти кардіоваскулярних подій і, насамперед, — цереброваскулярних [26, 27].
До числа пріоритетних відноситься комбінація антагоніста Са з інгібітором АПФ. У дослідженні ACCOMPLISH хворі на АГ (n = 11 506) були рандомізовані у дві групи антигіпертензивної терапії: прийом комбінації тривалодіючого дигідропіридинового антагоніста кальцію з ІАПФ або ІАПФ з тіазидним діуретиком. Незважаючи на подібний антигіпертензивний ефект та однакове зниження рівня АТ, поєднання антагоніста кальцію з ІАПФ забезпечило додаткове зниження ризику будь-якого кардіоваскулярного ускладнення і смерті на 20 %. Важливо підкреслити, що ця комбінація виявилась особливо корисною у хворих із максимальною ймовірністю розвитку серцево-судинних ускладнень, зокрема осіб віком понад 70 років, зменшуючи у них ризик смерті та серцево-судинних ускладнень на 21 %.
Фіксована комбінація нітрендипіну з еналаприлом (препарат Енеас) забезпечує поєднання унікальних властивостей — зменшення ризику загальної і серцево-судинної смерті, кардіоваскулярних подій та частоти інсультів у хворих похилого віку з ізольованою систолічною АГ та зниження ймовірності розвитку у них деменції судинного, постінсультного та альцгеймерівського типу. Згідно з рекомендаціями Європейського товариства з вивчення АГ (2007, 2009) [28, 29], комбінація дигідропіридинового антагоніста та інгібітора ангіотензинперетворюючого фермента розглядається серед пріоритетних та може бути терапією першої лінії у хворих з високим серцево-судинним ризиком, коли є бажаним ранній контроль АТ.
Комбінована антигіпертензивна терапія ІАПФ (еналаприл) та пролонгованим антагоністом кальцію (нітрендипін), крім прогностичних, має цілий ряд клініко-фармакологічних переваг [37]. По-перше, при призначенні такої комбінації відбувається не просте додавання гіпотензивних ефектів, а потенціювання дії ЛЗ за рахунок їх впливу на різні ланки патогенезу АГ (блокада РААС та артеріолярна вазодилатація). У зв’язку з цим дози окремих компонентів зменшені до низьких або середніх. По-друге, така комбінація сприяє подоланню контррегуляторних механізмів, що завжди запускаються на початку антигіпертензивної терапії. Ці механізми спрямовані на підтримку стартової інтенсивності внутрішньоорганної перфузії, зумовленої високим АТ, і призводять до зменшення ефективності гіпотензивних ліків. Зокрема, ІАПФ нейтралізують можливу активацію симпатоадреналової системи, викликану дією антагоністів кальцію, яка клінічно виявляється схильністю до тахікардії як компенсаторної реакції у відповідь на швидке зниження АТ. По-третє, лікування цією комбінацією ЛЗ веде до зменшення частоти виникнення побічних ефектів і поліпшення прихильності до лікування. Маючи збалансовані вено– та артеріо–дилатуючі властивості, ІАПФ зменшують частоту периферичних набряків, що розвиваються в результаті вибіркової артеріолярної дилатації під впливом антагоністів кальцію. З іншого боку, натрійуретична дія антагоністів кальцію створює негативний баланс натрію і підсилює гіпотензивну дію ІАПФ [28, 37, 39].
Таким чином, АГ є головним чинником розвитку судинної деменції і порушення когнітивних функцій у хворих похилого віку. Адекватна антигіпертензивна терапія призводить до суттєвого зниження ймовірності розвитку судинної та інших видів деменції. Цільовим рівнем АТ повинен бути рівень менше за 140–130/90–80 мм рт.ст., а темпи його зниження — адекватними. Одним із найбільш ефективних у даний час ЛЗ, який, окрім зниження АТ, має самостійний церебропротективний антидементний ефект, є дигідропіридиновий антагоніст кальцію нітрендипін. Комбінація нітрендипіну з еналаприлом Енеас значно покращує як когнітивний прогноз, так і безпеку антигіпертензивної терапії у хворих похилого віку з ізольованою систолічною АГ.
1. Анацкая Л.Н. Терапевтическая стратегия при сосудистой деменции // Медицинский вестник. — 2008. — № 37(871).
2. Маркин С.П. Нарушение когнитивных функций во врачебной практике: Методическое пособие. — Воронеж, 2008. — 42 с.
3. Фонякин А.В., Гераскина Л.А. Сосудистые когнитивные расстройства и деменция: факторы риска и подходы к терапии // Consilium medicum. Неврология. Ревматология. — 2011. — Т. 13, № 2. — C. 81–85.
4. Захаров В.В., Яхно В.В. Нарушения памяти. — М.: ГЭОТАР-Медиа, 2003. — 150 с.
5. Кобалава Ж.Д., Котовская Ю.В., Моисеев В.С. Артериальная гипертония. Ключи к диагностике и лечению. — М.: ГЭОТАР–Медиа. — 862 с.
6. Конради А.О. Антигипертензивная терапия в профилактике и коррекции когнитивных расстройств // Артериальная гипертензия. — 2005. — Т. 11, № 3. — С. 160–163.
7. Остроумова О.Д., Смолярчук Е.А., Средняков А.В. Артериальная гипертензия и когнитивные нарушения: возможности длительно действующих дигидропиридиновых антагонистов кальция // Фарматека. — 2008. — № 15. — С. 44–49.
8. Захаров В.В., Яхно Н.Н. Когнитивные расстройства в пожилом и старческом возрасте: Методическое пособие для врачей. — Москва, 2005. — 71 с.
9. Whitmer R.A., Sidney S., Selby J. et al. Midlife cardiovascular risk factors and risk of dementia in late life // Neurology. — 2005. — Vol. 64. — Р. 277–281.
10. Launer L.J., Masaki K., Petrovitch H. et al. The association between midlife blood pressure levels and late-life cognitive function. The Honolulu-Asia Aging Study // JAMA. — 1995. — Vol. 274. — Р. 1846–1851.
11. Skoog I., Lernfelt B., Landahl S. et al. 15-year longitudinal study of blood pressure and dementia // Lancet. — 1996. — Vol. 347. — Р. 1141–1145.
12. Murray M.D., Lane K.A., Gao S. et al. Preservation of cognitive function with antihypertensive medications: a longitudinal analysis of a community-based sample of African Americans // Arch. Intern. Med. — 2002. — Vol. 162. — Р. 2090–2096.
13. Мищенко Т.С., Дмитриева Е.В. Роль артериальной гипертензии в развитии сосудистой деменции // Практическая ангиология. — 2006. — № 2(3).
14. Elias M.F., Wolf P.A., D’Agostino et al. Untreated blood pressure level is inversely reated to cognitive functioning: the Framingham Study // Am. J. Epidemiol. — 1993. — Vol. 138(6). — Р. 353–64.
15. Tzourio C., Dufouil C., Ducimetiere P., Alperovitch A. Cognitive decline in individuals with high blood pressure: a longitudinal study in the elderly. EVA Study Group. Epidemiology of Vascular Aging // Neurology. — 1999. — Vol. 53(9). — Р. 1948–1952.
16. Ruitenberg A., Skoog I., Ott A. et al. Blood pressure and risk of dementia: results from the Rotterdam Study and the Gothenburg H-70 study // Dement. Geriatr. Cogn. Disord. — 2001. — Vol. 12(1). — Р. 33–39.
17. Cicconetti P., Cacciafesta M., Monteforte G. et al. Event-related potentials in the elderly with new mild hypertension // Clin. Exp. Hypertens. — 2000. — № 22(6). — Р. 583–593.
18. Swan G.E., Carmelli D., Larue A. Systolic blood pressure tracking over 25 to 30 years and cognitive performance in older adults // Stroke. — 1998. — Vol. 29. — Р. 2334–2340.
19. Tohgi H., Cliba K., Kimura M. Twenty-four-hourvariation of blood pressure in vascular dementia of the Binswanger type // Stroke. — 1991. — Vol. 22. — Р. 603–608.
20. Гогин Е.Е., Шмырев В.И. Осложнения гипертонической болезни: дисциркуляторная энцефалопатия, инсульты // Терапевтический архив. — 1997. — № 4. — С. 5–10.
21. МКБ-10. ВОЗ: Женева, 1995. — Т. 1. — С. 315–316.
22. Saha M., Muppala M.R., Castaldo J.E. et al. The impact of cardiac index on the cerebral hemodynamics // Stroke. — 1993. — 24. — Р. 1668–90.
23. Elias M.F., Sullivan L.M., Elias P.K. et al. Atrial fibrillation is associated with lower cognitive performance in the Framingham offspring men // J. Stroke. Cerebrovasc. Dis. — 2006. — № 15. — Р. 214–222.
24. Kase C.S., Wolf P.A., Kelly-Hayes M. et al. Intellectual decline after stroke: The Framingham Study // Stroke. — 1998. — Vol. 29. — P. 805–812.
25. PROGRESS Collaborative Group. Randomised trial of a perindoprilbased blood-pressure-lowering regimen among 6105 individuals with previous stroke or transient ischaemic attack // Lancet. — 2001. — Vol. 358. — P. 1033–1041.
26. Law M.R., Morris J.K., Wald N.J. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomised trials in the context of expectations from prospective epidemiological studies // BMJ. — 2009. — Vol. 338. — Р. 1245–1253.
27. Бильченко А.В. Лечение больных с высоким кардиоваскулярным риском. Как предотвратить развитие инсульта? // Здоров’я України. — 2009. — № 14/1. — С. 64–66.
28. Mancia G., De Backer G., Dominiczak A. et al. Management of Arterial Hypertension of the European Society of Hypertension; European Society of Cardiology. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertens. — 2007. — Vol. 25(6). — Р. 1105–1187.
29. Mancia G., Laurent S., Agabiti-Rosei E. et al. Reappraisal of European guidelines on hypertension management: a European society of hypertension task force document // J. Hypertens. — 2009. — Vol. 27. — Р. 2121–2158.
30. Чазова И.Е., Фомин В.В. Рекомендации Европейского общества по артериальной гипертензии версии 2009 года: Что изменилось? // Клиническая нефрология. — 2010. — № 4. — С. 19–25.
31. Lever A.F., Brennan P.J. MRC trial of treatment in elderly hypertensives // Clin. Exp. Hypertens. — 1993. — Vol. 15. — Р. 941–2.
32. Heart Outcomes Prevention Evaluation (HOPE) Study Investigators. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICROHOPE substudy // Lancet. — 2000. — Vol. 355. — Р. 235–259.
33. Lithell H., Hansson L., Skoog I. et al. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial // J. Hypertens. — 2003. — Vol. 21. — Р. 875–886.
34. Fournier A., Messerli F.H., Achard J.M., Fernandez L. Cerebroprotection mediated by angiotensin II: a hypothesis supported by recent randomized clinical trials // J. Am. Coll. Cardiol. — 2004. — Vol. 43. — Р. 1343–1347.
35. Schrander J., Luders S., Kulschewski A. et al. Morbidity and mortality after stroke, eprosaran compared with netrendipine for seondary prevention (MOSES study) // Stroke. — 2005. — Vol. 36. — Р. 1218–26.
36. Forette F., Seux M.L., Staessen J.A. et al. The Prevention of dementia with antihypertensive treatment // Arch. Intern. Med. — 2002 Oct 14. — 162(18). — 2046–2052.
37. Thijs L., Richart T., de Leeuw P.W. et al. Morbidity and mortality on combination versus monotherapy: a post hoc analysis of the Systolic Hypertension in Europe trial // Journal of Hypertension. — 2010. — Vol. 28. — Р. 865–874.
38. Jameson K., Weber M.A., Bakris G.L. et al. ACCOMPLISH Trial Investigators. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients // N. Engl. J. Med. — 2008. — Vol. 359. — Р. 2417–2428.
39. Переваги комбінацій антигіпертензивних препаратів у лікуванні хворих з артеріальною гіпертензією // Артериальная гипертензия. — 2011. — № 2(16). — С. 101–103.

/12/12.jpg)