Украинский журнал хирургии 2 (25) 2014
Вернуться к номеру
Дезінтеграційні механізми функціонування та структурні зміни підшлункової залози у хворих на гострий панкреатит з урахуванням ліпідного профілю та функції гепатоцитів
Авторы: Іващук С.І. - Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Хирургия
Разделы: Клинические исследования
Версия для печати
Мета. Дослідити системні взаємозв’язки функціонального стану підшлункової залози й печінки, обміну ліпідів та системної запальної відповіді з урахуванням етіологічного чинника і статі у хворих на гострий панкреатит та загострення хронічного панкреатиту.
Матеріал і методи. Обстежені 86 хворих, серед яких було 35 (40,7 %) жінок і 51 (59,3 %) чоловік, віком від 23 до 77 років. Усі хворі мали набрякову форму панкреатиту: первинний гострий панкреатит встановили у 45 (52,3 %) осіб, загострення хронічного панкреатиту — у 41 (47,7 %) пацієнта. Проаналізовано системні взаємозв’язки показників структурно-функціонального стану підшлункової залози, печінки, обміну ліпідів та С-реактивного протеїну з урахуванням етіологічного чинника та статі у хворих на гострий панкреатит та загострення хронічного панкреатиту.
Результати та обговорення. Установлено, що у хворих на алкогольний гострий панкреатит зменшується дезінтоксикаційна функція печінки із переважанням цитолітичного та холестатичного компонентів на фоні системної та внутрішньоацинарної активації панкреатичних ензимів та інгібіторних протеаз, низької активності панкреатичної еластази-1. Біліарний гострий панкреатит супроводжується сильнішою системною запальною реакцією за рівнем С-реактивного протеїну (р = 0,027) та альфа-1-антитрипсину, суттєвими дисліпідемічними розладами з аналогічною алкогольному гострому панкреатиту фоновою агресивністю панкреатичних ферментів. Структурні зміни алкогольного гострого панкреатиту характеризуються помірно вираженою запальною реакцією паренхіми, парапанкреатичною гідрофільністю та появою дрібних кіст. Біліарний гострий панкреатит асоціює з більшою частотою гострозапальних змін структури підшлункової залози: зниженням ехогенності та її неоднорідністю.
Висновки. Установлено, що на фоні загальних дисліпідемічних розладів, зниження дезінтоксикаційної функції печінки та системної запальної реакції за гострого панкреатиту чи загострення хронічного панкреатиту мають місце відмінності у ступені їх прояву та структурних змінах підшлункової залози залежно етіологічних чинників.
Цель. Исследовать системные взаимосвязи функционального состояния поджелудочной железы и печени, обмена липидов и системного воспалительного ответа с учетом этиологического фактора и пола у больных с острым панкреатитом и обострением хронического панкреатита.
Материал и методы. Обследованы 86 больных, среди которых было 35 (40,7 %) женщин и 51 (59,3 %) мужчина, возрастом от 23 до 77 лет. У всех больных была отечная форма панкреатита: первичный острый панкреатит установили у 45 (52,3 %) человек, обострение хронического панкреатита — у 41 (47,7 %) пациента. Проанализированы системные взаимосвязи показателей структурно-функционального состояния поджелудочной железы, печени, обмена липидов и С-реактивного протеина с учетом этиологического фактора и пола у больных с острым панкреатитом и обострением хронического панкреатита.
Результаты и обсуждение. Установлено, что у больных с алкогольным острым панкреатитом уменьшается дезинтоксикационная функция печени с преобладанием цитолитического и холестатического компонентов на фоне системной и внутриацинарной активации панкреатических энзимов и ингибиторных протеаз, низкой активности панкреатической эластазы-1. Билиарный острый панкреатит сопровождается более сильной системной воспалительной реакцией согласно уровню С-реактивного протеина (р = 0,027) и альфа-1-антитрипсина, существенными дислипидемическими расстройствами с аналогичной алкогольному острому панкреатиту фоновой агрессивностью панкреатических ферментов. Структурные изменения алкогольного острого панкреатита характеризуются умеренно выраженной воспалительной реакцией паренхимы, парапанкреатической гидрофильностью и появлением мелких кист. Билиарный острый панкреатит ассоциируется с большей частотой островоспалительных изменений структуры поджелудочной железы: снижением эхогенности и ее неоднородностью.
Выводы. Установлено, что на фоне общих дислипидемических расстройств, снижения дезинтоксикационной функции печени и системной воспалительной реакции при остром панкреатите или обострении хронического панкреатита имеют место отличия в степени их выраженности и структурных изменениях поджелудочной железы в зависимости от этиологических факторов.
Objective. To investigate the systemic relationships of the pancreas and liver functional state, lipid metabolism and systemic inflammatory response considering the etiological factor and gender of patients with acute pancreatitis and exacerbation of chronic pancreatitis.
Materials and Methods. The study involved 86 patients, among them were 35 (40.7 %) women and 51 (59.3 %) men, aged 23 to 77 years. All patients had oedematous form of pancreatitis: primary acute pancreatitis was diagnosed in 45 (52.3 %) patients, exacerbation of chronic pancreatitis — in 41 (47.7 %) patients. The system relationship of the data of the structural and functional state of the pancreas, liver, lipid metabolism and C-reactive protein considering etiological factors and gender of patients with acute pancreatitis and exacerbation of chronic pancreatitis was analysed.
Results and Discussion. The structural changes of the pancreas in patients with acute pancreatitis, depending on the etiological factors were as follows: heterogeneity of the pancreas structure was observed 1.78 times more likely for biliary pancreatitis, while parapancreatic hydrophilicity 1.94 times more often was of alcoholic pancreatitis origin; in patients with acute pancreatitis of alcoholic origin ultrasonographically simple cysts were diagnosed, which are not observed in patients with acute biliary pancreatitis origin.
We have found that the majority of patients had a significant dyslipidaemia: total cholesterol content was higher than normal levels (> 5 mmol/l) in 64.7 % of men and 17.1 % women, low-density lipoprotein cholesterol (> 3 mmol/l) — in 51.0 and 17.1 %, respectively, triglycerides (> 1.7 mmol/l) — in 56.9 and 17.1 %, atherogenic index (> 3.0) — in 49.0 and 34.3 %, with low antiatherogenic lipoprotein cholesterol high-density (< 1.03 for men and < 1.2 for women) — in 33.3 % of men and 17.1 % of women, respectively.
Alanine aminotransferase slight increase was observed in 31 (36.0 %) patients with acute pancreatitis, mainly due to biliary oedematous pancreatitis. The average rate of aspartate aminotransferase of the examined patients was almost twice the reference value, especially in men with alcoholic acute pancreatitis. Changes of the de Ritis ratio confirm the cause of acute pancreatitis: increases in rate (> 2) in male patients with alcoholic pancreatitis, which exceeded those in men with biliary pancreatitis by 2.2 times (p = 0.032).
Gamma-glutamyl transpeptidase in 59 (68.6 %) patients exceeded the norm 1.7–2.7 times, a significant difference between groups of observations in men: gamma-glutamyl transpeptidase content in patients with alcoholic acute pancreatitis 2.9 times was higher than in biliary pancreatitis (p = 0.007). In women with biliary acute pancreatitis gamma-glutamyl transpeptidase level was 1.52 times higher than that of the men of this group (p = 0.027).
Nonspecific indicator of systemic inflammatory response of C-reactive protein was higher than the reference data (10 mg/l) ten times in 72 (83.7 %) patients with acute pancreatitis with significantly higher values in patients with biliary form of acute pancreatitis than in alcoholic 2.25 times (p = 0.027).
Conclusions. 1. The course of acute oedematous pancreatitis and exacerbation of chronic pancreatitis is accompanied by dysregulation of lipid metabolism, increased indices of systemic inflammatory response and likely changes in the content of organ enzymes.
2. Patients with acute alcoholic pancreatitis had the reduced detoxification function of the liver with the domination of cytolytic and cholestatic components on background system and intraacinar activated pancreatic enzymes and protease inhibitory, low activity of pancreatic elastase 1. Acute biliary pancreatitis is accompanied by stronger systemic inflammatory response according to the level of C-reactive protein and alpha-1 antitrypsin, significant dyslipidaemic disorders with similar to alcoholic acute pancreatitis background aggressiveness of pancreatic enzymes.
3. Structural changes during alcoholic acute pancreatitis are characterized by a moderate inflammatory reaction of parenchyma, parapancreatic hydrophilicity and the appearance of small cysts. Biliary acute pancreatitis is associated with a greater incidence of acute inflammatory changes in the structure: lower echogenicity and its heterogeneity.
панкреатит, запалення, ферменти, ліпіди, гепатоцити.
панкреатит, воспаление, ферменты, липиды, гепатоциты.
pancreatitis, inflammation, enzymes, lipids, hepatocytes.
Статья опубликована на с. 76-82
Вступ
Гострий панкреатит (ГП) та загострення хронічного панкреатиту (ХП) упродовж останніх 20 років продовжують посідати «почесне» друге місце за частотою у структурі гострої хірургічної патології органів черевної порожнини [1, 3, 8, 13]. У 10,9–15,0 % випадків захворювання підшлункової залози стають причиною первинної інвалідизації хворих із проблемами органів травлення. В Україні захворюваність на ГП становить у середньому 6,7–6,95 на 10 тис. населення. Загальна летальність при цьому захворюванні коливається у країнах Європи від 4,5 до 15 %, при деструктивних формах — 24–60 %, а післяопераційна летальність — близько 70 % (в Україні в середньому — 14,1–14,7 %) [3].
В амбулаторно-поліклінічній та загальнолікарській практиці кожен четвертий пацієнт гастроентеролога чи сімейного лікаря з патологією органів черевної порожнини має ХП. Захворюваність на ХП у країнах Європи та в Україні становить 4–8 випадків, а поширеність — 25 випадків на 100 тис. населення [1, 5–7, 12, 14]. Майже в 30 % хворих на ХП з’являються ранні ускладнення: гнійно-септичні, кровотечі з виразок гастродуоденальної зони, тромбоз у системі портальної вени, стеноз холедоха або дванадцятипалої кишки тощо. Переважно вони стають причиною смерті цих пацієнтів: протягом перших 5 років помирають 6,3 %, 10 років — 30 %, а через 20 років — близько 50 % хворих на ХП [5–7, 9, 15]. За неефективного лікування ХП прогресує функціональна недостатність підшлункової залози, розвивається абдомінальний ішемічний синдром [5–7, 9, 14–16].
Основними патофізіологічними механізмами розвитку гострого панкреатиту є гіпертензія біліарної системи внаслідок набряку сфінктера Одді, рефлекторного спазму сфінктерного апарату вищевказаної системи на фоні больового синдрому, обструкції жовчних шляхів конкрементами, затруднення відтоку та гіперпродукції панкреатичного секрету, протокова гіпертензія, безпосереднє пошкодження ацинарних клітин підшлункової залози та гепатоцитів токсичними субстанціями (у тому числі алкоголем), активація панкреатичних ферментів у протоках та паренхімі, що призводить до автолізу, набряку, некротичних змін, а в подальшому (за рецидивуючого перебігу) — до склерозування й фіброзу залози з розвитком секреторної недостатності [1, 6–9, 12–16]. Завдяки потужним захисним інгібіторним механізмам протидії впливу агресивного панкреатичного секрету патологічний процес може обмежитись набряком без розвитку некрозу [15, 17]. У патогенетичний механізм обмеження патологічного процесу запалення залучається й гепатобіліарна система [7]. Однак не до кінця вивченими залишаються питання дезінтеграції функціонування та структурних змін підшлункової залози й гепатоцитів за ГП чи загострення ХП з урахуванням розвитку синдрому системної запальної відповіді, з метою попередження можливих ускладнень, проведення вторинної профілактики та корекції лікування, що потребують подальших досліджень.
Мета — дослідити системні взаємозв’язки показників функціонального стану підшлункової залози й печінки, обміну ліпідів та індикаторів системної запальної відповіді з урахуванням етіологічного чинника та статі у хворих на ГП та загострення ХП.
Матеріал та методи
У проспективному одномоментному скринінговому дослідженні взяли участь 95 осіб, які були госпіталізовані до лікарні швидкої медичної допомоги м. Чернівців (із жовтня 2012 р. по жовтень 2013 р.) із приводу ГП чи загострення ХП. Відбір пацієнтів та розподіл по групах за походженням ГП (біліарний, алкогольний), черговістю виникнення (ГП уперше, загострення ХП), тяжкістю ураження (набряковий, деструктивний) здійснювали відповідно до чинних вітчизняних наказів МОЗ України [3, 5] та рекомендацій європейських товариств із діагностики та лікування гострих та хронічних панкреатитів [8, 9, 12, 14, 16]. Діагноз ГП чи загострення ХП встановлювали на підставі Наказу МОЗ України від 02.04.2010 № 297 [3] з урахуванням анамнезу захворювання, провокуючих факторів, оцінки об’єктивного стану за наявністю основних симптомів, даних лабораторної (загальноклінічні і біохімічні аналізи, діастаза сечі, амілаза і глюкоза крові, коагулограма, креатинін крові, ферменти підшлункової залози і печінки) та інструментальної діагностики (сонографія органів черевної порожнини, за потреби — рентгенологічного дослідження шлунково-кишкового тракту, комп’ютерна томографія підшлункової залози). У дослідження не включали хворих на деструктивні форми ГП, на суб-/некомпенсований цукровий діабет (ЦД) 2-го типу, ЦД 1-го типу, хворих на автоімунні гепатити, вірусні гепатити, цирози печінки, неалкогольну жирову хворобу печінки, наявність виразок у будь-якому відділі шлунково-кишкового тракту, гострі порушення локального кровообігу (гострий коронарний синдром, мозкові інсульти) менше ніж 3 місяці до цього, загострення ішемічної хвороби серця, бронхіальну астму, хронічне обструктивне захворювання легень ІІІ–ІV стадії (GOLD 2011, Наказ МОЗ України № 555 від 27.06.2013), муковісцидоз, онкологічні, інфекційні та захворювання системні сполучної тканини в період загострення чи нестійкої ремісії, кістково-суглобової сфери з явищами деструкції, психічні розлади.
Етап скринінгу пройшли 86 хворих, які підписали інформовану згоду пацієнта на участь у дослідженні з наступним проведенням комплексу клінічно-лабораторно-діагностичних обстежень. Серед обстежених були 35 (40,7 %) жінок, 51 (59,3 %) чоловік. Вік пацієнтів — від 23 до 77 років (у середньому 44,60 ± 5,25 року для чоловіків, 52,70 ± 7,24 року для жінок). Усі хворі мали набрякову форму панкреатиту: первинний ГП встановили у 45 (52,3 %) осіб, загострення ХП — у 41 (47,7 %) пацієнта.
Функцію печінки вивчали за активністю ферментів аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), гаммаглутамілтранспептидази (ГГТП), лактатдегідрогенази (ЛДГ), лужної фосфатази (ЛФ), загальним білірубіном та його фракціями, тимоловою пробою. За відношенням АСТ до АЛТ (АСТ/АЛТ) розраховували коефіцієнт де Рітіса як один із додаткових портальних чинників панкреатичної агресії за рівня АСТ і АЛТ більше 1 ммоль/л або АСТ/АЛТ менше 1,0 чи вище 2,0 [3]. Визначали також активність показника деструкції тканини підшлункової залози — панкреатичну еластазу-1, активність альфа-1-антитрипсину та рівень трипсину сироватки високочутливим (109–1010г) імуноферментним методом із використанням реактивів фірми Thermo Fisher Scientific (Фінляндія). С-реактивний протеїн (СРП) визначали методом фотометричного аналізу (KONELAB 20i) із набором реактивів Thermo Fisher Scientific (Фінляндія).
Дослідження ліпідів сироватки включало визначення загального холестеролу (ЗХС), тригліцеридів (тріацилгліцеролів, ТГ) та ХС ліпопротеїдів високої і низької щільності (ХС ЛПВЩ, ХС ЛПНЩ) із використанням реактивів фірми Thermo Fisher Scientific (Фінляндія) проводили на аналізаторі біохімічному KONELAB 20i (Thermo Fisher Scientific, Фінляндія) методом фотометричного аналізу. Індекс атерогенності (ІА) вираховували за формулою А.Н. Клімова: ІА = (ЗХС – ХС ЛПВЩ)/ХС ЛПВЩ. За нормальні вважали: ІА < 3,0; ЗХС < 5,0 ммоль/л, ХС ЛПНГ < 3,0 ммоль/л, ХС ЛПВГ у чоловіків > 1,03 ммоль/л, у жінок > 1,2 ммоль/л, ТГ < 1,7 ммоль/л [2, 10].
Статистичну обробку виконували за допомогою прикладних програм MS® Excel® 2003™, MYSTAT 12 (Systat Software Inc., США) і Scout 2008 Version 1.00.01 (U.S.Environmental Protection Agency, США). Вірогідність даних для незалежних вибірок розраховували за t-критерієм Student (при розподілі масивів близькими до нормальних) чи U-критерієм Wilcoxon — Mann — Whitney (при нерівномірному розподілі). Аналіз якісних ознак — за критерієм c2. Різницю вважали вірогідною при р < 0,05.
Результати та обговорення
За даними ультразвукового дослідження (УЗД) підшлункової залози у переважної більшості хворих на набряковий ГП (n = 45) чи загострення ХП (n = 41) спостерігали збільшення розмірів голівки і/чи тіла та/чи хвостової ділянки (80,2 %), неоднорідність структури (72,1 %), майже в кожного третього ехогенність була нерівномірно знижена (34,9 %) чи підвищена (30,2 %), у решти — неоднорідні ділянки змішаної ехогенності (24,4 %); у 15,1 % осіб виявили розширення вірсунгової протоки, в окремих пацієнтів у паренхімі залози встановили сформовані прості кісти чи на стадії формування (8,1 %), у 4,7 % осіб у черевній порожнині верифікували вільну рідину, в одного хворого (1,2 %) спостерігали дрібні конкременти у просвіті вірсунгової протоки чи дрібні дуктулярні структури паренхіми.
Структурні зміни підшлункової залози у хворих на ГП чи загострення ХП залежно від етіологічного чинника наведені в таблиці 1. Неоднорідність структури підшлункової залози спостерігали в 1,78 раза частіше за біліарного панкреатиту (відношення шансів (ВШ) = 4,89, 95% довірчий інтервал (ДІ) = 1,31–18,3, р = 0,015). Натомість парапанкреатичну гідрофільність в 1,94 раза частіше виявляли за ГП алкогольного походження (ВШ = 3,95, 95% ДІ = 1,14–13,7, р = 0,027). У хворих на ГП алкогольного генезу ультрасонографічно діагностували прості кісти, чого не спостерігали в пацієнтів із ГП біліарного походження. За рештою УЗД-показників суттєвих відмінностей не встановили (табл. 1).
Таким чином, діагностично значимими ознаками структурних змін підшлункової залози у хворих на ГП є набрякова неоднорідність паренхіми і парапанкреатична гідрофільність як прояви гострозапальної реакції та поява простих кіст, що свідчить про тривале порушення секреторної та моторної функції панкреатичного дуктулярного апарату.
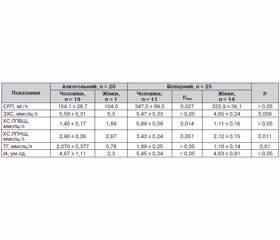
Рівень ліпідів та С-реактивного протеїну в сироватці хворих на гострий набряковий панкреатит наведено в таблиці 2. У переважної частини обстежених спостерігали клінічно й лабораторно значиму дисліпідемію: уміст ЗХС перевищував нормальні показники (> 5 ммоль/л) у 64,7 % чоловіків та в 17,1 % жінок, ХС ЛПНЩ (> 3 ммоль/л) — у 51,0 і 17,1 % відповідно, ТГ (> 1,7 ммоль/л) — у 56,9 і 17,1 %, ІА (> 3,0 ум.од.) — у 49,0 і 34,3 %, при низькому рівні антиатерогенного ХС ЛПВЩ (< 1,03 для чоловіків і < 1,2 для жінок) — у 33,3 % чоловіків і 17,1 % жінок відповідно. При цьому залежно від етіологічного чинника ГП чи загострення ХП вірогідної різниці в чоловіків за рівнем ЗХС, ТГ і розрахункового ІА не встановили. Уміст ХС ЛПВЩ у чоловіків із біліарним ГП на 36,4 % нижчий, ніж у таких з алкогольним ГП (р = 0,014), а ХС ЛПНЩ вищий на 18,3 % (р = 0,051). У жінок, хворих на біліарний ГП, рівні ХС ЛПНЩ та ТГ нижчі, ніж у чоловіків даної групи, на 38,2 % (р = 0,011) і 41,8 % (р = 0,01) відповідно (табл. 2). Неспецифічний показник системної запальної відповіді СРП перевищував референтні дані (10 мг/л) у десятки разів у 72 (83,7 %) хворих на ГП із вірогідно більшим значенням у пацієнтів із біліарною формою ГП, ніж алкогольною, у 2,25 раза (р = 0,027) (табл. 2).
Патогенетичні зміни функціонального стану печінки у хворих на ГП підтверджувалися відхиленнями маркерів цитолізу гепатоцитів: трансаміназ, коефіцієнта де Рітіса, ЛДГ; печінкового холестазу за рівнем ГГТП та ЛФ як мембранозв’язаного ферменту з відсутністю органної специфічності (суміш печінкових та кісткових ізоферментів). Активність органоспецифічних ферментів у сироватці крові хворих на гострий набряковий панкреатит залежно від етіологічного чинника наведено в таблиці 3. Установили незначне зростання АЛТ у 31 (36,0 %) пацієнта із ГП, переважно за рахунок біліарного набрякового панкреатиту. Середній показник АСТ в обстеженій популяції майже вдвічі перевищував референтні значення, особливо у чоловіків з алкогольним ГП, однак без статистично значимої різниці із хворими на біліарний ГП незалежно від статі (р > 0,05). Зміни коефіцієнта де Рітіса підтверджували природу ГП: вагоме зростання показника (> 2) у чоловіків, хворих на алкогольний ГП, що перевищувало аналогічний у чоловіків із біліарним ГП у 2,2 раза (р = 0,032).
ЛДГ належить до найважливіших клітинних ферментів, що бере участь у процесі гліколізу й каталізує зворотну реакцію відновлення піровиноградної кислоти в молочну, є універсальним ферментом тканинного дихання. Різке підвищення ЛДГ може слугувати предиктором некрозу гепатоцитів. ЛДГ перевищував норму у 21 (24,4 %) особи із ГП переважно алкогольного генезу. При цьому середні значення ЛДГ коливались у межах нормальних величин, без вірогідних відхилень за статтю та етіологічним чинником ГП (р > 0,05) (табл. 3).
Ранній специфічний показник внутрішньопечінкового холестазу ГГТП у 59 (68,6 %) хворих перевищував норму в 1,7–2,7 раза з вірогідною різницею між групами спостереження в чоловіків: уміст ГГТП у хворих на алкогольний ГП у 2,9 раза був вищим, ніж за біліарного ГП (р = 0,007). У жінок із біліарним ГП рівень ГГТП в 1,52 раза перевищував такий у чоловіків даної групи (р = 0,027). Гіпербілірубінемію (у межах 25–30 ммоль/л) встановили в 11 (12,8 %) осіб, у решти пацієнтів білірубін зберігався в межах норми.
У хворих на ГП рівень трипсину перевищував верхній поріг норми у 3,4–6,5 раза (табл. 3), засвідчуючи можливість інтрапанкреатичного автокаталітичного процесу з невірогідною перевагою активності у хворих на біліарний ГП. У відповідь на агресію трипсину компенсаторно зростає синтез печінкою альфа-1-антитрипсину як активатора гострої фази запалення та інгібітору протеолітичних ферментів (трипсину, хімотрипсину, еластази, калікреїну, катепсинів та інших ферментів тканинних протеаз). У 53,3 % пацієнтів рівень альфа-1-антитрипсину перевищував верхню межу норми в середньому на 10,7 %, без вагомої міжгрупової різниці (табл. 3).
У період гострофазових запальних змін за ГП оксидативний стрес здатен надати захворюванню системного характеру з утворенням активних метаболітів кисню, що зумовлюють пошкодження біомолекул. У ділянці ушкодження активація макрофагів і моноцитів призводить до вивільнення прозапальних цитокінів, останні локально підвищують проникність судин, стимулюють ендотеліальну адгезію, активацію й міграцію нейтрофілів [11, 17]. Нейтрофіли вивільняють агресивні гідролітичні ферменти, що діють на всі структурні елементи поверхні клітин та екстрацелюлярного матриксу, серед яких протеолітичні — еластаза, катепсин G — найбільш здатні до деструкції тканин [4]. В обстежених нами пацієнтів рівень панкреатичної еластази-1 у жодному випадку не перевищував нормальних показників (табл. 3), засвідчуючи опосередковано відсутність деструкції паренхіми підшлункової залози та достатньо високий компенсаторний рівень інгібітору протеаз альфа-1-антитрипсину як важливого регулятора активності еластаз різного походження [4, 7]. Суттєвих міжгрупових відмінностей рівнів панкреатичної еластази-1, у т.ч. залежно від статі, не встановили (р > 0,05).
У ряді досліджень встановлено, що потужний оксидативний стрес із вивільненням нейтрофілами та тромбоцитами аніону О2– та інших вільних супероксидрадикалів ініціює перекисне окиснення ліпідів (ПОЛ) та окиснювальну модифікацію білків (ОМБ) у реакціях респіраторного вибуху із пошкодженням клітин переважно шляхом апоптозу [1, 6, 7, 17]. Підвищена активність ПОЛ і ОМБ призводить до збільшення кількості модифікованих ЛПНЩ, що є фактором перетворення макрофагів в тучні клітини, що ми й отримали в переважної більшості наших хворих на ГП в основному біліарного походження. Інтенсифікація вільнорадикального окислення ліпідів підтримує локальний запальний процес, сприяє порушенню мікроциркуляції та обмінних процесів у підшлунковій залозі, пригніченню тканинного дихання, що, у свою чергу, призводить до дегенерації ацинарних клітин та їх апоптозу. Окрім того, модифіковані ЛПНЩ є хемоатрактантами для гранулоцитів і моноцитів, сприяють їх активації і провокують підвищення концентрації протеїназ і кисневих радикалів, причетних до ушкодження стінки судин [2, 4, 7, 11, 15]. Тому зниження активності панкреатичної еластази-1 у наших хворих асоціює з відсутністю парапанкреатичного ексудату в більшості пацієнтів, натомість у 21 (46,7 %) хворого наявною була сонографічно підтверджена парапанкреатична гідрофільність.
Таким чином, гострозапальний процес у підшлунковій залозі характеризується не тільки змінами структури, а й системними компенсаторними порушеннями функціонування ацинарних клітин залози та гепатоцитів, змін ліпідного профілю в напрямку модифікації ХС ЛПНЩ із наступним підвищенням кількості та активності інгібіторних протеїназ, що безумовно має залежність від етіологічного чинника.
Висновки
1. Перебіг гострого набрякового панкреатиту та загострення хронічного панкреатиту супроводжуються дисрегуляцією ліпідного обміну, підвищенням показників системної запальної відповіді та вірогідними змінами вмісту органоспецифічних ферментів.
2. У хворих на гострий алкогольний панкреатит зменшується дезінтоксикаційна функція печінки із переважанням цитолітичного (вагоме зростання АСТ, коефіцієнту де Рітіса) та холестатичного (збільшення ГГТП) компонентів на фоні системної та внутрішньоацинарної активації панкреатичних ензимів та інгібіторних протеаз, низької активності панкреатичної еластази-1. Гострий біліарний панкреатит супроводжується сильнішою системною запальною реакцією за рівнем СРП (р = 0,027) та альфа-1-антитрипсину, суттєвими дисліпідемічними розладами (зменшенням ХС ЛПВЩ, зростанням ХС ЛПНЩ) із аналогічною алкогольному ГП фоновою агресивністю панкреатичних ферментів.
3. Структурні зміни алкогольного гострого панкреатиту характеризуються помірно вираженою запальною реакцією паренхіми, парапанкреатичною гідрофільністю (ВШ = 3,95, 95%ДІ = 1,14–13,7) та появою дрібних кіст. Біліарний гострий панкреатит асоціює з більшою частотою гострозапальних змін структури: зниженням ехогенності та її неоднорідністю (ВШ = 4,89, 95 % ДІ = 1,31–18,3).
Перспективи подальших досліджень. Установлення можливих генетичних механізмів формування гострого панкреатиту з урахуванням етіологічного чинника, статі, змін зовнішньосекреторної активності підшлункової залози.
1. Бабінець Л.С. Хронічний панкреатит: діагностика і лікування, алгоритми динамічного спостереження лікарем загальної практики — сімейної медицини на засадах доказової медицини / Л.С. Бабінець // Здоров’я України. — 2012. — № 1 (23). — С. 61–63.
2. Дисліпідемії: діагностика, профілактика та лікування. Методичні рекомендації Асоціації кардіологів України 2011 р. / Робоча група з проблем метаболічного синдрому, діабету та серцево-судинних захворювань Асоціації кардіологів України: О.І. Мітченко, М.І. Лутай, Є.П. Свіщенко [та ін.] // Новости медицины и фармации. — 2011. — № 19 (391). — С. 11–15.
3. Наказ МОЗ України від 02.04.2010 № 297 «Про затвердження стандартів та клінічних протоколів надання медичної допомоги зі спеціальності «Хірургія» / МОЗ. — К.: МОЗ, 2010. — Режим доступу: http://www.moz.gov.ua/ua/portal/dn_20100402_297.html
4. Пат. № 72346 Україна. Набір для визначення еластазоінгібіторної активності α-1 інгібітору протеїназ в біологічних рідинах / Самохіна Л. М. // Офіційний бюлетень «Промислова власність». — 2005. — № 2. Укрпатент. — Опубл. 15. 02. 2005 р. — 6 с.
5. Проект наказу МОЗ України «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при хронічному панкреатиті». Хронічний панкреатит. Адаптована клінічна настанова, заснована на доказах / Робоча група МОЗ України М.К. Хобзей, Н.В. Харченко, О.М. Ліщишина [та ін.] // МОЗ. — К.: МОЗ, 2013. — Режим доступу: http://www.moz.gov.ua/ua/print/dn_20130903_0.html
6. Христич Т.Н. Хронический панкреатит: нерешенные проблемы / Т.Н. Христич, В.П. Пишак, Т.Б. Кендзерская. — Черновцы: Медуниверситет, 2006. — С. 69–84, 158–161.
7. Христич Т.М. Хронічний панкреатит: що в імені твоєму? (збірник основних статей 2003–2013 рр.) / За ред. Шестакової К.Г., Кузик Ф.В., Телекі Я.М. — Чернівці, 2013. — 320 с.
8. Diagnosis and treatment of acute pancreatitis: the position statement of the Italian Association for the study of the pancreas / R. Pezzilli, G. Uomo, A. Zerbi [et al. on behalf of Italian Association for the Study of the Pancreas Study Group] // Dig. Liver Dis. — 2008. — Vol. 40(10). — P. 803–808.
9. Exocrine pancreatic insufficiency in adults: a shared position statement of the Italian association for the study of the pancreas. / R. Pezzilli, A. Andriulli, C. Bassi [et al.] // World J. Gastroenterol. — 2013. — Vol. 19(44). — P. 7930–46.
10. Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) / Expert Panel on Detection, Evaluation and Treatment Blood Cholesterol in Adults (Adult Treatment Panel III) final report // Circulation. — 2002. — Vol. 106, № 25. — P. 3143–3421.
11. Hubbard A.K. Intercellular adhesion molecule1 (ICAM1) expression and cell signaling cascades / A.K. Hubbard, R. Rothlein // Free Radic. Biol. Med. — 2000. — Vol. 28, № 9. — P. 1379–1386.
12. Italian consensus guidelines for chronic pancreatitis / L. Frulloni, M. Falconi, A. Gabbrielli [et al.] // Dig. Liver Dis. — 2010. — Vol. 42, Suppl. 6. — P. 381–406.
13. Lindkvist B. Diagnosis and treatment of pancreatic exocrine insufficiency / B. Lindkvist // World J. Gastroenterol. — 2013. — Vol. 19 (42). — P. 7258–66.
14. Management of pancreatic exocrine insufficiency: Australasian Pancreatic Club recommendations / J. Toouli, A.V. Biankin, M.R. Oliver [et al.] // Med. J. Aust. — 2010. — Vol. 19 (3). — P. 461–467.
15. Pancreatic enzymes for chronic pancreatitis / N. Shafiq, S. Rana, D. Bhasin [et al.] // Cochrane Database Syst. Rev. — 2009. — CD006302.
16. S3–Leitlinie Chronische Pankreatitis: Definition, Ätiologie, Diagnostik, konservative, interventionell endoskopische und operative Therapie der chronischen Pankreatitis / A. Hoffmeister, J. Mayerle, C. Beglinger [et al. Leitlinie der Deutschen Gesellschaft für Verdauungs– und Stoffwechselkrankheiten (DGVS)] // Z. Gastroenterol. — 2012. — Vol. 50. — S. 1176–1224.
17. Vaday G.G. Extracellular matrix moieties, cytokines, and enzymes: dynamic effects on immune cell behavior and inflammation / G.G. Vaday, O. Lider // J. Leukoc. Biol. — 2000. — Vol. 67, № 2. — P. 149–159.

/78/78.jpg)
/79/79.jpg)
/79/79_2.jpg)