Журнал «» 4 (30) 2013
Вернуться к номеру
Ефективність метаболічної корекції гіпергомоцистеїнемії при гіпертонічній хворобі
Авторы: Яковлєва О.О., Кириченко О.В. - Вінницький національний медичний університет ім. М.І. Пирогова
Рубрики: Кардиология, Терапия
Разделы: Клинические исследования
Версия для печати
Відомо, що гомоцистеїн — ранжований незалежний фактор ризику серцево-судинних ускладнень. Метою дослідження є оптимізація лікування пацієнтів із гіпертонічною хворобою (ГХ) шляхом контролю гіпергомоцистеїнемії додатковим призначенням перорального В-вітамінного комплексу та 1 мг фолієвої кислоти. Матеріал і методи. У дослідження було включено 80 пацієнтів із ГХ І–ІІІ стадій віком 58,29 ± 0,84 року. Пацієнти були рандомізовані на клінічні групи. Хворі групи А (n = 34) отримували терапію на тлі призначення блокаторів рецепторів ангіотензину ІІ типу та діуретичний засіб за потребою. Пацієнтам групи В (n = 46) на тлі базової терапії додатково призначили гомоцистеїн-знижуючу комбінацію. Термін спостереження — три місяці. Контрольну групу становили 34 практично здорові особи. Рівень загального гомоцистеїну визначали імуноферментним методом набором Homocysteine EIA до та після лікування. Результати. Рівень гомоцистеїну в групі А достовірно не змінився (14,60 ± 1,09 мкмоль/л проти 13,60 ± 0,89 мкмоль/л при р > 0,05) і перевищував дані групи контролю (9,20 ± 0,56). У групі В відбулась редукція зазначеного маркера на 22,7 % (р < 0,0001). Висновки. У пацієнтів із ГХ спостерігається елевація гомоцистеїну в порівнянні з практично здоровими особами
(р < 0,0001). Гіпотензивна терапія не впливає на концентрацію гомоцистеїну. Включення у гіпотензивну терапію вітамінної комбінації та 1 мг фолієвої кислоти сприяє достовірному зниженню рівня гомоцистеїну в порівнянні з базовим (р < 0,0001).
Известно, что гомоцистеин — ранжированный независимый фактор риска сердечно-сосудистых осложнений. Целью исследования является оптимизация лечения пациентов с гипертонической болезнью (ГБ) путем контроля гипергомоцистеинемии дополнительным назначениемя перорального В-витаминного комплекса и 1 мг фолиевой кислоты. Материал и методы. В исследование были включены 80 пациентов I–III стадий в возрасте 58,29 ± 0,84 года. Пациенты рандомизированы на клинические группы. Больные группы А (n = 34) получали терапию на фоне применения блокаторов рецепторов ангиотензина II типа и диуретическое средство при необходимости. Пациентам группы В (n = 46) на фоне базовой терапии дополнительно назначили гомоцистеин-снижающую комбинацию. Срок наблюдения — три месяца. Контрольную группу составили 34 практически здоровых человека. Уровень общего гомоцистеина определяли иммуноферментным методом при помощи набора Homocysteine EIA до и после лечения. Результаты. Уровень гомоцистеина в группе А достоверно не изменился (14,60 ± 1,09 мкмоль/л против 13,60 ± 0,89 мкмоль/л при р > 0,05) и превышал данные группы контроля (9,20 ± 0,56 мкмоль/л). В группе В произошла редукция указанного маркера на 22,7 % (р < 0,0001). Выводы. У пациентов с ГБ наблюдается элевация гомоцистеина по сравнению с практически здоровыми лицами (р < 0,0001). Гипотензивная терапия не влияет на концентрацию гомоцистеина. Включение в базовое лечение витаминной комбинации и 1 мг фолиевой кислоты способствует достоверному снижению уровня гомоцистеина по сравнению с базовым (р < 0,0001).
Homocysteine is considered as an independent ranked risk factor of cardiovascular complications. The objective of the study is to optimize therapy of hypertensive patients by additional oral administration of vitamin B complex and 1 mg of folic acid. Material and Methods. The study included 80 patients suffered from essential hypertension stage I–III, aged 58.29 ± 0.84 years. Patients were randomized to clinical groups. Patients of group A (n = 34) received treatment on the background of administration of angiotensin II receptor blocker and diuretic when necessary. Patients of group B
(n = 46) on the background of basic therapy were additionally administered homocysteine-lowering combination. Follow-up was three months. The control group consisted of 34 apparently healthy individuals. The level of total homocysteine was determined by immunoenzyme technique using Homocysteine EIA kit before and after treatment. Results. The level of homocysteine in group A did not change significantly (14.60 ± 1.09 mmol/l vs 13.60 ± 0.89 mmol/l; p > 0.05) and was higher than in the control group
(9.20 ± 0.56 mmol/l). In the group B it was observed homocysteine lowering by 22.7 % (p < 0.0001). Conclusions. In hypertensive patients we observed homocysteine elevation compared to apparently healthy individuals (p < 0.0001). Antihypertensive therapy does not affect the homocysteine concentration. Addition to antihypertensive therapy of vitamin complex and 1 mg of folic acid promotes significant reduction of homocysteine level in comparison with baseline (p < 0.0001).
гіпертонічна хвороба, гіпергомоцистеїнемія, гомоцистеїн, нейрорубін-форте лактаб, фолієва кислота.
гипертоническая болезнь, гипергомоцистеинемия, гомоцистеин, нейрорубин-форте лактаб, фолиевая кислота.
hypertension, hyperhomocysteinemia, homocysteine, neurorubine-forte lactab, folic acid.
Гомоцистеїн (Гц) є ранжованим незалежним фактором ризику серцево-судинних ускладнень — інфаркту міокарда, інсульту, венозної тромбоемболії, атеросклерозу [7, 9, 11]. Гіпергомоцистеїнемію (ГГц) вважають вагомим предиктором смертності людей із серцево-судинними захворюваннями або іншими факторами ризику [1, 15].
На думку дослідників, ГГц супроводжується пошкодженням ендотелію судин за рахунок утворення перекису водню в реакціях, каталізованих Гц. На рівні артеріальної стінки гомоцистеїн призводить до посилення синтезу ДНК у гладком’язових клітинах, викликаючи їх проліферацію, ймовірно, через активність метаболіту, гомоцистеїнової кислоти. Гц також підвищує вміст глікозаміногліканів в артеріальній інтимі, що призводить до зниження проникності й посилення агрегації позаклітинного матриксу, зв’язування ліпопротеїдів низької щільності і підсилення кальцифікації [2, 12]. Високий рівень Гц може сприяти формуванню аномальних кровоносних судин, які є більш чутливими до пошкоджень. Кінцевий результат впливу Гц на ендотелій є формування атеросклеротичних бляшок. ГГц, за даними досліджень, призводить до пошкодження артерій малого калібру [6].
За хімічною будовою Гц є природною сірковмісною амінокислотою, що є продуктом деметилювання метіоніну, однією з восьми незамінних амінокислот організму. Не будучи структурним елементом білків, гомоцистеїн з їжею в організм не потрапляє. У плазмі крові вільний (відновлений) Гц є у невеликій кількості (1–2 %). Приблизно 20 % його знаходиться в окисленому стані. Метаболізм Гц проходить за участі ряду ферментів, основними серед яких є 5,10-метилентетрагідрофолатредуктаза та цистатіон-b-синтетаза. Кофакторами в цих процесах виступають вітаміни, передусім піридоксин (вітамін В6), ціанокобаламін (вітамін В12) та фолієва кислота (вітамін В9) [1, 13].
Мета дослідження: оптимізація лікування пацієнтів із гіпертонічною хворобою (ГХ) шляхом контролю гіпергомоцистеїнемії під час комплексної терапії додатковим пероральним призначенням В-вітамінної комбінації та фолієвої кислоти.
Матеріал і методи
Відкрите проспективне рандомізоване клінічне спостереження було проведено на базі кардіологічної клініки ВМКЦ ЦР м. Вінниці протягом 2010–2012 рр. У дослідження були включені пацієнти з ГХ І–ІІІ стадій віком 40–65 років. Підписана інформована згода була отримана в усіх пацієнтів. Верифікація діагнозу ГХ проводилась згідно з рекомендаціями Української асоціації кардіологів (2008) та ESH (2009) [10]. Критеріями виключення з дослідження були вторинні гіпертензії, психічні захворювання, тяжка соматична патологія, гостра та підгостра фаза порушення мозкового кровообігу, серцева недостатність ІІБ стадії, захворювання системи крові, тяжкий цукровий діабет, онкологічні захворювання, білатеральний стеноз ниркових артерій, ревматичні вади серця, а також вагітність та лактація.
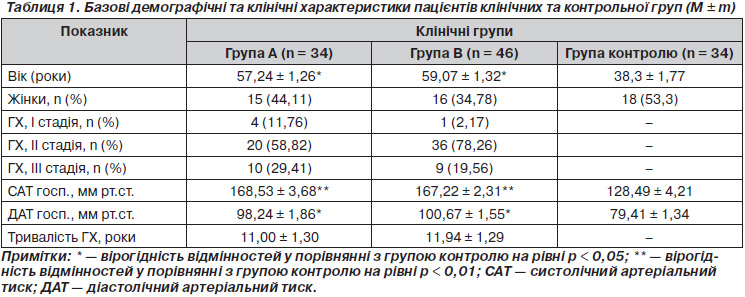
У цілому в дослідження було включено 88 пацієнтів із ГХ І–ІІІ стадій. Зважаючи на те, що 8 пацієнтів було втрачено, при проведенні кінцевого аналізу були використані дані 80 осіб віком 58,29 ± 0,84 року. Простим методом пацієнти були рандомізовані на дві клінічні групи залежно від характеру фармакотерапії. Сформовані клінічні групи були репрезентативними за віком, статтю та базовими клінічними характеристиками (табл. 1). У клінічну групу А було включено 34 пацієнти, які отримували гіпотензивну терапію на тлі прийому блокаторів рецепторів ангіотензину ІІ типу та діуретичний засіб за потребою. Пацієнтам, рандомізованим у клінічну групу В (n = 46), на тлі антигіпертензивної терапії додатково була призначена пероральна Гц-знижуюча комбінація: 1 таблетка вітамінного комплексу, що містить 200 мг тіаміну мононітрату (вітамін В1), 50 мг піридоксину гідрохлориду (вітамін В6), 1 мг ціанокобаламіну (вітамін В12) та 1 мг фолієвої кислоти (вітамін В9). Вітамінний комплекс був обраний тому, що, згідно з результатами досліджень, містить дози вітамінів, достатні для адекватної корекції ГГц [5]. Для досягнення кращої комплайєнтності пацієнтів перевага була надана таблетованій формі у зв’язку з тривалістю лікування. Що стосується підбору дози фолієвої кислоти, то була використана доза 1 мг/добу. Мегадози фолієвої кислоти (5 мг) не призначались, оскільки питання щодо індукції канцерогенезу вітаміном В9 залишається дискусійним [3]. Згідно з протоколом дослідження, термін спостереження становив три місяці.
До контрольної групи увійшли 34 практично здорові особи з нормальним рівнем АТ, серед яких було 18 (53,3 %) жінок і 16 (46,7 %) чоловіків віком від 25 до 52 років (середній вік 38,30 ± 1,77 року).
Протокол дослідження включав визначення базового Гц та його динаміку через 3 місяці фармакотерапії. Забір крові здійснювався в стандартних умовах — з 8-ї до 9-ї години, натще, після нічного голодування, з ліктьової вени за допомогою вакутейнерів у пробірки Vacuette (Greiner Bio-One, Австрія) без антикоагулянтів. Сироватку отримували центрифугуванням крові при 1500 об/хв протягом 15 хв при 18–22 оС. Для біохімічних та імуноферментних досліджень аліквоти сироватки відбирали в мікропробірки Ерpendorf і до проведення досліджень зберігали при температурі –20 оС.
Рівень загального гомоцистеїну в плазмі крові хворих та осіб контрольної групи визначали імуноферментним методом при використанні набору Homocysteine EIA (Axis-Shield, Великобританія) на аналізаторі STAT FAX 303/PLUS. Для аналізу плазмових концентрацій Гц у пацієнтів клінічних груп із різними стадіями ГХ та групи контролю були використані рекомендації D.W. Jacobsen: 10–15 мкмоль/л — субнормальний рівень; 15–25 мкмоль/л — легка ГГц; 25–50 мкмоль/л — середня ГГц; понад 50 мкмоль/л — тяжка [8].
Математичну обробку отриманих даних проводили за допомогою стандартних методів варіаційного аналізу із застосуванням пакета програм SPSS 17.0 (SPSS Inc, Chicago, США). Результати подані у вигляді «середнє значення (М) ± похибка (m)». Для оцінки міжгрупової різниці застосовували параметричний t-критерій Стьюдента. Вірогідність відмінностей у групах була прийнята при рівні статистичної значущості p < 0,05.
Результат та обговорення
Біохімічне визначення рівня Гц плазми у пацієнтів клінічних груп характеризується елевацією в порівнянні з практично здоровими особами (р < 0,001). При цьому базовий рівень Гц крові пацієнтів обох клінічних груп знаходиться в межах субнормальних цифр (рис. 1). Розподіл показників Гц залежно від статі не продемонстрував достовірних внутрішньо- та міжгрупових відмінностей (р > 0,05).
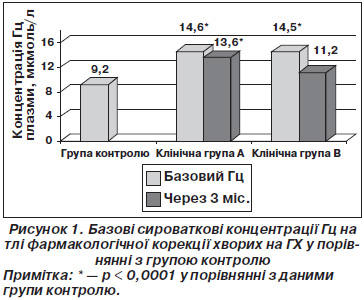
Коливання рівнів Гц у осіб контрольної групи відбувалось у межах від 5,3 до 20,1 мкмоль/л і в середньому Гц крові був 9,20 ± 0,56 мкмоль/л, без достовірних гендерних відмінностей (р > 0,05). Рівень Гц плазми чоловіків групи контролю (n = 18) становив у середньому 9,13 ± 0,53 мкмоль/л і відповідав нормі. Середній рівень Гц практично здорових жінок дорівнював 9,27 ± 0,60 мкмоль/л і також розцінювався як нормальний.
Базові показники Гц у клінічних групах А та В становили 14,60 ± 1,09 мкмоль/л та 14,50 ± 0,93 мкмоль/л відповідно без достовірної міжгрупової різниці (р > 0,05). Тримісячна гіпотензивна терапія не вплинула на досліджуваний маркер ендотеліальної дисфункції. Плазмова концентрація Гц у клінічній групі В на тлі тримісячної базової гіпотензивної терапії становила 13,60 ± 0,89 мкмоль/л і не зазнала суттєвих змін (р > 0,05). Додаткова метаболічна корекція зазначеною фармакотерапевтичною комбінацією, використана в клінічній групі В, спричинила редукцію рівнів Гц на 22,7 % (р < 0,05). Порівняння отриманої через 3 місяці фармакотерапії концентрації Гц плазми в клінічній групі В (11,20 ± 0,56 мкмоль/л) демонструє відсутність достовірної різниці з групою контролю, хоча при цьому зазначений показник знаходиться в межах субнормальних варіантів.
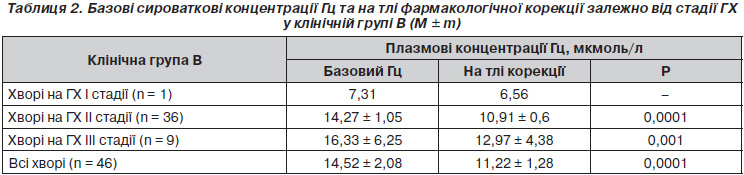
Для більш детального аналізу пацієнти клінічної групи В були розподілені залежно від стадії основного захворювання (табл. 2). Порівняння базових показників Гц демонструє його зростання у міру прогресування ГХ. У хворих на ГХ ІІ стадії відбулась редукція рівня Гц на 28,45 % (р < 0,0001). Включення в антигіпертензивну терапію додаткової вітамінної комбінації сприяло зниженню концентрації Гц плазми на 3,36 ± 0,32 мкмоль/л у хворих на ГХ ІІІ стадії.
Таким чином, рівень Гц плазми слід розглядати як додатковий фактор стратифікації ризику у пацієнтів із ГХ. Зростання його концентрації з перебігом основного захворювання може свідчити про прогресування ендотеліальної дисфункції. Важливість оцінки дослідженого предиктора полягає у його схильності до терапевтичної корекції.
Висновки
1. У пацієнтів із ГХ спостерігається елевація Гц у порівнянні з практично здоровими особами (р < 0,0001).
2. Плазмові концентрації Гц не зазнали суттєвих змін на тлі антигіпертензивної фармакотерапії блокатором ангіотензинових рецепторів ІІ типу (р > 0,05).
3. Включення у базову гіпотензивну фармакотерапію В-вітамінного комплексу сприяє достовірному зниженню рівня Гц на 22,7 % у порівнянні з базовим (р < 0,0001).
Отже, перспективою для подальших розробок може бути оцінка ефективності та безпеки більш тривалої метаболічної Гц-знижуючої терапії.
1. Гомоцистеин — предиктор патологических изменений в организме человека / И.И. Мирошниченко, С.Н. Птицына, Н.Н. Кузнецова [и др.] // Русский медицинский журнал. — 2009. — Т. 17, № 4. — С. 224-228.
2. Adverse vascular effects of homocysteine are modulated by endothelium derived relaxing factors and relayed oxides of nitrogen / J. Stamler, J. Jsborne, O. Jaraki [et al.] // Journal of Clinical Investigation. — 1993. — Vol. 91, № 1. — P. 308-318.
3. A temporal association between folic acid fortification and an increase in colorectal cancer rates may be illuminating important biological principles: a hypothesis / J.B. Mason, A. Dickstein, P.F. Jacques [et al.] // Cancer Epidemiology, Biomarkers & Prevention Online. — 2007. — Vol. 16, № 7. — P. 1325-1329.
4. Bolander-Gouaille Ch. Homocysteine in the Development of Dementia — An Overview / Ch. Bolander-Gouaille // Bussines briefing: European pharmacotherapy. — 2005. — P. 1-8.
5. Changes in markers of cobalamin status after cessation of oral B-vitamin supplements in elderly people with mild cobalamin deficiency / S.J. Eussen, P.M. Ueland, G.J. Hiddink [et al.] // European Journal of Clinical Nutrition. — 2008. — Vol. 62, № 10. — P. 1248-1251.
6. Homocysteine is a risk factor for cerebral small vessel disease, acting via endothelial dysfunction / A. Hassan, B.J. Hunt, M. O’Sullivan [et al.] // Brain. — 2004. — Vol. 127, № 1. — P. 212-219.
7. Homocysteine Studies Collaboration. Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis // JAMA. — 2002. — Vol. 288. — P. 2015-2022.
8. Jacobsen D.W. Homocysteine and vitamins in cardiovascular disease / D.W. Jacobsen // Clinical chemistry. — 1998. — № 44. — P. 1833-1843.
9. Lentz S.R. Homocysteine: Is it a clinically important cardiovascular risk factor? / S.R. Lentz, W.G. Haynes // Cleveland Clinic Journal of Medicine. — 2004. — Vol. 71. — P. 729-734.
10. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task. Force document / G. Manciaa, S. Laurentb, E. Agabiti-Roseic [et al.] // Journal of Hypertension. — 2009. — Vol. 27. — 38 p.
11. Moat S.J. Plasma total homocysteine: instigator or indicator of cardiovascular disease? / S.J. Moat // Annals Clinical Biochemisry. — 2008. — Vol. 45, № 4. — P. 345-348.
12. Promotion of vascular smooth muscle growth by homocysteine: a link to atherosclerosis / J.C. Tsai, M.A. Perella, M. Yoshizumi [et al.] // Proceedings of the National Academy of Sciences of the United States of America (PNAS). — 1994. — Vol. 91, № 14. — P. 6369-6373.
13. Szegedi S.S., Castro C.C., Koutmos M., Garrow T.A. Betaine-homocysteine s-methyltransferase-2 is an s-methylmethionine–homocysteine methyltransferase / S.S. Szegedi, C.C. Castro, M. Koutmos [et al.] // The Journal of Biological Chemistry. — 2008. — Vol. 283, № 14. — P. 8939-8945.
14. Virtanen J.K. Homocysteine as a risk factor for CVD mortality in men with other CVD risk factors: the Kuopio Ischaemic Heart Disease Risk Factors (KIHD) Study / J.K. Virtanen, S. Voutilainen, G. Alfthan // Journal of Internal Medicine. — 2005. — Vol. 257, № 3. — P. 255-262.
15. Vollset S.E. Population determinants of Homocysteine / S.E. Vollset, H. Refsum, P.M. Ueland // American Journal of Clinical Nutrition. — 2001. — Vol. 73, № 3. — P. 499-500.