Журнал «» 3 (29) 2013
Вернуться к номеру
Прогностическая значимость нейропептида Y у больных с гипертонической болезнью III стадии и сопутствующим ожирением
Авторы: Визир В.А., Волошина И.Н., Запорожский государственный медицинский университет, кафедра внутренних болезней № 2
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
В исследовании проведено определение плазменного содержания нейропептида Y у пациентов с гипертонической болезнью III стадии и ожирением, установлена прогностическая значимость нейропептида Y для развития церебро- и кардиоваскулярных осложнений.
У дослідженні проведено визначення плазмового вмісту нейропептиду Y в пацієнтів із гіпертонічною хворобою III стадії й ожирінням, встановлена прогностична значимість нейропептиду Y для розвитку церебро- і кардіоваскулярних ускладнень.
Determination of plasma content of neuropeptide Y in patients with stage III hypertension and obesity had been carried out in the study. Predictive value of neuropeptide Y for the development of cerebro- and cardiovascular complications is proved.
гипертоническая болезнь, нейропептид Y, ожирение.
гіпертонічна хвороба, нейропептид Y, ожиріння.
hypertension, neuropeptide Y, obesity.
Введение
Автономная нервная система (АНС) осуществляет важный координационный контроль над циклическими процессами в организме человека [8, 12]. Длительное повышение активности одного из отделов АНС (симпатического или парасимпатического) вследствие различных провоцирующих факторов ассоциируется с формированием синдрома вегетативной дисфункции. Гиперсимпатикотония является ведущим патогенетическим фактором инициации и прогрессирования двух наиболее распространенных заболеваний — гипертонической болезни (ГБ) и ожирения (ОЖ) [1, 3, 11]. Эффекты симпатической гиперактивации реализуются вследствие положительного хронотропного и инотропного воздействия на миокард, увеличения периферического сосудистого сопротивления и задержки жидкости в организме [12, 13]. Данных, касающихся оценки прогностической значимости гиперсимпатикотонии у больных осложненной и неосложненной ГБ в сочетании с ОЖ, накоплено недостаточно. Определенную сложность в этом представляет отсутствие единого диагностичекого алгоритма оценки степени активности симпатической нервной системы (СНС). Тем не менее экспериментальное и клиническое изучение различных компонентов СНС как потенциальных объектов терапевтического воздействия при ГБ в настоящее время активно проводится во всем мире.
Целью исследования явилось определение прогностической значимости гиперсимпатикотонии у больных гипертонической болезнью III стадии с последствиями инфаркта мозга (ИМ) и ожирением.
Материал и методы исследования
Обследовано 120 больных (76 мужчин, 44 женщины) с диагнозом «гипертоническая болезнь ІІІ стадии», перенесших ИМ давностью более 12 месяцев. Средний возраст пациентов составил 59,0 ± 0,9 года. Наличие и степень ожирения определяли на основании расчета индекса массы тела (ИМТ) [4]. Контрольную группу составили 20 клинически здоровых лиц (12 мужчин, 8 женщин) в возрасте 54,0 ± 3,8 года, не имеющих в анамнезе артериальной гипертензии и цереброваскулярных заболеваний. По гендерному составу, возрасту, частоте курения группы обследуемых лиц были сопоставимы. Уровни медиаторов СНС в плазме крови определяли иммуноферментным методом (ИФА) с помощью наборов IBL (Германия) — для норадреналина и Peninsula (Великобритания) — для определения нейропептида Y (NPY). Образцы крови для ИФА брали из локтевой вены, контралатеральной той руке, где измерялось АД, утром натощак до приема медикаментов, в состоянии покоя. На момент проведения исследования все обследованные лица либо не получали постоянной антигипертензивной терапии, либо она была отменена за 48 часов до включения больных в исследование. Плазму отделяли методом центрифугирования незамедлительно и замораживали при температуре –70 °С до момента проведения анализа. Уровень NPY определяли после его экстракции из плазмы с помощью картриджей SEPCOLUMN, содержащих 200 мг сорбента С18 (Peninsula).
В соответствии с целью исследования была создана первичная конечная клиническая точка, в качестве которой рассматривали все случаи смерти по любой причине, а также случаи нефатальных церебро и кардиоваскулярных событий (мозговой инсульт, инфаркт миокарда, фибрилляция предсердий). Период наблюдения составил 365 ± 10 дней от момента включения пациентов в исследование. В течение периода наблюдения все пациенты получали комплексную терапию согласно существующим рекомендациям [5].
Полученные результаты представляли в виде средней (M) и стандартной ошибки среднего (m) или 95% доверительного интервала (ДИ). Для выявления предикторов неблагоприятного течения ГБ использовали модель пропорциональных рисков Кокса. Чувствительность и специфичность предикторов определяли путем построения ROCкривых. Внутри и межгрупповые различия оценивали с помощью двухвыборочного Ттеста или c2теста в зависимости от вида данных в рамках программы StatPlus 2009. Статистически достоверными считали различия между показателями при отклонении нулевой гипотезы и уровне значимости p < 0,05 [2].
Результаты и их обсуждение
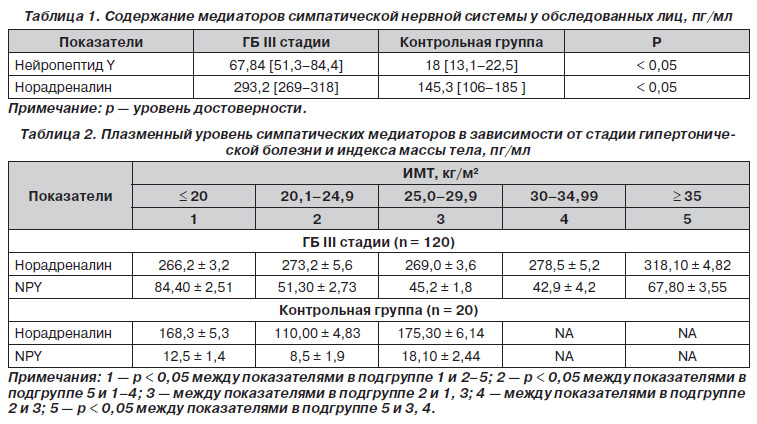
Анализ полученных значений симпатических маркеров показал, что достоверно более высокие значения плазменной концентрации норадреналина и NPY были выявлены у пациентов с ГБ III стадии, перенесших ИМ, по сравнению с нормотензивными лицами без цереброваскулярной патологии (табл. 1).
Неоднозначным оказалось распределение концентрации симпатических медиаторов в зависимости от индекса массы тела (табл. 2). Уровень норадреналина среди больных ГБ ІІІ стадии с последствиями инсульта был наивысшим у лиц с ИМТ ≥ 35 кг/м2, достоверно превышая аналогичные значения у пациентов с меньшей массой тела.
Неожиданными оказались результаты определения концентрации NPY в плазме крови больных ГБ ІІІ стадии и с последствиями инсульта. Максимальные значения данного нейропептида регистрировались у больных с ИМТ ≤ 20 кг/м2, достоверно превышая аналогичные показатели у лиц с ИМТ 20–34,99 кг/м2. У больных ГБ ІІІ стадии с ИМТ ≥ 35 кг/м2 плазменный уровень NPY был на 20 % (p < 0,05) ниже в сравнении с пациентами, имеющими ИМТ ≤ 20 кг/м2. Наименьшие значения NPY у больных ГБ ІІІ стадии с последствиями инсульта определялись в подгруппе с ИМТ 30–34,99 кг/м2.
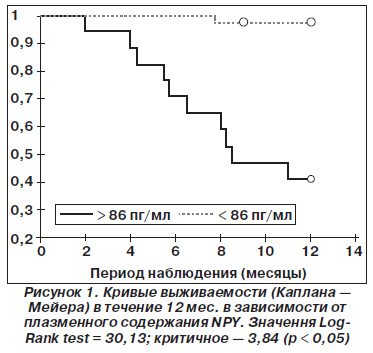
Оценка выживаемости в группе исследуемых пациентов проводилась через один год от момента включения в исследование. За указанный период наблюдения зарегистрировано 9,16 % комбинированных конечных клинических точек. Кумулятивное выживание больных с ГБ и последствиями ИМ составило 90,8 %. Осложнения, приведшие к смерти, были зарегистрированы в 2,5 %. Частота возникновения всех инсультов составила 4,9 %; кардиальных осложнений — 4,16 %. При проведении ROCанализа с последующим прогностическим моделированием по Коксу выявлено, что уровень нейропептида Y являлся независимым предиктором возникновения церебро и кардиоваскулярных осложнений у больных ГБ III стадии, перенесших ИМ (HR = 1,19; p < 0,05). Оптимальной точкой разделения на ROCкривой, свыше которой значение NPY имело наиболее высокую прогностическую ценность относительно возникновения церебро и кардиоваскулярных событий, оказалась концентрация для NPY свыше 86 пг/мл. Площадь под кривой (AUC) составила 0,971; чувствительность анализа 90,9 %, специфичность — 85,7 % (p < 0,05). На рис. 1. представлены кривые выживаемости Каплана — Мейера в зависимости от плазменного уровня NPY.
При анализе выживаемости больных в зависимости от ИМТ (табл. 3) оказалось, что неблагоприятные клинические события отмечались у пациентов, имеющих ИМТ < 20 кг/м2, и у лиц с ожирением ІІ–ІІІ степени (ИМТ ≥ 35 кг/м2) достоверно чаще в отличие от больных с нормальной и избыточной массой тела и ожирением первой степени.
Исходя из данных, представленных в табл. 2, можно предположить, что возможным патогенетическим механизмом, связанным с увеличением риска развития повторных инсультов и сердечнососудистых событий, было повышение плазменного уровня нейропептида Y. Полученные результаты отражают, несомненно, важную роль активации симпатической нервной системы в патогенезе осложненной ГБ, а также в регуляции метаболических процессов. Высокие концентрации норадреналина и особенно NPY у больных ГБ ІІІ стадии с последствиями ИМ характеризуют нарушение процесса секреции нейропептида структурами центральной нервной системы. Повышенная концентрация нейропептида Y на фоне относительно неизмененного уровня норадреналина у больных с ИМТ ≤ 20 кг/м2 может являться патогенетическим обоснованием «парадокса ожирения», выявленного в ряде крупных международных исследований. Результаты исследования TEMPIS показали, что среди 4428 больных с инсультом (70 % ишемических) наибольший риск развития повторных событий и смерти был выявлен у пациентов с низкой массой тела, а ожирение, напротив, ассоциировалось с благоприятным клиническим прогнозом [10]. Нейропептид Y известен не только как симпатический медиатор, но и как один из центральных регуляторов метаболизма жировой ткани, увеличение экспрессии NPY было выявлено при различных стрессорных воздействиях, ожирении и анорексии [14]. Повышение концентрации симпатического нейропептида Y у пациентов с ИМТ ≤ 20 кг/м2 и у больных с выраженным ожирением может косвенно отражать гиперадренергическое состояние, уровень стресса и преобладание катаболических реакций метаболизма у данного контингента лиц.
Таким образом, полученные в исследовании данные отображают высокий прогностический потенциал маркеров гиперсимпатикотонии для оценки риска развития церебро и кардиоваскулярных осложнений у пациентов высокого сердечнососудистого риска. Результаты согласуются с проведенными ранее исследованиями, в которых доминирование СНС (по данным анализа ВСР) ассоциировалось с высоким риском аритмий и ранних церебральных осложнений у больных с острым инсультом [7, 8]. Прогностическая значимость элевации плазменного уровня NPY ранее не изучалась у постинсультных пациентов с ГБ и ожирением. Полученные нами результаты высокой чувствительности и специфичности этого симпатического нейромедиатора позволяют предложить его определение для оценки риска развития осложнений у больных с ГБ ІІІ стадии и сопутствующим ожирением в клинической практике.
Выводы
1. Плазменное содержание нейропептида Y у больных гипертонической болезнью ІІІ стадии с последствиями инфаркта мозга и ожирением достоверно превышает аналогичные значения у нормотензивных лиц без цереброваскулярной патологии.
2. Гиперсимпатикотония является значимым патогенетическим фактором возникновения церебро и кардиоваскулярных осложнений у больных гипертонической болезнью ІІІ стадии.
3. Риск развития повторных инсультов и сердечнососудистых осложнений в течение одного года выше у больных гипертонической болезнью ІІІ стадии с индексом массы тела менее 20 кг/м2 и более 35 кг/м2.
1. Артериальная гипертония и масса тела. Решенные и нерешенные проблемы / А.Г. Мартынова, А.И. Кодочигова, В.Ф. Киричук, А.А. Ермолаев // Клинич. медицина. — 2005. — Т. 83, № 8. — С. 3236.
2. Герасимов А.Н. Медицинская статистика / А.Н. Герасимов // М.: Медицинское информагентство, 2007. — 480 с.
3. Конради А.О. Симпатическая нервная система, ожирение и артериальная гипертензия. Возможности терапии / А.О. Конради // Ожирение и метаболизм. — 2007. — № 3. — C. 915.
4. Мітченко О.І. Від імені Робочої групи з метаболічного синдрому, преддіабету і серцевосудинних захворювань Української асоціації кардіологів і Української асоціації ендокринологів / О.І. Мітченко // Укр. мед. часопис. — 2007. — № 2(58). — III/IV. — С. 4-13.
5. Рекомендації української асоціації кардіологів з профілактики та лікування артеріальної гіпертензії. Четверте видання / ННЦ «Інститут кардіології ім. Стражеска» АМН України. — К., 2008. – 79 с.
6. Ahren B. Autonomic regulation of islet hormone secretion implications for health and disease / B. Ahren // Diabetologia. — 2000. — 43. — P. 393410.
7. Colivicchi F., Bassi A., Santini M., Caltagirone C. Cardiac autonomic derangement and arrhythmias in rightsided stroke with insular involvement // Stroke. — 2004. — Vol. 35(9). — P. 20942098.
8. Dutsch M., Burger M., Dorfler C. et al. Cardiovascular autonomic function in poststroke patients // Neurology. — 2007. — Vol. 69(24). — P. 22492255.
9. Kuo L.E. et al. Neuropeptide Y. acts directly in the periphery on fat tissue and mediates stressinduced obesity and metabolic syndrome // Nature Med. — 2007. — Vol. 13. — P. 803811.
10. Doehner W., Schenkel J., Anker S.D. et al. Overweight and obesity are associated with improved survival, functional outcome, and stroke recurrence after acute stroke or transient ischaemic attack: Observations from the TEMPIS trial // Eur. Heart J. — 2013. — Vol. 34(4). — P. 268277.
11. Perin P.C. Sympathetic nervous system, diabetes, and hypertension / Perin P.C., Maule S., Quadri R. // Clinical and Experimental Hypertension. — 2001. — Vol. 23. — P. 4555.
12. Grassi G., Seravalle G., Dell’Oro R., Mancia G. Sympathetic mechanisms, organ damage, and antihypertensive treatment // Curr. Hypertens. Rep. — 2011. — Vol. 13(4). — P. 303308.
13. Hugget R.J., Burns J., Mackintosh A.F., Mary D. Sympathetic neural activation in nondiabetic metabolic syndrome and its further augmentation by hypertension // Hypertension. — 2004. — Vol. 44. — P. 847852.
14. Tatemoto K. Neuropeptide Y: History and Overview // Michel M.C. Handbook of Experimental Pharmacology. — Springer, 2004. — Р. 215.