Журнал «» 3(17) 2011
Вернуться к номеру
Проект робочих груп Асоціації кардіологів України з невідкладної кардіології та артеріальної гіпертензії. Гіпертензивні кризи
Артеріальна гіпертензія (АГ) є однією з найпоширеніших хвороб у сучасному світі, від якої страждає приблизно третина дорослого населення (Lloyd-Jones D.M., Evans J.C. et al., 2003). Впровадження нових антигіпертензивних препаратів дозволило суттєво знизити вірогідність виникнення невідкладних гіпертензивних станів (до менш ніж 1 % від загальної кількості хворих), але ускладнення АГ і досі належить до основних причин виклику швидкої допомоги та госпіталізації хворих кардіологічного профілю (Shayne P.H., Pitts S.R., 2003). Ускладнений гіпертензивний криз (ГК) є станом, що безпосередньо загрожує життю хворого. За відсутності лікування смертність пацієнтів із ускладненим ГК сягає 70–80 % протягом 1 року (Webster J., Petrie J.C. et al., 1993). У той же час адекватний контроль артеріального тиску (АТ) дозволяє знизити цей показник до 10 % (Rhoades R., Planzer R., 1996). Ці рекомендації розроблені Робочими групами з невідкладної кардіології та артеріальної гіпертензії Асоціації кардіологів України спільно з Науково-практичним товариством неврологів, психіатрів та наркологів України та присвячені питанням діагностики й лікування гіпертензивних кризів.
Визначення
Гіпертензивний криз — це раптове значне підвищення артеріального тиску від нормального або підвищеного рівня, що майже завжди супроводжується появою чи посиленням розладів з боку органів-мішеней або вегетативної нервової системи.
Критеріями гіпертензивного кризу є:
— раптовий початок;
— значне підвищення артеріального тиску;
— поява або посилення симптомів з боку органів-мішеней.
Залежно від наявності чи відсутності ураження органів-мішеней і необхідності термінового зниження AT виділяють:
— ускладнені кризи, що характеризуються гострим або прогресуючим ураженням органів-мішеней, становлять пряму загрозу життю хворого та потребують негайного (від хвилин до однієї-двох годин) зниження AT;
— неускладнені кризи — без гострого або прогресуючого ураження органів-мішеней, становлять потенційну загрозу життю хворого і потребують швидкого (протягом кількох годин) зниження AT.
Таким чином, термін «ускладнений гіпертензивний криз» об’єднує низку клінічних станів, при яких неконтрольоване підвищення артеріального тиску призводить до дисфункції органів-мішеней оборотного чи необоротного характеру (табл. 1).
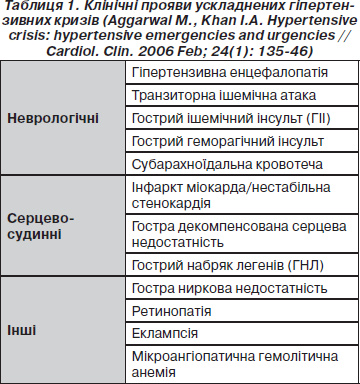
Найбільш часто при ускладненому ГК спостерігається розвиток гострої серцевої недостатності, що проявляється гострим набряком легенів (22,5 %) чи декомпенсацією хронічної серцевої недостатності (12 %). 25 % хворих мають гостре порушення мозкового кровообігу, 12 % — гострий коронарний синдром, 4,5 % — внутрішньочерепну або субарахноїдальну кровотечу, 4,5 % — еклампсію та 2 % — розшарування аорти.
У 83 % хворих спостерігається ураження одного з органів-мішеней, у 14 % — двох. Три органи і більше страждають приблизно у 3 % хворих з ускладненим ГК (Zampaglione B., Pascale P., 1996).
Епідеміологія
Розробка та впровадження в клінічну практику рекомендацій із лікування артеріальної гіпертензії на базі сучасних антигіпертензивних засобів призвели до суттєвого зниження частоти реєстрації неускладнених та ускладнених ГК. Хоча статистичні дані в останній час досить обмежені, вважається, що ГК хоча б раз у житті розвивається в 1–5 % хворих на АГ (National Heart Lung Blood Institute., 2010; Marik P.E., Varon J., 2007).
Таким чином, з огляду на частоту АГ в загальній популяції ГК є досить частим невідкладним станом. В одному з досліджень ГК становили 27,5 % від усіх надходжень у відділення інтенсивної терапії лікарні загального профілю (Zampaglione B., Pascale C., 1996). ГК частіше зустрічаються серед осіб старших вікових груп, чоловіків та осіб негроїдної раси. Ускладнені ГК відмічаються в чоловіків майже вдвічі частіше, ніж у жінок (Bennett N.M., Shea S., 1988; Potter J.F., 1995).
У більшості випадків причиною ГК є неадекватність призначеної антигіпертензивної терапії чи недотримання режиму її прийому. Так, у деяких дослідженнях більше 50 % пацієнтів з ГК не приймали рекомендоване лікування протягом як мінімум одного тижня до госпіталізації (Tumlin J.A., Dunbar L.M., 2000).
Таким чином, неконтрольований АТ є основним фактором ризику ГК. Предикторами неадекватного контролю АТ були визначені старіший вік, менша кількість антигіпертензивних препаратів, декомпенсований цукровий діабет, гіперліпідемія, серцева недостатність та нефропатія (Okonofua E.C., Simpson K.N., Jesri A. et al., 2006).
Патофізіологія
Фактори, що призводять до значного та швидкого підвищення АТ у пацієнтів із ГК, до цього часу відомі недостатньо. У деяких випадках ГК може розвиватися de novo, хоча у більшості пацієнтів виявляли в анамнезі первинну або вторинну АГ (Tisdale J.E., Huang M.B., Borzak S. et al., 2004).
Захворювання та стани, що можуть ускладнюватися розвитком гіпертензивного кризу:
— Гіпертонічна хвороба.
— Хвороби нирок.
— Паренхіматозні.
— Хронічний пієлонефрит.
— Первинний гломерулонефрит.
— Судинно-гломерулярні захворювання.
— Тубулоінтерстиціальний нефрит.
— Реноваскулярні.
— Стеноз ниркової артерії:
а) фібромускулярна дисплазія;
б) атеросклеротичне ураження.
— Лікарські препарати та наркотичні засоби.
— Вагітність.
— Ендокринні захворювання.
— Захворювання ЦНС.
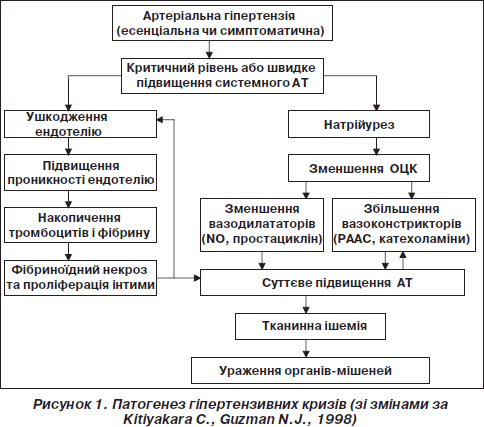
Вважається, що початковим етапом у розвитку ГК є стрімке підвищення системного судинного опору (за рахунок вивільнення гуморальних вазоконстрикторів із судинної стінки) на фоні порушення нормальної авторегуляції АТ (Ault M.J., Ellrodt A.G., 1985; Wallach R., Karp R.B., Reves J.G. et al., 1980). Як наслідок, значне та швидке підвищення внутрішньосудинного тиску спричинює пошкодження ендотелію, збільшення проникності судинної стінки, активацію тромбоцитів, запуск каскаду згортання крові та накопичення фібрину. Результатом цих процесів є прогресування ендотеліальної дисфункції з розвитком фібриноїдного некрозу артеріол та подальшим вивільненням великої кількості вазоконстрикторів. Якщо це порочне коло вчасно не розірвати, виникає тканинна ішемія з ураженням органів-мішеней та посилюються порушення авторегуляторних механізмів.
У розвитку та прогресуванні ГК важливу роль відіграють дисфункція ренін-ангіотензин-альдостеронової системи (РААС), затримка натрію та рідини, гостре порушення барорефлексу на фоні автодисрегуляції.
У нормі ренін-ангіотензин-альдостеронова система підтримує та регулює рівень АТ (Blumenfeld J.D., Laragh J.H., 2001). Надлишок синтезу реніну стимулює вироблення великої кількості ангіотензину ІІ — дуже потужного вазоконстриктора, що призводить до підвищення судинного опору та збільшення АТ. Високий рівень реніну (> 0,65 нг/мл/год) визначається при так званому R-типі (реніновому типі) артеріальної гіпертензії та деяких видах ГК. При порушенні функціонування РААС із патофізіологічної точки зору виправданим є застосування b-адреноблокаторів, інгібіторів АПФ або реваскулярізація/денервація/видалення ішемізованої нирки (Blumenfeld J.D., Laragh J.H., 2001). На відміну від R-типу у пацієнтів із так званим V-типом артеріальної гіпертензії основну роль відіграє затримка натрію та рідини при нормальному або навіть дещо зниженому рівні реніну. Ці пацієнти найкраще відповідають на терапію діуретиками, блокаторами альдостерону, блокаторами кальцієвих каналів та a-адреноблокаторами. (Blumenfeld J.D., Laragh J.H., 2001).
Хоча запропонована класифікація (залежно від рівня реніну) є корисною, інформація стосовно його рівня під час ГК у більшості випадків відсутня, що унеможливлює її використання.
Артеріальний барорефлекс допомагає підтримувати АТ на належному рівні та запобігає значним його коливанням (Ketch T., Biaggioni I., Robertson R.M. et al., 2002).
Гостре порушення барорефлекторної відповіді в основному пов’язане з хірургічними втручаннями внаслідок пошкодження функції язиково-глоткового та блукаючого нервів або при ендартеректомії сонних артерій, але можливе також на фоні гострого інсульту (порушення стовбурових функцій), при генетичних вадах хромафінної тканини, феохромоцитомі, променевій терапії голови, шиї або пухлинах гортані та глотки (Ketch T., Biaggioni I., Robertson R.M, et al., 2002).
Підвищення АТ унаслідок гострого порушення барорефлексу може сягати дуже значних цифр (систолічний АТ (систАТ) близько 300 мм рт.ст.) та іноді супроводжується значною брадикардією або блокадами серця. Для лікування цієї групи хворих рекомендовано використовувати центральні симпатолітики (клонідин, урапідил) для зниження АТ, а у випадку блокад серця — постановку електрокардіостимулятора.
Велику роль у виникненні та прогресуванні ГК відіграє порушення авторегуляції локального мозкового, коронарного та/або ниркового кровотоку. У нормотоніків авторегуляторні механізми ЦНС зазнають перенавантаження при рівнях систолічного АТ понад 170–180 мм рт.ст., що призводить до набряку головного мозку із підвищенням внутрішньочерепного тиску, головного болю, підвищеної судомної активності, енцефало- та ретинопатії (McGregor E., Isles C.G., Jay J.L. еt al., 1986).
Пошкодження місцевої регуляції ниркового кровотоку, обумовлене переобтяженням механізмів зворотного зв’язку та еферентних артеріол клубочків в умовах значного підвищення АТ. Наслідком цього є розвиток протеїнурії, зниження продукції сечі і у крайньому випадку розвиток серцевої недостатності.
Вторинні ГК
Ішемічні ураження органів-мішеней (у результаті тромботичної оклюзії) можуть бути не тільки наслідком, але й часто є причиною розвитку ГК. Значне підвищення АТ спостерігається у хворих із гострими коронарними синдромами, гострим інсультом, гострою серцевою недостатністю. Можливий також розвиток ГК у результаті порушення функції щитоподібної залози, вживання токсичних речовин (кокаїн, амфетаміни, стероїди), а також у разі різкої відміни деяких медичних препаратів (клонідин, b-адреноблокатори). Причиною незначної (< 0,3 %) частини ГК є феохромоцитома (Fitzgerald P., 2010; Madani R., Al-Hashmi M. еt al., 2007).
Незважаючи на рідкісний характер захворювання (1 випадок на 500 000 населення) диференційна діагностика феохромоцитоми повинна проводитись у всіх хворих із ГК. Можливими причинами ГК є також стеноз ниркових артерій (< 1 % випадків), гострий гломерулонефрит, еклампсія-прееклапмпсія, стан після трансплантації нирки, постопераційній період.
Центральна нервова система
Механізми авторегуляції забезпечують постійність мозкового кровотоку при широкому спектрі перфузійного тиску. Пацієнти з хронічною АГ здатні переносити більш високі цифри АТ до зриву авторегуляції. У той же час у цієї категорії хворих відмічається підвищення судинного опору, у зв’язку з чим вони більш схильні до розвитку ішемії головного мозку при зниженні кровотоку в умовах нормалізації АТ.
Різке підвищення рівня АТ може призвести до збільшення мозкового кровотоку, підвищення внутрішньочерепного тиску та набряку мозку (Kitiyakara C., Guzman N.J., 1998).
Одним із клінічних проявів набряку головного мозку та мікрогеморагій на тлі порушення авторегуляції мозкового кровотоку в умовах ГК є гіпертензивна енцефалопатія (Heilpern K., 2008).
Серцево-судинна система
Пацієнти з тривалим анамнезом АГ характеризуються підвищенням жорсткості судинної стінки, збільшенням рівня систолічного й пульсового АТ, розвитком гіпертрофії ЛШ (Heilpern K., 2008). Ці фактори призводять до зниження коронарної перфузії та збільшення потреби міокарда в кисні. В умовах ГК ЛШ не може компенсувати різке підвищення системного судинного опору, що є причиною гострої лівошлуночкової недостатності й набряку легень або гострої ішемії міокарда (Aggarwal M., Khan I.A., 2006).
Сечовидільна система
Хронічне підвищення АТ у пацієнтів з АГ викликає ремоделювання дрібних артерій нирок із розвитком ендотеліальної дисфункції та порушенням їх здатності до вазодилатації. У цих умовах порушується авторегуляція ниркового кровообігу, коли внутрішньоклубочковий тиск не підтримується на постійному рівні, а починає змінюватися залежно від коливань системного АТ. В умовах ГК таке порушення авторегуляції може супроводжуватися гострою ішемією нирок та (у крайньому випадку) розвитком гострої ниркової недостатності (Aggarwal M., Khan I.A., 2006).
Діагноз
Найважливішим завданням початкового етапу діагностики є відокремлення хворих з ускладненими й неускладненими гіпертензивними кризами, тобто пошук ознак можливого ураження органів-мішеней. Ретельний збір анамнезу та фізикальне обстеження в багатьох випадках дозволяють з’ясувати природу артеріальної гіпертензії, ступінь підвищення артеріального тиску, ураження того чи іншого органа-мішені, а також визначити план подальшого обстеження і лікування.
Анамнез
При зборі анамнезу захворювання необхідно звернути увагу на тривалість артеріальної гіпертензії; звичайні («робочі») цифри АТ; визначити можливі ураження органів-мішеней у минулому та супутні захворювання; деталізувати антигіпертензивну терапію, що проводиться, та її дотримання; визначити прийом ліків (симпатоміметики, НПЗП, трав’яні препарати) або наркотичних засобів (кокаїн, амфетаміни, ефедрин), що могли спровокувати розвиток ГК. Причиною розвитку ГК може також стати різка відміна прийому бета-адреноблокаторів та центральних симпатолітиків (рикошетна гіпертензія). Симптоми, що виникають у хворих із ГК, можна умовно поділити на загальні та локальні (Сидоренко Б.А., 2007).
До загальних симптомів належать: почервоніння або блідість шкіри й обличчя, пітливість, запаморочення, серцебиття, сухість у роті, шум у вухах, страх, збудження, тремор тощо. Локальні симптоми залежать від ураження конкретного органа-мішені: ангінозний біль (нестабільна стенокардія, інфаркт міокарда, дисекція аорти), задишка (гострий набряк легенів), біль у спині (дисекція аорти), головний біль, порушення свідомості, вогнищева неврологічна симптоматика, нудота, блювання та порушення зору (внутрішньочерепна або субарахноїдальна кровотеча, гіпертензивна енцефалопатія), кровотеча (післяопераційна).
Фізикальне обстеження
Визначення АТ обов’язково повинно проводитися на обох руках — так, суттєва різниця показників (більше ніж у 20 мм рт.ст.) може свідчити про наявність розшарування аорти. Вимірювання тиску в різних положеннях (стоячи та лежачи) дозволить виявити приховане зневоднення, що часто спостерігається у пацієнтів із ГК (посилення діурезу за рахунок компенсаторного виділення натрію). Треба ще раз підкреслити необхідність застосування манжети необхідного розміру для вимірювання АТ, оскільки використання замалої манжети може штучно збільшувати цифри АТ у пацієнтів із надлишковою вагою (Graves J.W., 2001; Linfors E.W., Feussner J.R. et al., 1984).
Обстеження серцево-судинної системи повинно також включати оцінку нових шумів та додаткових тонів. Так, діастолічний шум над аортою може підтвердити діагноз розшаровуючої аневризми, а наявність ритму галопу, посилення акценту другого тону над легеневою артерією чи посилення систолічного шуму мітральної регургітації є ознаками прогресуючої серцевої недостатності. Ознаками прогресування серцевої недостатності також можуть виступати розширення яремних вен, збільшення печінки та посилення периферичних набряків. Розвиток гострої лівошлуночкової недостатності характеризується появою крепітаційних хрипів у нижніх відділах чи над усією поверхнею легенів. Під час ГК може відбутися зрив ритму на пароксизмальну тахікардію або фібриляцію передсердь, що значно погіршує клінічну ситуацію в таких хворих.
Наявність атеросклеротичного процесу в будь-якому судинному басейні, особливо в курців, повинна застерегти відносно реноваскулярного характеру АГ. Підтвердженням цього діагнозу може бути наявність систолічного/діастолічного шуму над місцем проекції цих судин на передню черевну стінку.
Кожному хворому треба провести уважне неврологічне та офтальмологічне обстеження. Наявність вогнищевої неврологічної симптоматики свідчить про розвиток ішемічного чи геморагічного інсульту. Загальномозкова симптоматика, порушення свідомості можуть свідчити про розвиток гіпертензивної енцефалопатії. Хоча в будь-якому випадку діагноз гіпертензивної енцефалопатії є діагнозом виключення — його встановлюють тільки після остаточного виключення інших причин порушення діяльності центральної нервової системи (ішемічний/геморагічний інсульт, субарахноїдальна кровотеча). Всім хворим треба провести обстеження очного дна. Наявність ретинопатії третього (плазморагії та геморагії; світло-жовті «тверді» й сірувато-білі «м’які» ексудати; білі «ватоподібні» вогнища) чи четвертого (набряк зорового нерва та дегенеративні зміни сітківки) ступеня за класифікацією Keith-Wagner-Barker також є ознаками ускладненого ГК (Keith N.M., Wagener H.P., 1939).
Неускладнені гіпертензивні кризи характеризуються відсутністю клінічних ознак гострого або прогресуючого ураження органів-мішеней, проте вони становлять потенційну загрозу життю хворого, оскільки несвоєчасне надання допомоги може призвести до появи ускладнень і смерті. Такі кризи супроводжуються, як правило, появою чи посиленням симптомів із боку органів-мішеней (інтенсивний головний біль, болі в ділянці серця, екстрасистолія) або з боку вегетативної нервової системи (вегетосудинні порушення, тремтіння, часте сечовиділення).
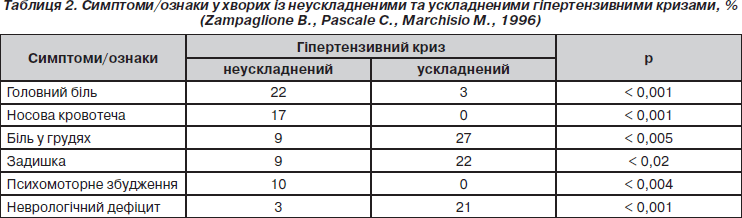
Відмінності у клінічній симптоматиці ускладнених та неускладнених гіпертензивних кризів наведені в табл. 2.
Залежно від того, які органи є джерелом симптомів, виділяють церебральні та кардіальні неускладнені кризи (табл. 2). Гіпоталамічні пароксизми (за старою термінологією — діенцефально-вегетативні кризи) є проявом церебрального кризу. Підвищення CAT до 240 мм рт.ст. або ДАТ до 140 мм рт.ст. слід також розцінювати як гіпертензивний криз незалежно від того, з’явилися симптоми з боку органів-мішеней чи ще ні, оскільки для кожного хворого воно є небезпечним. Загрозливим є також значне підвищення тиску в ранньому післяопераційному періоді через ризик кровотечі.
Лабораторна діагностика
Проведення лабораторної діагностики дозволяє отримати додаткову інформацію щодо ураження органів-мішеней. Так, обов’язковим базисним аналізом є загальний аналіз крові з мікроскопічною оцінкою формених елементів на наявність шистоцитів, що свідчать про розвиток мікроангіопатичної гемолітичної анемії. Визначення загального рівня сечовини, креатиніну, електролітів допомагає в діагностиці ураження нирок. З цією метою важливим є також проведення аналізу сечі на наявність гематурії чи/та протеїнурії (тест-смужка), а також мікроскопічний аналіз сечі на наявність змінених чи незмінених еритроцитів. Зменшення об’єму циркулюючої крові та вторинний гіперальдостеронізм, що виникають унаслідок цього, можуть бути причиною гіпокаліємії та метаболічного алкалозу. Іноді гостра ішемія печінки на фоні ГК спричинює підвищення рівня печінкових трансаміназ (АСТ, АЛТ).
Додатковими аналізами крові є токсикологічні, ендокринологічні дослідження, а також тест на вагітність, що іноді допомагають у з’ясуванні причини ГК. Так, при підозрі на вторинний характер АГ додатково вимірюють рівень реніну, альдостерону чи катехоламінів.
Інші методи діагностики
Електрокардіограма є обов’язковим методом обстеження всіх хворих із ГК. Вона дозволяє як виявити ознаки гострої ішемії або інфаркту міокарда в гострій фазі ГК, так і оцінити наявність гіпертрофії міокарда, пов’язаної з попередньою АГ. Важливими діагностичними дослідженнями при ГК є рентгенографія органів грудної клітки та ехокардіографія. За допомогою рентгенографії визначають контури серця, аорти й легеневої артерії, наявність ознак застою в легенях. За допомогою ехокардіографії уточнюють розміри камер серця, аорти, стан внутрішньосерцевої гемодинаміки (Сіренко Ю.М., 2002).
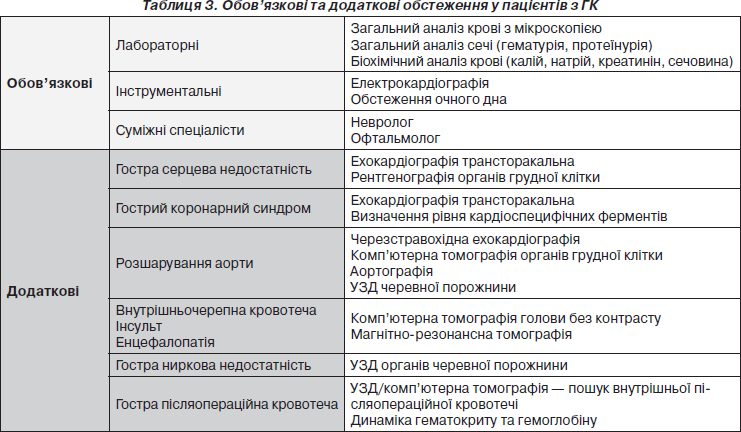
Необхідність проведення інших інструментальних та лабораторних методів діагностики залежить від того, ураження яких з органів-мішеней були виявлені або запідозрені при зборі анамнезу та фізикальному обстеженні (табл. 3).
Слід пам’ятати, що проведення діагностичних процедур не повинно затягуватися, їх треба проводити паралельно з терапевтичними заходами.
Незважаючи на те що план лабораторного та інструментального обстеження хворих з ускладненим ГК виглядає досить чітким, багато з цих пацієнтів не отримують належного обстеження протягом перебування у відділі інтенсивної терапії. Так, результати двох нещодавніх досліджень свідчать, що належні біохімічні аналізи крові проводяться лише у 70–73 %, ЕКГ — 53–70 %, рентгенологічне дослідження органів грудної клітки — 24–46 %, аналіз сечі — 43–44 % хворих. Всі необхідні аналізи були вчасно виконані менше ніж у 10 % хворих та лише дві третини пацієнтів були вчасно оглянуті офтальмологом (обстеження очного дна).
Принципи ведення хворих з ГК
Найважливішим питанням при лікуванні хворого з ускладненим чи неускладненим ГК є визначення швидкості та ступеня зниження АТ. У той же час на сьогодні немає результатів високоякісних проспективних досліджень, які б вирішували це питання. Сучасні принципи лікування ГК базуються не тільки на основі абсолютних цифр підвищення АТ, але і враховують наявність чи відсутність ураження того чи іншого органа-мішені. У будь-якому випадку (перед тим як розглянути темпи зниження АТ, що рекомендуються) незалежно від вихідного рівня АТ при терапії пацієнтів із ГК необхідно лікувати пацієнта, а не цифри.
Лікування неускладнених ГК
Більшість пацієнтів зі значним підвищенням АТ не мають ознак ураження органів-мішеней, тобто мають неускладнені ГК. Терапія таких хворих може проводитися амбулаторно, але з обов’язковим повторним контролем стану пацієнта протягом 24 годин. При неможливості такого контролю амбулаторно пацієнти повинні бути госпіталізовані. Хворого необхідно заспокоїти та розмістити в темному комфортному приміщенні. Рекомендоване повільне поступове зниження АТ (протягом 24–48 годин) шляхом перорального прийому антигіпертензивних препаратів. Швидке зниження АТ може призвести до порушення авторегуляції та спричинити значне зниження перфузії життєво важливих органів (мозок, серце, нирки), їх ішемії та розвитку інфаркту (Strandgaard S., 1973).
Швидке та значне зниження АТ є особливо небезпечним у пацієнтів старших вікових груп із супутнім периферичним атеросклерозом, відомим атеросклеротичним ураженням коронарних та мозкових судин, тобто з високим ризиком розвитку ішемічних ускладнень (Vaidya C.K., 2007).
Метою терапії хворих із неускладненими ГК є зниження АТ до 160/110 мм рт.ст. протягом декількох годин, сумарно швидкість зниження середнього АТ повинна становити не більше ніж 25 % протягом 24 годин. Більшість авторів не рекомендують застосовувати сублінгвальне та внутрішньом’язове введення антигіпертензивних препаратів у зв’язку з непередбаченим фармакодинамічним ефектом (Grossman E., Messerli F.H. еt al., 1996).
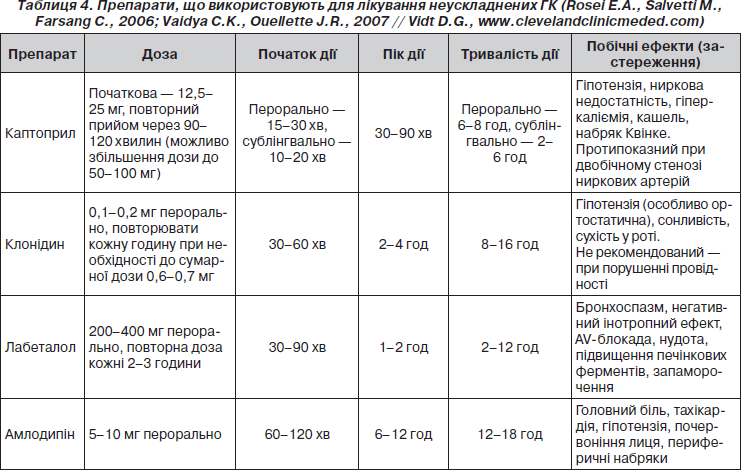
Найбільш часто для лікування неускладнених ГК використовують каптоприл, клонідин, лабеталол та амлодипін (табл. 4).
Застосування ніфедипіну короткої дії для лікування ГК протипоказано, оскільки швидкість та ступінь зниження АТ при його прийомі (особливо сублінгвально) тяжко контролювати, у зв’язку з чим підвищується ризик мозкової або коронарної ішемії (Rehman F., Mansoor G.A., White W.B., 1996; National Heart, Lung, and Blood Institute, 1995; Rosei E.A., Salvetti M. et al., 2006).
У разі вегетативних порушень ефективні седативні препарати, зокрема бензодіазепінові похідні, що можна використовувати per os або у вигляді внутрішньом’язових ін’єкцій, а також піроксан та дроперидол.
Лікування ускладнених ГК
Всі хворі з ускладненими ГК повинні госпіталізуватися до блоків кардіореанімації або відділення інтенсивної терапії з можливістю постійного моніторування параметрів центральної гемодинаміки та життєво важливих функцій. Антигіпертензивна терапія проводиться шляхом внутрішньовенного введення препаратів. Метою антигіпертензивної терапії при більшості ускладнених ГК є зниження рівня середнього АТ на 20–25 % протягом 1–2 годин. Треба уникати більш швидких темпів зниження АТ задля попередження ятрогенної мозкової, ниркової та/або коронарної ішемії (Chobanian A.V., Bakris G.L., Black H.R. et al., 2003).
Ці рекомендації базуються на особливостях авторегуляції мозкового, ниркового та коронарного кровотоку підтримувати сталий рівень перфузії при зниженні АТ у межах 20–25 % (Flanigan J.S., Vitberg D., 2006).
Якщо стан пацієнта залишається стабільним, можна продовжувати зниження систолічного АТ до 160 мм рт.ст. та діастолічного АТ (діастАТ) до 100–110 мм рт.ст. протягом наступних 2–6 годин. Метою терапії є зниження АТ до «робочих» (характерних для пацієнта) цифр протягом 24–48 годин лікування. Ретельний контроль симптомів і ознак можливого ішемічного ураження органів-мішеней на фоні зниження АТ повинен проводитися протягом усього періоду спостереження (Chobanian A.V., Bakris G.L., Black H.R. et al., 2003; National Heart Lung and Blood Institute, 2009).
Для лікування ускладнених ГК використовують ряд медичних препаратів, що належать до різних класів та мають різні механізми дії. Вибір антигіпертензивного препарату проводиться з урахуванням препарат-специфічних та пацієнт-специфічних факторів.
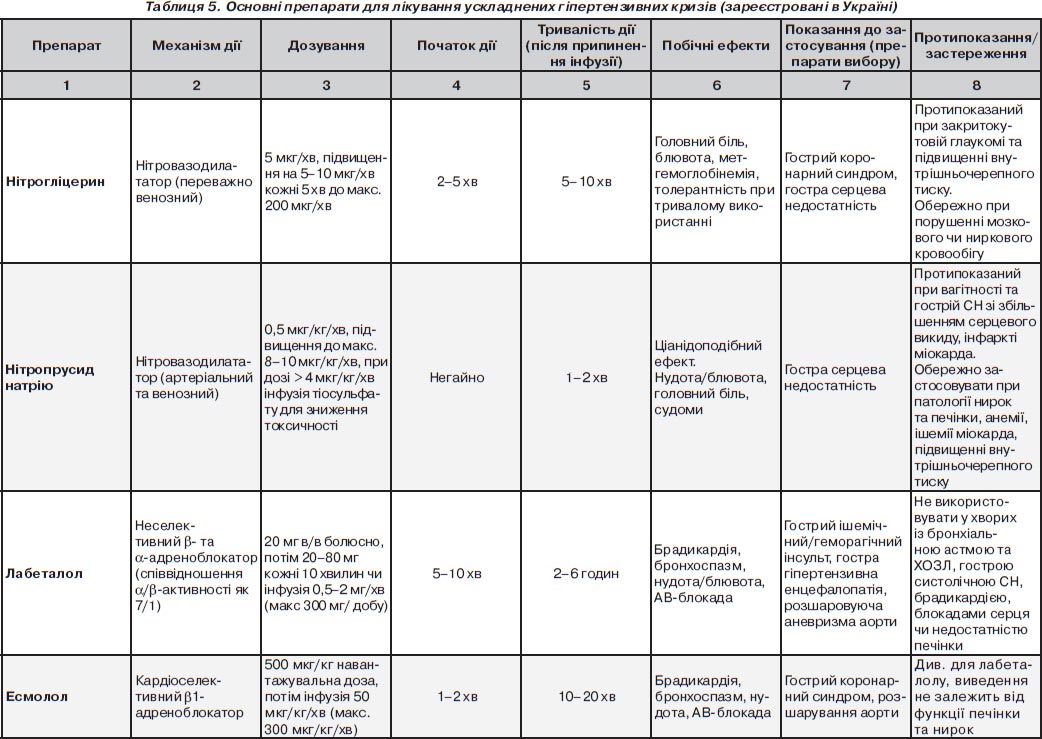
До препарат-специфічних факторів зараховують особливості фармакокінетики та фармакодинаміки препарату, а також можливі побічні ефекти та особливості введення препарату й контролю за його дією. «Ідеальний» антигіпертензивний препарат для лікування ускладненого ГК повинен вводитися внутрішньовенно, мати швидкий початок та припинення дії, легко титруватись, мати підтверджену ефективність, безпечність та прийнятну вартість. Сьогодні час в Україні зареєстрована обмежена кількість препаратів, що були схвалені для застосування при ускладнених ГК: нітрогліцерин, нітропрусид, лабеталол, есмолол, еналаприлат, урапідил. Основні характеристики препаратів подані в табл. 5.
При виборі антигіпертензивного препарату необхідно також враховувати ряд факторів із боку пацієнта, а саме — вік, расу, стать, можливість вагітності, ступінь зневоднення, ураження того або іншого органа-мішені та наявність супутніх захворювань. Як правило, пацієнти старшої вікової групи (> 65 років) більш чутливі до антигіпертензивної терапії, тому лікування цих хворих слід починати з менших доз. Функцію нирок та печінки визначає швидкість елімінації препаратів чи/та їх активних/токсичних метаболітів, тому їх важливо враховувати перед вибором препарату та його дози.
Основні характеристики, особливості використання та дозування, можливі побічні ефекти, а також цільові групи хворих для різних антигіпертензивних препаратів, що зареєстровані в Україні для лікування ускладнених ГК, наведені нижче.
Нітропрусид натрію
За своїми фармакодинамічними властивостями нітропрусид натрію належить до артеріальних та венозних вазодилататорів та здатний зменшувати як після-, так і переднавантаження (Friederich J.A., Butterworth J.F., 1995; Robin E.D., McCauley R., 1992). Цей препарат характеризується значною антигіпертензивною ефективністю, швидким початком та нетривалістю дії (період напіввиведення дорівнює 3–4 хв), тобто за фармакокінетичними особливостями наближується до ідеального засобу для лікування ускладненого ГК. Втім нітропрусид має ряд властивостей, що значно обмежують його використання. Це і можливість швидкого виникнення тахіфілаксії, і необхідність використання спеціальних заходів для попередження його деградації під дією світла, і утворення значної кількості цитотоксичних вільних радикалів у результаті надлишку оксиду азоту (Nakamura Y., Yasuda M., Fujimori H. et al., 1997; Gobbel G.T., Chan T.Y., Chan P.H., 1997), але найголовніше — загроза інтоксикації ціанідами.
Приблизно 44 % від загальної маси нітропрусиду становлять ціаніди, що вивільняються в організмі людини без участі ферментів (Pasch T., Schulz V., Hoppenshauser G., 1983). Вони блокують процеси клітинного дихання (Niknahad H., O’Brien P.J., 1996; Izumi Y., Benz A.M., Clifford D.B. et al., 1993), що може проявлятися в клініці «безпричинною зупинкою серця», розвитком коми, енцефалопатії, судом або необоротної вогнищевої неврологічної симптоматики (Vesey C.J., Cole P.V., Simpson P.J., 1976).
На сьогодні час немає достатньо чутливих та доступних методів моніторингу інтоксикації ціанідами (Pasch T., Schulz V., Hoppenshauser G., 1983). Тому нітропрусид натрію слід використовувати тільки за відсутності або неефективності інших антигіпертензивних препаратів, тривалість його введення повинна бути якомога коротшою, а швидкість інфузії — не перевищувати 2 мкг/кг/хв (Marik P.E., Varon J., 2007). Метаболізм ціанідів здійснюється в печінці за наявності достатньої кількості тіосульфату (Hall V.A., Guest J.M., 1992). Тіоціанат, що утворюється внаслідок цієї хімічної реакції, приблизно у 100 разів менш токсичний, ніж ціаніди. Він виводиться з організму людини переважно через нирки. Тому для знезараження та виведення ціанідів необхідна задовільна функція печінки, нирок та достатня кількість тіосульфату.
У разі необхідності застосування великих доз нітропрусиду натрію (від 4 до 10 мкг/кг/хв) або якщо тривалість інфузії перевищує 30 хвилин, рекомендують застосовувати введення тіосульфату натрію (Hall V.A., Guest J.M., 1992). Нітропрусид натрію в основному використовують у хворих із набряком легенів або при розшаровуючій аневризмі аорти, коли необхідно швидко та значно знизити рівень АТ. Препарат зменшує мозковий кровообіг та підвищує рівень внутрішньочерепного тиску, що значно обмежує його використання у хворих із неврологічними гіпертензивними станами (Hartmann A., Buttinger C., Rommel T. et al., 1989; Kondo T., Brock M., Bach H., 1984; Griswold W.R., Reznik V., Mendoza S.A., 1981; Anile C., Zanghi F., Bracali A. et al., 1981). У хворих з ІХС нітропрусид може викликати значне зменшення регіонального кровотоку (ефект обкрадання) (Mann T., Cohn P.F., Holman L.B., et al., 1978). У зв’язку зі збільшення летальності пацієнтів із гострим інфарктом міокарда його застосування в даної категорії хворих протипоказано (Cohn J.N., Franciosa J.A., Francis G.S. et al., 1982).
Нітрогліцерин
Нітрогліцерин, як і нітропрусид натрію, належить до нітровазодилататорів, але на відміну від останнього не має вираженого артеріального ефекту (проявляється лише у великих дозах) (Varon J., 2008) та впливає переважно на венозний тонус, зменшуючи переднавантаження серця. В умовах зниження об’єму циркулюючої крові, що є характерною рисою всіх (окрім набряку легенів) ускладнених ГК, це призводить до зменшення серцевого викиду та є небажаним у хворих із порушеннями мозкового та ниркового кровообігу. У деяких хворих за рахунок дефіциту ОЦК виникнення значної гіпотензії та рефлекторної тахікардії виявляли вже на початку терапії нітрогліцерином (Elkayam U., Kulick D., McIntosh N. et al., 1987). При лікуванні ускладненого ГК внутрішньовенну інфузію НГ слід починати зі швидкості 5 мкг/хв. Швидкість інфузії може збільшуватися на 5 мкг/хв кожні 3–5 хвилин до 20 мкг/хв. Якщо зниження АТ є недостатнім, подальше підвищення швидкості інфузії проводять на 10 мкг/хв кожні 3–5 хв. Максимальна швидкість інфузії — 200 мкг/хв. Досягнення хоча б часткового антигіпертензивного ефекту на будь-якому етапі змушує уповільнити темпи збільшення швидкості інфузії, рекомендовані вище (Rhoney D., Peacock W.F., 2009).
Фармакокінетика нітрогліцерину є дуже близькою до нітропрусиду натрію та наближується до ідеального антигіпертензивного засобу. Ефект препарату реєструється вже через 2–5 хв від початку інфузії та триває 5–10 хв після її закінчення.
Завдяки зменшенню переднавантаження, а також прямому коронаровазодилатуючому ефекту нітрогліцерин є препаратом вибору у пацієнтів із гострим коронарним синдромом (у більшості хворих сумісно з бета-адреноблокаторами) та гострою серцевою недостатністю (набряк легенів) (Van de Werf F., Bax J., Betriu A. et al., 2008).
Суттєвою проблемою при використанні нітрогліцерину є розвиток толерантності до його дії, яка в деяких випадках розвивається дуже швидко від початку застосування. (Hirai N., Kawano H., Yasue H. et al., 2003). Головний біль виникає приблизно у третини хворих і є найчастішим побічним ефектом, при тривалому використанні можливий розвиток метгемоглобінемії (Chobanian A.V., Bakris G.L., Black H.R. et al., 2003).
Есмолол
Есмолол є селективним блокатором b1-адренорецепторів ультракороткої дії. Як справжній b-адреноблокатор есмолол має негативний інотропний та хронотропний ефект та не впливає на тонус судин, що дозволяє використовувати його в комбінації з вазодилататорами. Введення препарату починають з дози 0,5–1,0 мг/кг протягом 1 хв з наступною інфузією зі швидкістю 50 мкг/кг/хв. За необхідності можливе збільшення швидкості інфузії до 300 мкг/кг/хв (Gray R.J., 1988). Ефект есмололу спостерігається вже через 1 хвилину (Varon J., Marik P.E., 2003). Препарат швидко метаболізується естеразами еритроцитів, тому дія препарату спостерігається лише протягом 10–20 хв (період напіввиведення 9 хв). (Singh P.P., Dimich I., Sampson I. et al., 1992). Метаболізм препарату не змінюється у хворих із порушеннями функції печінки та нирок, але може уповільнюватися при супутній анемії.
Есмолол використовують у пацієнтів із гострим коронарним синдромом та збереженою систолічною функцією ЛШ (Mooss A.N., Hilleman D.E., Mohiuddin S.M. et al., 1994; Van de Werf F., Bax J., Betriu A. et al., 2008), а також при розвитку періопераційної (особливо постопераційної) гіпертензії, коли відмічається підвищення ЧСС, АТ та серцевого викиду у відповідь на гіперсимпатикотонію (Balser J.R., Martinez E.A., Winters B.D. et al., 1998; Gray R.J., Bateman T.M., Czer L.S. et al., 1985; Muzzi D.A., Black S., Losasso T.J. et al., 1990; Mooss A.N., Hilleman D.E., Mohiuddin S.M. et al., 1994). Під час введення есмололу слід контролювати ЧСС, особливо у пацієнтів старших вікових груп. Есмолол завдяки негативному інотропному ефекту може спричинити прогресування симптоматики серцевої недостатності (Chobanian A.V., Bakris G.L., Black H.R. et al., 2003; Gray R.J., Bateman T.M., Czer L.S. et al., 1987). Незважаючи на досить високу кардіоселективність, есмолол необхідно обережно застосовувати в пацієнтів з обструктивними захворюваннями легенів, хоча декілька досліджень виявили добру переносимість препарату в цієї категорії хворих (Sheppard D., DiStefano S., Byrd R.C. et al., 1986). Протипоказаннями для застосування есмололу є брадикардія, блокади серця та декомпенсована серцева недостатність. Використання b-адреноблокаторів у вигляді монотерапії на фоні гіперсимпатикотонії може спричинити вторинну стимуляцію a-адренорецепторів за рахунок вивільнення надлишку катехоламінів. У цьому випадку спостерігається констрикція периферичних артерій, що супроводжується підвищенням рівня АТ та посиленням ішемії органів-мішеней, що може мати фатальні наслідки (Martin J.F., Higashiama E., Garcia E. et al., 2004).
Тому b-адреноблокатори не слід застосовувати у пацієнтів з ускладненими ГК на фоні інтоксикації кокаїном чи при феохромоцитомі (особливо перед використанням a-блокаторів) (Lange R.A., Cigarroa R.G., Flores E.D. et al., 1990).
Лабеталол
Лабеталол — це унікальний препарат, який має властивості неселективного b- та селективного a1-адреноблокатора. При внутрішньовенному використанні превалює b-блокуючий ефект (співвідношення a/b блокади як 1/7) (Kitiyakara C., Guzman N.J., 1998).
На відміну від справжніх b-блокаторів лабеталол майже не змінює серцевий викид та незначною мірою впливає на ЧСС, на відміну від a-блокаторів не викликає рефлекторної тахікардії. Препарат майже не впливає на мозковий кровообіг та не підвищує внутрішньочерепний тиск (Olsen K.S., Svendsen L.B., Larsen F.S. et al., 1995), а також не порушує нирковий і коронарний кровообіг, що дозволяє використовувати його при більшості ускладнених ГК (Pearce C.J., Wallin J.D. et al., 1994; Wallin J.D., 1985; Marx P.G., Reid D.S., 1979). Препарат за рахунок водорозчинних властивостей майже не проникає через гематоенцефалічний бар’єр, що є додатковою перевагою при лікуванні ГК у вагітних (Vigil-De Gracia P., Lasso M., Ruiz E. et al., 2006). З огляду на неселективність b-блокуючого ефекту лабеталол протипоказаний у хворих з обструктивними захворюваннями легенів. Препарат може посилювати симптоматику серцевої недостатності та погіршувати АВ-провідність (Grossman E., Ironi A.N., Messerli F.H., 1998).
Застосування лабеталолу починають із навантажувальної дози 20 мг, що вводиться внутрішньовенно болюсно. Надалі препарат використовують у вигляді повторних болюсних ін’єкцій від 20 до 80 мг з інтервалом у 10 хвилин до досягнення бажаного рівня АТ або у вигляді внутрішньовенної інфузії, починаючи зі швидкості 1–2 мг/хв і поступовим її збільшенням у разі неефективності (Rosei E.A., Trust P.M., Brown J.J. et al., 1975). Гіпотензивний ефект препарату починається через 2–5 хвилин, сягає максимуму через 5–15 хвилин та триває від 2 до 4 годин. Лабеталол знешкоджується у печінці шляхом зв’язування з глюкуроновою кислотою (Kanot J., Allonen H., Kleimola T. et al., 1981).
Еналаприлат
Еналаприл належить до інгібіторів ангіотензинперетворюючого ферменту (АПФ), що перешкоджають утворенню сильного вазоконстриктора ангіотензину ІІ з ангіотензину І. Частково ефект цих препаратів також обумовлений вазодилатуючим ефектом брадикініну, рівень якого підвищується в результаті блокади АПФ (Barbe F., Su J.B., Guyene T.T. et al., 1996). Призначення інгібіторів АПФ пацієнтам з артеріальною гіпертензією призводить до зниження загального периферичного опору практично без впливу на ЧСС, величину серцевого викиду та тиск заклинювання легеневої артерії (McAreavey D., Robertson J.I., 1990). Еналаприл використовують у дозі 1,25 мг (в/в введення протягом 5 хвилин) кожні 6 годин. Зважаючи на фармакокінетичні характеристики еналаприл тільки умовно можна зарахувати до препаратів для лікування ускладнених ГК. Він характеризується тривалим часом до початку (15–30 хвилин) і піку (до 4 годин) гіпотензивного ефекту та значною тривалістю дії (12–24 години), що, з одного боку, не дозволяє у короткий термін досягнути бажаного ефекту, з іншого, ускладнює ведення хворих при розвитку гіпотензії. Більший гіпотензивний ефект еналаприлу спостерігається в пацієнтів із високим рівнем ангіотензину ІІ та підвищеною активністю реніну в плазмі крові (Hirschl M.M., Binder M., Bur A. et al., 1997). Саме ця категорія хворих потребує ретельного моніторування АТ задля попередження гіпотензії. Максимальна доза еналаприлу 5 мг в/в кожні 6 годин. Початкова доза еналаприлу в пацієнтів, які приймають діуретики, та в пацієнтів з порушенням функції нирок (кліренс креатиніну ≤ 30 мл/хв) повинна бути знижена до 0,625 мг. При недостатній ефективності вводять повторно 0,625 мг еналаприлу через 1 годину і потім 1,25 мг кожні 6 годин.
Еналаприл використовують, як правило, як препарат другого ряду в пацієнтів із декомпенсованою серцевою недостатністю та у хворих із неврологічними гіпертензивними станами, а також у пацієнтів із неускладненими ГК (Gomez Angelats E., Bragulat Baur E., 2010; Marik P.E., Varon J., 2007). Внутрішньовенне введення еналаприлу не рекомендоване у пацієнтів із гострим ІМ та білатеральним стенозом сонних артерій. Інгібітори АПФ протипоказані при вагітності, тому не використовуються для лікування еклампсії та преекламсії.
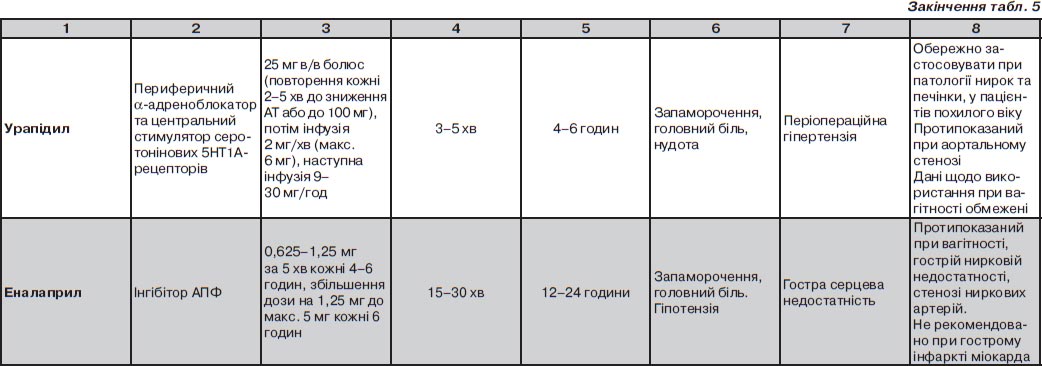
Урапідил
Антигіпертензивна активність урапідилу обумовлена зниженням судинного опору за рахунок блокади периферичних a1-адренорецепторів та центральної симпатолітичної дії, що реалізується через активацію серотонінових 5НТ1А-рецепторів довгастого мозку (van Zwieten P.A., Blauw G.J., van Brummelen P., 1990). Ефект препарату при внутрішньовенному введенні починається через 2–5 хвилин та триває від 4 до 6 годин (Buch J. Urapidil, 2010) Період напіввиведення урапідилу — 2,7 години. На відміну від інших вазодилататорів за рахунок центральних механізмів дії урапідил не викликає розвитку рефлекторної тахікардії у відповідь на зниження АТ (van der Stroom J., van Wezel I., Vergroesen J. et al., 1996). Припускають, що в реалізації цього ефекту також має значення ваготонічний (підвищення активності блукаючого нерва) ефект препарату (Fozard J., Mir A., 1987). Урапідил не порушує мозковий (Wьsten R., Hemelrijck J., Mattheussen M. et al., 1990), нирковий (de Leeuw P.W, van Es P.N., de Bruyn H.A. et al., 1988; Lavrijssen A.T., Kroon A.A., Fuss-Lejeune M. et al., 2000) чи коронарний кровообіг (Gregorini L., Marco J., Kozakova M. et al., 1999), не впливає на рівень внутрішньочерепного тиску (Wьsten R., Hemelrijck J., Mattheussen M. et al., 1990), має нейропротекторні властивості (Prehn J.H., Backhauss C., Karkoutly C. et al., 1991) та не погіршує функцію ЛШ (Gregorini L., Marco J., Palombo C. et al., 1998; Kozakova M., Marco J., Heusch G. et al., 2004). Це дозволяє використовувати препарат для лікування ускладнених ГК з ураженням різних органів-мішеней. Найбільш вивченим є використання препарату для лікування періопераційної гіпертензії (Olmos M., Vidarte M.A., Ballester J.A. et al., 1981; Gцb E., Barankay A., Richter J.A., 1981; Hess W., 990; Puchstein C., Van Aken H., Zander J. et al., 1984; Gosse P., Tauzin-Fin P., Sesay M.B. et al., 2009), контролю АТ у хворих на геморагічний інсульт (Anderson C.S., Huang Y., Wang J.G. et al., 2008), гострий набряк легенів (на догоспітальному етапі) (Schreiber W., Woisetschlager C., Binder M. et al., 1998). Незважаючи на обмежений досвід застосування у вагітних (Wacker J., Werner P., Walter-Sack I., Bastert G., 1998; Wacker J.R., Wagner B.K., Briese V. et al., 2006; Schulz M., Wacker J., Bastert G., 2001). У деяких країнах (Франція, Німеччина, Австрія) урапідил рекомендований як препарат вибору для зниження АТ у комплексній терапії прееклампсії та еклампсії.
Введення препарату починають з внутрішньовенного болюсу 25 мг. При неадекватному ефекті болюсне введення в дозі 25 мг повторюють кожні 2–5 хвилин до досягнення бажаного рівня АТ чи сумарної дози препарату 100 мг. Потім урапідил вводиться крапельно, починаючи зі швидкості 1–3 мг/хв, після введення 6 мг препарату — швидкість зменшується для підтримання необхідного рівня АТ (у середньому 10 мг/год).
Препарат добре переноситься. Найчастішими побічними явищами (1–2 % хворих) є шлунково-кишкові розлади, стомленість, головний біль та серцебиття (Zanchetti A., 1995). Урапідил слід обережно застосовувати у пацієнтів похилого віку, з супутньою патологією печінки та нирок. Протипоказаний при аортальному стенозі.
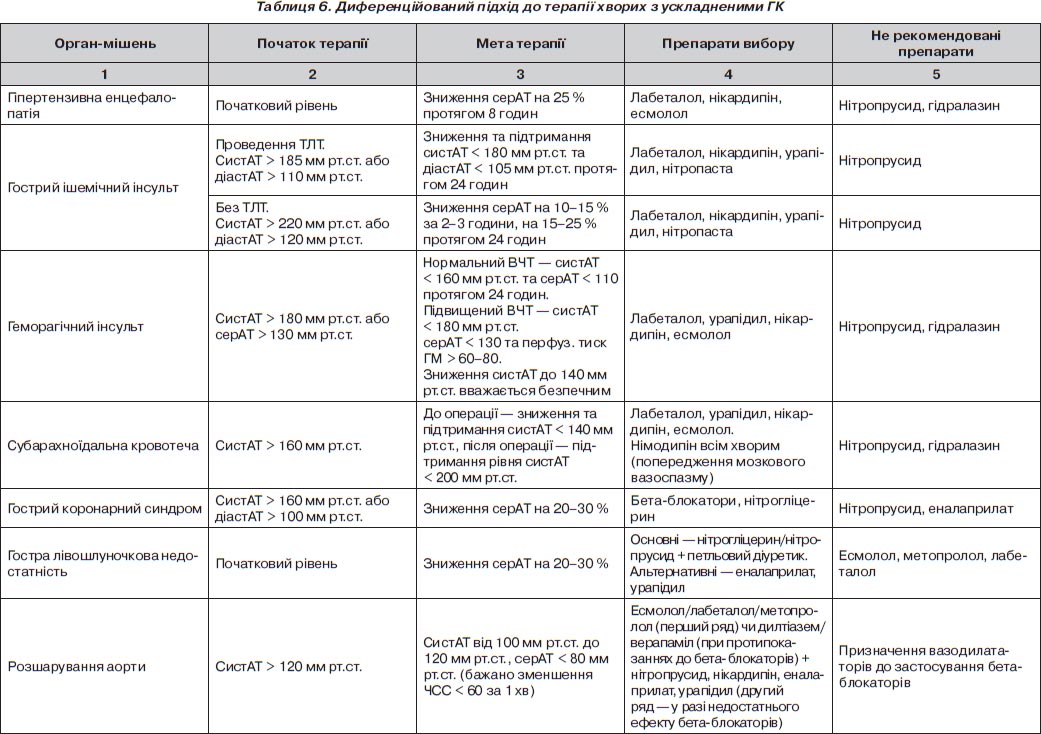
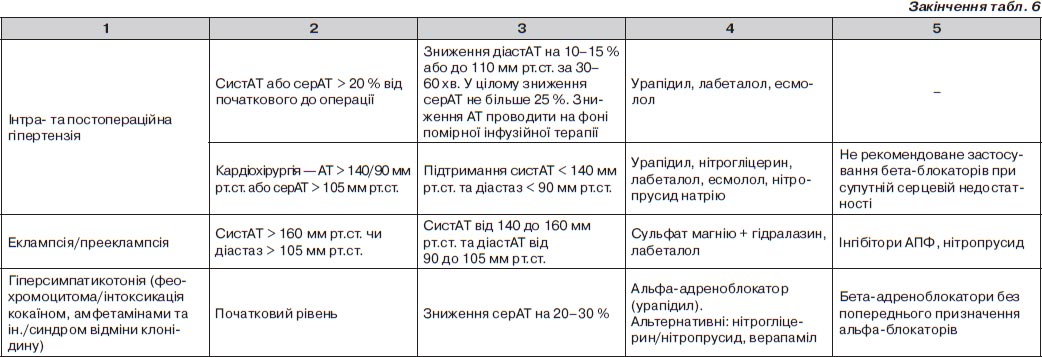
Особливості корекції АТ при ускладнених ГК залежно від ураження органа-мішені
Гострий коронарний синдром
Часто у хворого з ГКС та підвищеним рівнем АТ дуже тяжко визначити, чи це підвищення первинне (причина ГКС), чи розвинулося у відповідь на гостре порушення коронарного кровообігу. Але підходи до контролю АТ у більшості випадків є однаковими і визначаються рівнем АТ на момент оцінки та до розвитку ГКС, наявністю ускладнень ГКС (гостра серцева недостатність, механічні ускладнення та ін.) та ураження інших органів мішеней.
Специфічну антигіпертензивну терапію слід починати при підвищенні систАТ > 160 мм рт.ст. та/або діастАТ > 100 мм рт.ст. Метою терапії є зниження середнього АТ на 20–30 % протягом години (Diercks D.B., Ohman E.M., 2008). Проведення тромболітичної терапії можливе тільки, якщо рівень АТ знаходиться у межах < 185/110 мм рт.ст. (Van de Werf F., Bax J., Betriu A. et al., 2008). Препаратами вибору для контролю АТ у хворих із ГКС є нітрогліцерин та b-адреноблокатори.
Нітрогліцерин знижує гемодинамічне навантаження на серце (в основному переднавантаження), зменшує його потреби в кисні та енергетичні затрати, розширює коронарні судини, що, окрім зниження АТ, забезпечує додатковий клінічний ефект при гострій ішемії міокарда та робить НГ препаратом вибору у цих хворих. Втім перед призначенням нітропрепаратів у хворого слід з’ясувати, чи приймав він інгібітори 5-фосфодіестерази. Призначення нітратів на фоні препаратів цієї групи може спричинити розвиток значної гіпотензії, тому протягом 24 (силденафіл) — 48 годин (тадалафіл) від останнього прийому інгібіторів 5-фосфодіестерази використання нітропрепаратів протипоказане (Kloner R.A., Hutter A.M., Emmick J.T. et al., 2003).
Альтернативою нітрогліцерину можуть виступати b-адреноблокатори. Існують деякі суперечки щодо можливості раннього внутрішньовенного призначення препаратів цієї групи пацієнтам із гострим інфарктом міокарда. Декілька досліджень виявили зниження летальності хворих (Randomised trial of intravenous atenolol among 16 027 cases of suspected acute myocardial infarction: ISIS-1, 1986; Hjalmarson A., Herlitz J., Holmberg S. et al., 1983), зменшення розміру ІМ (Reduction of infarct size by the early use of intravenous timolol in acute myocardial infarction. International Collaborative Study Group, 1984; Jurgensen H.J., Andersen M.P., Bechsgaard P. et al., 1984; Galcera-Tomas J., Castillo-Soria F.J., Villegas-Garcia M.M. et al., 2001). Попередження порушень серцевого ритму та зменшення кількості реінфарктів при ранньому внутрішньовенному призначенні b-адреноблокаторів (Herlitz J., Edvardsson N., Holmberg S. et al., 1984). Найбільший ефект спостерігався у пацієнтів без елевації сегмента ST (Herlitz J., Hjalmarson A., Swedberg K. et al., 1988). Втім за результатами найбільшого дослідження COMMIT (45 852 хворих) внутрішньовенне призначення метопрололу (особливо в перші 24 години) у хворих із ГКС з елевацією сегмента ST (окрім попередження реінфарктів та порушень серцевого ритму) достовірно збільшувало ризик кардіогенного шоку (Chen Z.M., Pan H.C., Chen Y.P. et al., 2005). Тому на сьогодні у пацієнтів із ГКС тільки значне підвищення АТ та розвиток тахіаритмій є показанням для застосування внутрішньовенних b-адреноблокаторів (O’Connor R.E., Brady W., Brooks S.C. et al., 2010). Протипоказннями для призначення b-адреноблокаторів є помірна або виражена серцева недостатність та набряк легенів, брадикардія (< 60 за 1 хв), ознаки порушення периферичного кровообігу, АВ-блокада 2-го чи 3-го ступеня або обструктивне захворювання легенів.
Інгібітори АПФ рекомендовані всім хворим із гострим ІМ за відсутності протипоказань вже з першої доби захворювання (GISSI-3, 1994; the Chinese Cardiac Study, 1995; ACE Inhibitor Myocardial Infarction Collaborative Group, 1998).
Втім внутрішньовенне введення еналаприлу цим хворим у дослідженні CONSENSUS II супроводжувалося збільшенням летальності, що, імовірне було пов’язано з розвитком гіпотензії (Swedberg K., Held P., Kjekshus J. et al., 1992).
Тому призначення внутрішньовенних інгібіторів АПФ у хворих із ГКС (у тому числі і для лікування ГК) протипоказане.
Гострий набряк легенів
Приблизно 50 % пацієнтів з гострим набряком легенів мають підвищені цифри АТ (систолічний АТ > 140 мм рт.ст.). У частини хворих така гіпертензивна реакція не є первинною, а розвивається у відповідь на задишку, збудження та/або стенокардитичний біль. Тому таким хворим треба налагодити оксигенотерапію, заспокоїти та забезпечити адекватне знеболення. Препаратом вибору в цьому випадку є морфін, що має також деякі інші позитивні ефекти у хворих із ГНЛ. Метою подальшого лікування цієї категорії хворих є зниження перед- і післянавантаження та забезпечення достатнього діурезу. Зниження АТ дозволяє зменшити потреби серця в кисні та підвищити серцевий викид. При ГНЛ зниження АТ необхідно проводити терміново та швидко. Препаратами вибору є нітрогліцерин та нітропрусид натрію, що використовуються на фоні сечогінної терапії (Elliott W.J., 2006; Van de Werf F., Bax J., Betriu A. et al., 2008).
Схеми введення препаратів подані в табл. 5.
В одному нерандомізованому відкритому дослідженні була продемонстрована перевага використання високих доз нітрогліцерину (повторні болюсні ін’єкції 2 мг кожні 3 хв) для зниження АТ над стандартною схемою (внутрішньовенна інфузія) у хворих із ГНЛ на фоні ГК (систАТ ≥ 160 мм рт.ст. або серАТ ≥ 120 мм рт.ст.) (Levy P., Compton S., Welch R. et al., 2007).
Група агресивного лікування характеризувалася значно меншою необхідністю госпіталізації до відділення інтенсивної терапії (37,9 проти 80,0 %), проведення інтубації (13,8 проти 26,7 %) та меншою частотою підвищення рівня тропоніну (17,2 проти 28,9 %). На відміну від жодного випадка в групі стандартної терапії в одного хворого (3,4 %) з групи активного лікування було відмічено розвиток симптоматичної гіпотензії. Тому така схема застосування нітрогліцерину може використовуватися тільки після ретельного виваження можливих користі і ризику та потребує подальшого підтвердження.
Альтернативою нітровазодилататорам для зниження АТ у хворих з ГНЛ може бути застосування урапідилу. Цей препарат на відміну від інших вазодилататорів не викликає розвиток рефлекторної тахікардії (van der Stroom J., van Wezel I., Vergroesen J. et al., 1996), що особливо важливо у хворих із гострою серцевою недостатністю. У дослідженні NITURA використання урапідилу (на фоні оксигенотерапії, морфіну та діуретиків) на догоспітальному етапі у хворих з ГК, які ускладнені ГНЛ, супроводжувалося значнішим зниженням АТ та суттєвішим покращенням респіраторних та метаболічних показників, ніж застосування сублінгвального нітрогліцерину (Schreiber W., Woisetschlager C., Binder M. et al., 1998).
Гостра дисекція аорти
Дисекція аорти (ДАо) — це невідкладний кардіологічний стан, що характеризується ушкодженням середнього шару аорти (медія) у вигляді його сепарації з наступним проникненням і поширенням крові вздовж аортальної стінки. У більшості випадків (90 % хворих) проникнення крові в стінку аорти відбувається через пошкодження її внутрішнього шару (інтима) напряму або за рахунок пенетрації атеросклеротичної виразки (Hiratzka L.F., Bakris G.L., Beckman J.A. et al., 2010), але можливе також первинне утворення гематоми у середньому шарі аорти в результаті кровотечі з vasa vasorum (O’Gara P.T., DeSanctis R.W., 1995; Nienaber C.A., Sievers H.H., 2002).
Прогноз хворих із ДАо є дуже несприятливим — до 40 % хворих помирає миттєво, потім летальність становить близько 1 % хворих протягом кожної наступної години та 5–20 % під час або ж одразу після оперативного втручання (Anagnostopoulos C.E., Prabhakar M.J., Kittle C.F., 1972; HIirst A.E. Jr., Johns V.J. Jr, Kime S.W. et al., 1958; Masuda Y., Yamada Z., Morooka N. et al., 1991).
Тому при ДАо своєчасна діагностика та швидкий початок терапії мають дуже важливе значення. Підходи до лікування гострої дисекції грудної аорти залежать від її анатомічного розташування. За класифікацією Стенфорда, виділяють 2 типи ДАо: тип А — включає всі дисекції, які залучають висхідну аорту, та тип В — всі дисекції без ураження висхідної частини аорти (Hiratzka L.F., Bakris G.L., Beckman J.A. et al., 2010).
Коливання АТ є дуже частим явищем у цієї категорії пацієнтів. За даними регістру IRAD, 71 % хворих із дисекцією типу В та 36 % хворих із дисекцією типу А мають підвищення систАТ понад 150 мм рт.ст. (Suzuki T., Mehta R.H., Ince H. et al., 2003; Trimarchi S., Nienaber C.A., Rampoldi V. et al., 2006).
Навпаки, приблизно 20 % хворих при госпіталізації мають стійку гіпотензію чи симптоми шоку (Klompas M., 2002). Саме ця категорія хворих характеризується найгіршим прогнозом (Tsai T.T., Bossone E., Isselbacher E.M. et al., 2005). Часткова оклюзія основних гілок аорти (у тому числі підключичних артерій) за рахунок дисекції може бути причиною помилково низьких результатів при вимірюванні АТ. Тому вимірювання слід обов’язково проводити на обох руках та обох ногах пацієнта.
Основою початкового етапу у веденні хворих із ДАо є попередження подальшого розшарування за рахунок зменшення гемодинамічного стресу та одночасне визначення хворих, які потребують хірургічного або ендоваскулярного втручання.
Для вирішення першого питання необхідно пам’ятати, що поширення дисекції обумовлене не тільки рівнем АТ, але й параметрами роботи лівого шлуночка, а саме швидкістю його скорочення (dP/dt) та ЧСС. Тому бета-адреноблокатори (есмолол, лабеталол метопролол чи пропранолол), що впливають на всі перераховані вище компоненти патогенезу, є препаратами вибору для лікування хворих із ДАо. Метою терапії є зниження ЧСС до менше ніж 60 ударів за хвилину та підтримання систолічного АТ у межах від 100 до 120 мм рт.ст. (Tsai T.T., Nienaber C.A., Eagle K.A., 2005).
У пацієнтів із відносними протипоказаннями для використання бета-адреноблокаторів (астма, серцева недостатність, ХОЗЛ та ін.) препаратом вибору може бути есмолол, що характеризується надзвичайно малим періодом напіввиведення. При непереносимості бета-блокаторів прийнятною альтернативою може бути застосування недигідропіридинових антагоністів кальцію (верапаміл, дилтіазем). Втім зниження ЧСС у хворих зі значною аортальною регургітацією повинно проводитись дуже обережно, оскільки може спровокувати розвиток гострої серцевої недостатності.
Використання бета-блокаторів у більшості випадків не дозволяє адекватно контролювати рівень АТ, тому рекомендоване застосування вазодилататорів (Suzuki T., Mehta R.H., Ince H. et al., 2003; Tsai T.T., Fattori R., Trimarchi S. et al., 2006; Khoynezhad A., Plestis K.A., 2006). В одному дослідженні пацієнти з ДАо для цільового зниження АТ у середньому потребували призначення 4 різних антигіпертензивних препаратів (Eggebrecht H., Schmermund A., von Birgelen C. et al., 2005). Задля цього може використовуватися внутрішньовенне введення нітропрусиду натрію, нітрогліцерину, нікардипіну та ряду інших антигіпертензивних засобів (Hiratzka L.F., Bakris G.L., Beckman J.A. et al., 2010).
Втім треба пам’ятати, що призначення вазодилататорів перед бета-адреноблокаторами є дуже небезпечним та може спровокувати розвиток рефлекторної тахікардії і підвищення сили серцевих скорочень, які є факторами ризику подальшого розшарування (Erbel R., Engberding R., Daniel W. et al., 1989).
Адекватна аналгезія на фоні внутрішньовенного введення опіатів дозволяє значно підвищити ефективність антигіпертензивної терапії передусім за рахунок зменшення симпатичної активації.
Всім пацієнтам у випадку розшарування аорти необхідна консультація кардіохірурга для визначення необхідності хірургічного лікування (Hiratzka L.F., Bakris G.L., Beckman J.A. et al., 2010). За умови відсутності тяжкої супутньої патології хірургічне втручання показане всім хворим із дисекцією типу А (Hagan P.G., Nienaber C.A., Isselbacher E.M. et al., 2000).
Пацієнти з розшаруванням аорти типу В потребують інтенсивної медикаментозної терапії. Операція в цьому випадку проводиться тільки за неможливості стабілізувати стан хворого (прогресування дисекції, синдром недостатньої перфузії, нестабільність гемодинаміки та ін.) (Suzuki T., Mehta R.H., Ince H., et al., 2003; Mehta R.H., O’Gara P.T., Bossone E., et al., 2002; Estrera A.L., Miller C.C. III, Safi H.J. et al., 2006; Umana J.P., Lai D.T., Mitchell R.S. et al., 2002; Mehta R.H., Suzuki T., Hagan P.G. et al., 2002).
Після стабілізації стану за рахунок хірургічного втручання та внутрішньовенної антигіпертензивної терапії, більшість хворих з ДАо потребують призначення тривалої антигіпертензивної терапії. Ця терапія окрім бета-блокатора повинна включати інгібітор АПФ або блокатор рецепторів до ангіотензину, застосування яких може зменшити подальшу дилатацію аорти (Hiratzka L.F., Bakris G.L., Beckman J.A. et al., 2010).
Гостра гіпертензивна енцефалопатія
Гостра гіпертензивна енцефалопатія (ГГЕ) — це невідкладний стан, зумовлений гострим набряком головного мозку на фоні гіпертензивного кризу та характеризується розвитком минучої неврологічної (в основному загальномозкової) симптоматики. ГГЕ займає проміжне положення між неускладненим гіпертензивним кризом і гострим інсультом та діагностується тільки в разі виключення останнього.
Розвиток ГГЕ, як правило, спостерігається в пацієнтів із тривалим анамнезом артеріальної гіпертензії. Порушення авторегуляції мозкового кровотоку у цих хворих призодить до збільшення проникності гематоенцефалічного бар’єру у відповідь на значне підвищення АТ (Immink R.V., van den Born B.J., van Montfrans G.A. et al., 2004). При цьому виникають умови для фільтрації плазми крові до тканин мозку та розвитку його вазогенного набряку. Погіршення реологічних властивостей крові за рахунок зменшення її рідкої частини та компресія мікроциркуляторного русла набряклими тканинами призводить до виникнення ділянок ішемії головного мозку. Подальше пошкодження та некроз артеріол на фоні значного підвищення АТ є причиною їх паретичного розширення та посилення набряку головного мозку, що обумовлює клінічну картину захворювання (Healton E.B., Brust J.C., Feinfeld D.A. еt al., 1982). Провідним клінічним симптомом ГГЕ є головний біль. У більшості випадків головний біль супроводжується нудотою, блювотою, вестибулярними (запаморочення, нестійкість, відчуття похитування) та/або зоровими (фотопсії, випадіння полів зору) порушеннями, судорожним синдромом. На відміну від інсульту стійких вогнищевих неврологічних симптомів не спостерігається, але можливий розвиток минучої розсіяної дрібновогнищевої симптоматики (оніміння чи парестезії кінцівок, язика, губ, слабкість у кінцівках та ін.), зумовленої вогнищевою ішемією головного мозку. Тяжкість стану хворого з ГГЕ визначається рівнем порушення свідомості, який може змінюватися від незначного (кволість, сплутаність) до розвитку коми (Верещагин Н.В., Суслина З.А., Максимова М.Ю., 2004; Tsou T.P., Yen Z.S., Fang C.C. et al., 2004).
ГГЕ — це діагноз, що встановлюють шляхом виключення інших можливих причин для виникнення неврологічної симптоматики (насамперед ішемічного та геморагічного інсультів, субарахноїдальної кровотечі, новоутворення та ін.). Дуже важливо швидко та правильно встановити діагноз ГГЕ, оскільки підходи до зниження АТ при різних неврологічних невідкладних станах різні. Тому, окрім обов’язкового огляду невролога й офтальмолога (Amraoui F., van Montfrans G.A., van den Born B.J., 2009), цим хворим якнайшвидше рекомендовано проведення магнітно-резонансної (краще) чи комп’ютерної томографії. Ознаки набряку головного мозку за відсутності його вогнищевого ураження, травми чи крововиливу є підтвердженням діагнозу ГГЕ (Schilling S., Hartel C., Gehl H.B. еt al., 2003). Механізми авторегуляції забезпечують відносно сталий рівень мозкового кровотоку в умовах значних коливань параметрів центральної гемодинаміки (рис. 2). Морфофункціональна перебудова мозкових артерій у пацієнтів зі стійкою артеріальною гіпертензією призводить до зміщення кривої авторегуляції вправо. Це дозволяє, з одного боку, пристосовуватися до значних підвищень АТ без суттєвих змін у рівні мозкового кровотоку, але, з іншого боку, призводить до виникнення ішемії при швидкому або значному зниженні АТ (Immink R.V., van den Born B.J., van Montfrans G.A. et al., 2004; Strandgaard S., Olesen J., Skinhoj E., Lassen N.A., 1973).
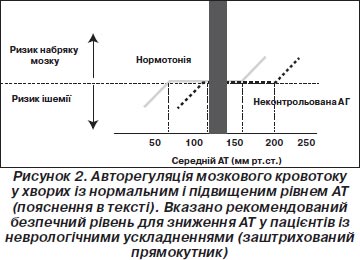
Тому в пацієнтів із ГГЕ (особливо при тривалому гіпертензивному анамнезі) рекомендований поміркований підхід до ступеня та швидкості зниження рівня АТ. Вважається, що зниження середнього АТ на 25 % протягом 8 годин або діастолічного АТ до 100–110 мм рт.ст. є досить безпечним та дозволяє повернутися в межі авторегуляції (Pancioli A.M., 2008). Фармакологічні препарати для зниження АТ у хворих із ГГЕ не повинні мати побічних ефектів зі сторони центральної нервової системи. Як початкову терапію часто використовують лабеталол. Використовують також урапідил, есмолол, нікардипін. Не рекомендовано застосовувати нітропрусид та гідралазин. Нітропрусид може застосовуатися тільки при неефективності інших препаратів (Pancioli A.M., 2008). Препаратами вибору для лікування набряку мозку є салуретики (фуросемід, торасемід). На відміну від осмодіуретиків ці препарати не призводять до відстроченого підвищення внутрішньочерепного тиску внаслідок гіперосмолярності. Також не втратило актуальності введення сульфата магнію, який окрім зниження АТ справляє седативний та протисудомний ефекти (Верещагин Н.В., Суслина З.А., Максимова М.Ю., 2004).
Iшемічний інсульт
У більшості пацієнтів з гострим ішемічним інсультом спостерігається суттєве підвищення АТ у перші години захворювання з подальшим його мимовільним зниженням протягом наступних декількох діб (Britton M., Carlsson A., de Faire U., 1986; Jorgensen H.S., Nakayama H., Christensen H.R. et al., 2002).
Підвищення АТ може бути обумовлено стресовою реакцією на розвиток порушення мозкового кровообігу, нудотою, болем, попередньою артеріальною гіпертензією, відповіддю на гіпоксію або підвищення внутрішньочерепного тиску (Phillips S.J., 1994; Johnston K.C., Mayer S.A., 2003). У механізмах розвитку гострої гіпертензивної реакції при порушенні мозкового кровообігу також суттєву роль відіграє порушення барорефлексу (Sykoraa M., Diedlera J., Polia S. et al., 2010). Залежність перебігу ГІІ від рівня АТ до кінця не з’ясована. У деяких дослідженнях був підтверджений зв’язок між підвищенням вихідного рівня АТ та несприятливим перебігом захворювання (Willmot M., Leonardi-Bee J., Bath P.M., 2004; Carlberg B., Asplund K., Hagg E., 1993), у деяких такої залежності не виявлялось, вказуючи на те, що підвищення АТ при ГІІ має протективний характер і направлено на підтримання адекватного внутрішньомозкового кровотоку, особливо в періінфарктній зоні (Jorgensen H.S., Nakayama H., Raaschou H.O. et al., 1994; Aslanyan S., Fazekas F., Weir C.J. еt al., 2003; Semplicini A., Maresca A., Boscolo G. et al., 2003).
Згідно з іншими дослідженнями, ця залежність мала U-подібний характер, тобто ускладнення частіше спостерігались у пацієнтів із дуже високими й низькими цифрами АТ (Leonardi-Bee J., Bath P.M., Phillips S.J. et al., 2002; Vemmos K.N., Tsivgoulis G., Spengos K. et al., 2004; Castillo J., Leira R., Garcia M.M. et al., 2004).
Так, у дослідженні Stead та співавт. спостерігали збільшення летальності серед хворих із рівнем систолічного АТ < 155 мм рт.ст. і > 220 мм рт.ст. та рівнем діастолічного АТ < 70 мм рт.ст. і > 105 мм рт.ст. (Stead L.G., Gilmore R.M., Decker W.W. et al., 2005). Продемонстровано також взаємозв’язок несприятливого прогнозу зі збільшенням пульсового АТ (Aslanyan S., Weir C.J., Lees K.R.; GAIN International Steering Committee and Investigators. 2004).
Теоретично приводом для зниження АТ при ГІІ є можливість зменшення набряку головного мозку, попередження геморагічної трансформації та профілактика подальшого судинного пошкодження. Негайне зниження АТ необхідно також при ураженні інших органів-мішеней чи розвитку гіпертензивної енцефалопатії (Johnston K.C., Mayer S.A., 2003; Kaplan N.M., 1994).
З іншого боку, агресивне зниження АТ може призвести до погіршення неврологічної симптоматики за рахунок зниження перфузії ішемізованих ділянок ГМ, що утворюються навколо основного вогнища (Goldstein L.B., 2004; Powers W.J., 1993).
Більшість досліджень, у яких перевіряли ефективність раннього агресивного зниження АТ у пацієнтів із ГІІ зазнали невдачі. Причому негативні наслідки швидкого зниження АТ у цієї категорії пацієнтів не залежали від того, використовували для цього специфічні антигіпертензивні препарати, чи ні. Так, Oliveira-Filho і співавт. продемонстрували зниження АТ в середньому на 28 % протягом першої доби гострого ішемічного інсульту незалежно від використання гіпотензивних препаратів, при цьому кожні 10 % зниження АТ призводило майже до подвоєння кількості ранніх ускладнень (Oliveira-Filho J., Silva S.C., Trabuco C.C. et al., 2003). У дослідженні Castillo та співавт. погіршення неврологічної симптоматики, збільшення розміру вогнища ураження та кількості несприятливих подій, враховуючи смерть, асоціювались зі зниженням як систолічного, так і діастолічного АТ більше ніж на 20 мм рт.ст. (Castillo J., Leira R., Garcia M.M. et al., 2004).
У рандомізованому багатоцентровому дослідженні INWEST несприятливий ефект німодипіну при ГІІ був пов’язаний саме зі зниженням АТ на фоні його прийому (Ahmed N., Wahlgren N.G., 2003; Wahlgren N.G., MacMahon D.G., DeKeyser J. et al., 1994).
У той же час при застосуванні інших препаратів (інгібітор АПФ та бета-блокатор) у дослідженні CHHIPS зниження АТ у пацієнтів із ГІІ не призвело до погіршення результатів лікування, а навіть знижувало летальність. 179 хворих до 36 годин від початку симптоматики ГІІ та АТ ≥ 160 мм рт.ст. починали отримувати лізиноприл, лабеталол чи плацебо. Дози препаратів збільшувалися до досягнення цільових значень систолічного АТ 145–150 мм рт.ст. чи його зниження на 15 мм рт.ст. У результаті лікування рівень систолічного АТ був значно нижчий в активній групі, ніж у групі контролю, як через 24 години, так і через 2 тижні від моменту рандомізації. Не було виявлено відмінностей між групами за частотою розвитку серйозних побічних явищ протягом дослідження, погіршення неврологічної симптоматики у перші 72 години, а також смерті/недієздатності через 2 тижні від початку лікування. У дослідженні була виявлена тенденція до зниження смерті від усіх причин через 3 місяці спостереження у групі активного лікування (9,7 проти 20,0 %, p = 0,05) (Potter J., Mistri A., Brodie F. et al., 2009).
У дослідженні COSSACS (763 пацієнти) було продемонстровано, що продовження антигіпертензивної терапії у гостру фазу ГІІ призводить до значного зниження АТ, але не зменшує вірогідність розвитку смерті/недієздатності через 2 тижні спостереження, а також не впливає на кількість серйозних побічних явищ та основних серцево-судинних подій протягом 6 місяців (Robinson T.G., Potter J.F., Ford G.A. et al., 2010). Зменшення смерті та несприятливих судинних подій після гострого інсульту було продемонстровано у дослідженні ACCESS із застосуванням блокатора рецепторів ангіотензину II кандесартану. Кандесартан призначали з першої доби гострого ішемічного інсульту з поступовим збільшенням дози препарату при рівні АТ > 160 мм рт.ст. (систол.) чи > 100 мм рт.ст. (діастол.), а з 7-ї доби в разі необхідності додавали інші антигіпертензивні засоби. При дуже високих цифрах АТ застосовували невідкладну внутрішньовенну його корекцію. Але позитивні ефекти кандесартану не спостерігали протягом перших місяців лікування, а достовірне розходження кривих починалося лише після 1 року (Schrader J., Luders S., Kulschewski A. et al., 2003). У нещодавно опублікованому багатоцентровому, плацебо-контрольованому дослідженні SCAST (2029 хворих) у пацієнтів із ГІІ та АТ ≥ 140 мм рт.ст. також не було виявлено позитивного ефекту раннього (протягом перших 7 діб) призначення кандесартану на розвиток основних серцево-судинних подій (смерть/нефатальний ІМ/інсульт) протягом 6 місяців спостереження. Функціональний стан пацієнтів, які приймали кандесартан, за модифікованою шкалою Rankin через 6 місяців був оцінений навіть як гірший, ніж у групі контролю (p = 0,048, хоча в даному дослідженні достовірною вважалася різниця при p < 0,025) (Sandset E.C. et al., 2011).
При математичному аналізі результатів 37 досліджень, які загалом включали 9008 пацієнтів і в яких тестували ефективність 13 різних гіпотензивних препаратів, не виявили статистично значущих переваг ранньої гіпотензивної терапії у хворих з ГІІ порівняно з контролем. У групі активного лікування залежність несприятливих подій від змін АТ мала U- чи J-подібний характер — як значне зниження, так і будь-яке підвищення АТ асоціювались із погіршенням результатів лікування. Найкращі результати в групі активного лікування спостерігались при досить помірному (від 8,1 до 14,6 мм рт.ст.) зниженні рівня систолічного АТ (Geeganage C.M., Bath P.M.W. еt al., 2009).
Результати проведених досліджень є досить неоднозначними, але в більшості свідчать про безпечність поміркованого підходу до зниження АТ у хворих із ГІІ та підвищеним АТ. У той же час досі немає чітких рівнів АТ, які потребують невідкладного лікування, а також не визначені швидкість та межа для його зниження. На сьогодні лікування підвищеного АТ у пацієнтів з ГІІ проводиться з огляду на можливість проведення тромболітичної терапії. Хворим, яким планується введення тканинного активатора плазміногену, невідкладне зниження АТ рекомендоване при підвищенні систолічного АТ > 185 мм рт.ст. та/або діастолічного АТ > 110 мм рт.ст., оскільки перевищення цих рівнів є протипоказанням для введення тромболітичного препарату. У інших пацієнтів межею для невідкладного лікування визначені цифри систолічного АТ > 220 мм рт.ст. та діастолічного АТ > 120 мм рт.ст. (Adams H.P., del Zoppo G., Alberts M.J. et al., 2007).
Зниження АТ повинно проводитися дуже обережно для попередження погіршення неврологічної симптоматики за рахунок погіршення внутрішньомозкової гемодинаміки. Доцільним вважається зниження середнього АТ на 15–25 % протягом першої доби (Grossman E., Ironi A.N., Messerli F.H., 1998; Adams H.P., del Zoppo G., Alberts M.J. et al., 2007).
Вибір антигіпертензивного препарату залежить від швидкості та тривалості (у випадку погіршення неврологічної симптоматики на фоні зниження АТ) його дії, від можливих побічних ефектів та від впливу на внутрішньомозковий кровообіг.
На сьогодні з метою зниження АТ у пацієнтів із ГІІ рекомендоване застосування лабеталолу, нікардипіну та нітропасти. Режими антигіпертензивної терапії наведені нижче. З огляду на відсутність негативного впливу на внутрішньомозковий кровообіг у цілому та на кровообіг у періінфарктній зоні при ГІІ у фенолдопаму та урапідилу, можливо також рекомендувати призначення цих препаратів для корекції АТ при гострому порушенні мозкового кровообігу (Hartmann A.).
При цьому задля запобігання розвитку гіпотензивної реакції необхідно суворо дотримуватись рекомендованих протоколів щодо режиму введення препаратів та чітко контролювати рівень АТ (Bugnicourt J.M., Duru C., Picard C. еt al., 2008). Нітропрусид натрію та ніфедипін підвищують рівень внутрішньочерепного тиску й порушують авторегуляцію внутрішньомозкового кровообігу (Kondo T., Brock M., Bach H., 1984; Griswold W.R., Reznik V., Mendoza S.A., 1981; Anile C., Zanghi F., Bracali A. et al., 1981).
Tому використання цих препаратів при ГІІ протипоказане. Нітропрусид може використовуватись лише як засіб «останньої надії» при неефективності інших антигіпертензивних препаратів та необхідності швидкого зниження АТ (наприклад, супутній набряк легень чи розшарування аорти).
Рекомендовані режими антигіпертензивної терапії при ГІІ для хворих, яким планується чи проводилась тромболітична терапія (Adams H.P., del Zoppo G., Alberts M.J. et al., 2007)
А. Контроль АТ при ГІІ у пацієнтів, яким планується проведення тромболітичної терапії чи інтервенційного втручання:
1. Якщо рівень систАТ > 185 мм рт.ст. або діастАТ > 110 мм рт.ст.:
а) лабеталол 10–20 мг в/в за 1–2 хвилини, можна повторити однократно;
б) або нітропаста 3–6 см;
в) або нікардипін в/в інфузія 5 мг/год, підвищуючи дози на 2,5 мг/год кожні 5–15 хвилин до максимальної дози 15 мг/год; при досягненні цільового АТ — знизити швидкість інфузії до 3 мг/год.
2. Якщо рівень АТ лишається вище > 185/110 мм рт.ст. — тромболітичну терапію не призначати.
Б. Контроль АТ під час та після проведення тромболітичної терапії або інтервенційного втручання. Необхідно моніторувати АТ кожні 15 хвилин під час ТЛТ та 2 години після її проведення, потім кожні 30 хвилин протягом наступних 6 годин та кожну 1 годину протягом 16 годин:
1. Якщо рівень систАТ від 180 мм рт.ст. до 230 мм рт.ст. або рівень діастАТ від 105 мм рт.ст. до 120 мм рт.ст.:
а) лабеталол 10 мг в/в за 1–2 хвилини, з можливістю повторного введення через кожні 10–20 хвилин до максимальної дози 300 мг;
б) або лабеталол 10 мг в/в з подальшою інфузією Mg від 2 до 8 мг/хв.
2. Якщо рівень систАТ > 230 мм рт.ст. або рівень діастАТ від 121 мм рт.ст. до 140 мм рт.ст.:
а) лабеталол 10 мг в/в за 1–2 хвилини, з можливістю повторного введення через кожні 10–20 хвилин до максимальної дози 300 мг;
б) або лабеталол 10 мг в/в з подальшою інфузією Mg від 2 до 8 мг/хв;
в) або нікардипін в/в інфузія 5 мг/год, підвищуючи дози на 2,5 мг/год кожні 5 хвилин до максимальної дози 15 мг/год;
3. За відсутності стабілізації АТ — введення нітропрусиду натрію.
Геморагічний інсульт
У хворих із геморагічним інсультом прогноз захворювання в першу чергу визначається об’ємом внутрішньочерепної гематоми (ВЧГ), збільшення якої відбувається протягом перших годин (особливо перших 3 годин) та суттєво уповільнюється або припиняються через 1 добу (Davis S.M., Broderick J., Hennerici M. et al., 2006; Kazui S., Naritomi H., Yamamoto H. et al., 1996). Об’єм ВЧГ напряму корелює зі ступенем підвищення систолічного АТ (≥ 160 мм рт.ст.) (Ohwaki K., Yano E., Nagashima H. et al., 2004), що спостерігається від 46 до 75 % хворих із внутрішньочерепною кровотечею (ВЧК) (Qureshi A.I., 2008; Wallace J.D., Levy L.L., 1981; Qureshi A.I., Ezzeddine M.A., Nasar A. et al., 2007).
Потенційними патофізіологічними механізмами підвищення АТ вважають стрес-індуковану активацію нейрон-ендокринної системи (симпатичної нервової системи, ренін-ангіотензин-альдостеронового механізму, глюкокортикоїдної системи) та підвищення внутрішньочерепного тиску (ВЧТ). Гіпертензія теоретично може сприяти гідростатичному збільшенню гематоми та перігематомного набряку, а також збільшувати ймовірність повторної кровотечі (Morgenstern L.B. et al., 2010).
За результатами метааналізу та підвищення систолічного АТ від 140 мм рт.ст. до 150 мм рт.ст. у перші 12 годин від розвитку ВЧК супроводжувалось майже вдвічі більшим ризиком смерті чи обмеження дієздатності (Zhang Y., Reilly K.H., Tong W. еt al., 2008; Willmot M., Leonardi-Bee J., Bath P.M., 2004).
На жаль, на сьогодні ми маємо досить обмежені дані відносно впливу зниження АТ на розмір ВЧГ. Навпаки, теоретично є загроза, що агресивне зниження АТ може погіршити перфузію головного мозку та спричинити його ішемічне ураження. Тому в рекомендаціях Американської асоціації серця/Американської асоціації інсульту 2007 року був закріплений досить поміркований підхід до корекції АТ у хворих з ВЧК (Broderick J., Connolly S., Feldmann E. et al., 2007).
Корекція АТ у хворих з гострим геморагічним інсультом
— При систолічному АТ > 200 мм рт.ст. або середньому АТ > 150 мм рт.ст. — агресивне зниження АТ за допомогою тривалої внутрішньовенної інфузії з частим моніторуванням АТ (кожні 5 хвилин).
— При систолічному АТ > 180 мм рт.ст. або середньому АТ > 130 мм рт.ст. із підвищенням або підозрою на підвищення внутрішьочерепного тиску — моніторування ВЧТ та зниження АТ за допомогою переривчастої або тривалої внутрішньовенної інфузії з підтриманням тиску перфузії головного мозку від 60 до 80 мм рт.ст.
— При систолічному АТ > 180 мм рт.ст. або середньому АТ > 130 мм рт.ст. без підвищення/підозри на підвищення ВЧТ — помірне зниження АТ (середній АТ до 110 мм рт.ст. або 160/90 мм рт.ст.) за допомогою переривчастої або тривалої внутрішньовенної інфузії з моніторуванням АТ і стану пацієнту кожні 15 хвилин.
Цей підхід передусім базувався на думці експертів та результатах невеликих клінчних досліджень. Втім у ряді експериментальних та клінічних робіт не виявили зон гіпоперфузії чи порушень авторегуляції мозкового кровотоку навколо ВЧГ, які б могли спричинити ішемічне ураження ГМ (Qureshi A.I., Wilson D.A., Hanley D.F. et al., 1999; Carhuapoma J.R., Wang P.Y., Beauchamp N.J. et al., 2000; Zazulia A.R., Diringer M.N., Videen T.O. et al., 2001; Kidwell C.S., Saver J.L., Mattiello J. et al., 2001; Powers W.J., Zazulia A.R., Videen T.O. et al., 2001; Qureshi A., 2008).
Декілька нерандомізованих клінічних досліджень також підтвердили безпечність раннього зниження АТ або навіть показали покращення клінічного перебігу захворювання у хворих із ВЧГ. У дослідженні S. Koch та співавт. порівнювали стандартну (серАТ = 110–130 мм рт.ст.) та агресивну (серАТ < 110 мм рт.ст.) антигіпертензивну терапію у пацієнтів з ВЧК, які були рандомізовані у перші 8 годин (у середньому 3,2 ± 2,2 год) від початку симптоматики захворювання. Утримання рівня серАТ проводили стандартними препаратами згідно з рутинною клінічною практикою (лабеталол, нікардипін або нітропрусид натрію) протягом 48 годин. У середньому необхідного рівня АТ досягали через 87,1 ± 59,6 хв та 163,5 ± 163,8 хв у групах стандартної та інтенсивної терапії відповідно. Не було виявлено відмінностей за частотою раннього погіршення неврологічної симптоматики, розмірами гематоми та навкологематомного набряку та клінічними результатами через 90 днів спостереження між двома групами (Koch S., Romano J.G., Forteza A.M. et al., 2008).
Qureshi та співавт. оцінювали переносимість та безпечність агресивної антигіпертензивної терапії (гідралазин та лабеталол) у 27 пацієнтів із ВЧК. Сістолічний АТ утримували нижче 160 мм рт.ст. та діастолічний АТ менше 90 мм рт.ст. протягом принаймні 24 годин від розвитку захворювання. Погіршення неврологічної симптоматики спостерігали у 2 хворих (7,4 %), збільшення розміру ВЧГ у 2 (9,1 %) із 22 хворих, яким проводилася повторна комп’ютерна томографія. Автори зробили висновок щодо можливості раннього застосування агресивної фармакотерапії гострого підвищення АТ у хворих із ВЧК (Qureshi A.I., Mohammad Y.M., Yahia A.M. et al., 2005).
У лютому 2010 року опубліковані результати дослідження ATACH (Antihypertensive Treatment of Acute Cerebral Hemorrhage), у якому хворі були розподілені на 3 групи залежно від цільових рівнів систолічного АТ: 170–200 мм рт.ст. (1-ша група), 140–170 мм рт.ст. (2-га група) та 110-140 мм рт.ст. (3-тя група). У дослідження включали хворих із симптоматикою спонтанної ВЧК у межах 6 годин від розвитку захворювання та систолічним АТ 170 мм рт.ст. Зниження та утримання цільових рівніх АТ протягом 18–24 годин досягали шляхом внутрішньовенної інфузії нікардипіну за стандартною схемою. З 774 хворих, які пройшли скринінг, рандомізовані були лише 60 пацієнтів — 18/20 та 22 пацієнти відповідно у 1-шу, 2-гу та 3-тю групу. Цільові рівні систолічного АТ були досягнуті у всіх пацієнтів з першої та другої групп та у 13 (59,1 %) пацієнтів третьої групи. Погіршення неврологічної симптоматики протягом перших 24 годин спостерігали в 1 (6 %), 2 (10 %) та 4 (18 %) пацієнтів, а розвиток серйозних побічних явищ протягом 72 годин — у 0, 1 (5 %) та 3 (14 %) пацієнтів із першої, другої та третьої груп. Через 3 місяці спостереження померли 3 (17 %), 2 (10 %) та 5 (23 %) пацієнтів відповідно. Частота небажаних побічних явищ була меншою, ніж очікували перед початком дослідження, тому автори зробили висновок про безпечність агресивного підходу до зниження АТ у хворих із ВЧК (Antihypertensive Treatment of Acute Cerebral Hemorrhage (ATACH) investigators. Antihypertensive treatment of acute cerebral hemorrhage, 2010).
Результати дослідження стали підставою для нового проекту — ATACH-ІІ. Метою дослідження є визначення можливості попередження смерті та обмеження дієздатності через 90 днів шляхом агресивної гіпотензивної терапії нікардипіном у перші 24 години від розвитку захворювання. У дослідження включають пацієнтів із ВКГ у межах 3 годин від першої неврологічної симптоматики та рівнем систолічного АТ від 180 до 240 мм рт.ст. Цільовий систолічний АТ у групі агресивної терапії становить 140 мм рт.ст., у групі контроля — 180 мм рт.ст. Набір пацієнтів розпочався у 2010 році, заплановано включення близько 1300 хворих (ClinicalTrials.gov. Antihypertensive Treatment in Acute Cerebral Hemorrhage-II http://clinicaltrials.gov/).
У дослідження INTERACT включали пацієнтів зі спонтанною ВЧК протягом 6 годин від виникнення симптоматики та підвищеним рівнем систолічного АТ (150–220 мм рт.ст.). Надалі хворих розподіляли у групу стандартного (систАТ > 180 мм рт.ст.) та агресивного контролю АТ (зниження систАТ > 140 мм рт.ст. протягом 1 години від початку терапії та утримання його рівня протягом тижня). Для зниження АТ використовували найбільш уживані у клініці препарати за стандартною схемою (урапідил та/або фуросемід понад 80 % хворих із групи агресивного лікування). У 2008 році були опубліковані результати першої фази дослідження (203 пацієнти у групі агресивної та 201 пацієнт у групі стандартної терапії). За 1 годину після рандомізації середній систАТ у групі стандартного контролю становив 167 мм рт.ст., у групі інтенсивного контролю — 153 мм рт.ст. (р < 0,0001), середній рівень систАТ від 1 до 24 години був 157 та 146 мм рт.ст. відповідно (р < 0,0001). За 24 години лікування в групі агресивного контролю АТ відмічено на 22,6 % менший приріст розміру ВЧГ (р = 0,06), а також значно менший відсоток хворих із суттєвим (> 33 або 12,5 мл) збільшенням розміру ВЧГ (р = 0,05). Частота виникнення небажаних побічних явищ та смерті протягом 90 днів спостереження суттєво не відрізнялась. Отримані результати дозволили авторам зробити висновок, що раннє інтенсивне зниження АТ у хворих з ВЧК є досяжним, добре переноситься та ймовірно призводить до зменшення приросту ВЧГ (Anderson C.S., Huang Y., Wang J.G. et al., 2008).
Таким чином, на сьогодні лишаються дійсними рекомендації щодо помірного зниження АТ у хворих зі спонтанною ВЧК з урахуванням рівня внутрішньочерепного тиску. У той же час з огляду на дані попередніх досліджень у пацієнтів із ВЧК і систолічним АТ від 150 до 220 мм рт.ст. гостре зниження АТ до 140 мм рт.ст. може вважатися безпечним. Саме це положення знайшло відображення у нових рекомендаціях Американської асоціації серця/Американської асоціації інсульту 2010 року (Morgenstern L.B. et al., 2010).
Субарахноїдальний крововилив (САК)
Субарахноїдальний крововилив нетравматичного генезу — це доволі частий патологічний процес (до 5 % усіх інсультів), що полягає у проникненні крові в субарахоїдальний простір за рахунок розриву мішкуватої аневризми або артеріовенозної мальформації. Основний метод лікування цього захворювання — хірургічний (чи інвазивний). Задача медикаментозної терапії полягає в попередженні й лікуванні набряку мозку, повторного крововиливу та ангіоспазму. Тому контроль АТ є дуже важливою складовою медикаментозної терапії. Хоча на сьогодні немає однозначних даних стосовно того, чи впливає адекватний контроль АТ на вірогідність повторного крововиливу, більшість досліджень підтверджують розвиток цього ускладнення в пацієнтів із підвищеним рівнем та значними коливаннями АТ (Ohkuma H., Tsurutani H., Suzuki S., 2001; Fujii Y., Takeuchi S., Sasaki O. et al., 1996). У цих дослідженнях розвиток повторної кровотечі асоціювався з рівнем систолічного АТ понад 150–160 мм рт.ст.
На сучасному етапі метою антигіпертензивної терапії у хворих із САК у передопераційний період є підтримання систолічного АТ нижче 140 мм рт.ст. та діастолічного АТ нижче 90 мм рт.ст. (Bambakidis N.C., Selman W.R., 2004; Suarez J.I., Tarr R.W., Selman W.R., 2006).
Задля досягнення цільових рівнів АТ використовують тривалу внутрішньовенну інфузію нікардипіну, лабеталолу чи есмололу. Слід уникати використання нітропрусиду натрію у зв’язку з можливістю підвищення внутрішньочерепного тиску й токсичністю в разі тривалого використання (Bederson J.B., Connolly E.S., Batjer H.H. et al., 2009). На відміну від нітропрусиду урапідил не впливає на рівень внутрішньочерепного тиску та дозволяє надійно й безпечно контролювати АТ у цих хворих (Hussein S., Seifert V., 1989).
Після САК у 30–70 % хворих спостерігається спазм артерій основи головного мозку, що призводить до суттєвого погіршення дистального мозкового кровотоку. Звичайно ознаки вазоспазму спостерігаються з 3–5-ї доби, сягають максимуму на 5–14-ту добу та минають наприкінці 2–4-го тижня (Heros R.C., Zervas N.T., Varsos V., 1983; Fisher C.M., Roberson G.H., Ojemann R.G., 1977).
Приблизно в половини хворих погіршення внутрішьомозкової гемодинаміки внаслідок вазоспазму призводить до виникнення нового неврологічного дефіциту, який може минати чи призводити до розвитку інфаркту мозку (Sundt T.M. Jr, Kobayashi S., Fode N.C. et al., 1982; Kassell N.F., Kongable G.L., Torner J.C. et al., 1985).
Задля попередження й лікування мозкового вазоспазму оперативні втручання з приводу САК слід проводити янайшвидше. Вже з перших годин після розвитку САК усі хворі повинні приймати німодипін (60 мг 4 рази на добу). Дані щодо ефективності інших антагоністів кальцію на цей час відсутні (Rinkel G.J., Feigin V.L., Algra A. et al., 2005; Bederson J.B., Connolly E.S., Batjer H.H. et al., 2009).
Лікування порушень мозкового кровообігу внаслідок мозкового вазоспазму полягає у збільшенні об’єму циркулюючої крові (hypervolemia), гемодилюції (haemodilution) та підвищенні рівня АТ (hypertension) — «правило 3h» (Bederson J.B., Connolly E.S., Batjer H.H. et al., 2009).
У деяких хворих у цей період спостерігається спонтанне підвищення рівня АТ, що у більшості випадків має компенсаторний характер і спрямоване на підтримання належного рівня мозкового кровообігу (Claassen J., Hirsch L.J., Kreiter K.T. et al., 2004).
Тому у хворих із САК у післяопераційний період (ліквідована причина повторної кровотечі) антигіпертензивна терапія не проводиться, якщо рівень систолічного АТ знаходиться в межах до 200 мм рт.ст. (Suarez J.I., Tarr R.W., Selman W.R., 2006).
Еклампсія та прееклампсія
Артеріальна гіпертензія ускладнює перебіг вагітності приблизно у 12 % жінок та є основною причиною материнської смертності у 18 % випадків (Koonin L.M., MacKay A.P., Berg C.J. et al., 1997).
Терапія прееклампсії та еклампсії є досить складною та полягає в контролі обміну рідини, введенні cульфату магнію та нормалізації артеріального тиску (Belfort M.A., Anthony J., Saade G.R. et al., 2003; Coetzee E.J., Dommisse J., Anthony J., 1998; Lucas M.J., Leveno K.J., Cunningham F.G., 1995). У разі неефективності проводять передчасні пологи.
Лікування прееклампсії/еклампсії повинно проводитись внутрішньовенно. Терапію починають із введення сульфату магнію (болюс — 4–6 грамів у 5% розчині декстрози протягом 15–20 хвилин з наступною інфузією 1–2 грами/годину), що має патогенетичне значення й дозволяє попередити виникнення судом та деякою мірою знизити рівень АТ. Специфічну антигіпертензивну терапію слід починати при рівні систолічного АТ вище ніж 160 мм рт.ст. та/або діастолічного АТ вище ніж 105 мм рт.ст. (Martin J. Jr, Thigpen B.D., Moore R.C. et al., 2005; Cunningham F.G., 2005).
Вона має на меті зниження та підтримання АТ на оптимальному рівні, що дозволить, з одного боку, попередити розвиток внутрішньочерепної кровотечі, серцевої недостатності та інфаркту/відшарування плаценти, а з іншого — не призведе до погіршення мозкового та/або плацентарного кровообігу (Sibai B.M., 2005).
Вважається, що такий «оптимальний» рівень систолічного АТ знаходиться в межах від 140 до 160 мм рт.ст., діастолічного — від 90 до 105 мм рт.ст. Такий досить вузький діапазон цільових рівнів АТ у сукупності з нестабільністю його показників, що є характерною рисою для хворих із прееклампсією/еклампсією, обумовлює необхідність постійного моніторингу таких хворих у відділеннях інтенсивної терапії. Застосування великих доз магнію також потребує щогодинного контролю діурезу та рівня глибоких сухожильних рефлексів.
Ідеального препарату для контролю АТ у хворих із прееклампсією/еклампсією не існує. Історично з цією метою використовують гідралазин. Цей препарат незначною мірою проникає через плацентарний бар’єр та не призводить до погіршення плацентарного кровообігу. У більшості випадків він добре переноситься, але може призводити до розвитку побічних ефектів (головний біль, нудота, блювання, рефлекторна тахікардія), які тяжко відрізнити від загострення прееклампсії. Препарат також характеризується відкладеною, непередбачуваною та тривалою гіпотензивною дією, що значно обмежує його застосування (O’Malley K., Segal J.L., Israili Z.H. et al., 1975).
З метою зниження рівня АТ у вагітних може також використовуватися лабеталол (Cressman M.D., Vidt D.G., Gifford R.W. Jr et al., 1984; Elatrous S., Nouira S., Ouanes Besbes L. et al., 2002; Huey J., Thomas J.P., Hendricks D.R. et al., 1988; Mabie W.C., Gonzalez A.R., Sibai B.M. et al., 1987).
Лабеталол є водорозчинним препаратом, тому майже не проникає через плацентарний барєр. Пряме порівняння лабеталолу та гідралазину в рандомізованому клінічному дослідженні не виявило в матерів суттєвих розбіжностей за частотою виникнення гіпотензії, тоді як терапія гідралазином частіше супроводжувалася тахікардією. Новонароджені також не відрізнялися за основними показниками, окрім гіпотензії та брадикардії, частота яких була значно вищою при застосуванні лабеталолу. За результатами цього дослідження обидва препарати були визнані прийнятними для лікування тяжкої гіпертензії під час вагітності (Vigil-De Gracia P., Lasso M., Ruiz E. et al., 2006).
У двох невеликих дослідженнях урапідил та дигідралазин однаково ефективно знижували рівень АТ у вагітних жінок із прееклампсією. У той же час гемодинамічні ефекти урапідилу були більш передбачувані та цей препарат краще переносився (Wacker J., Werner P., Walter-Sack I. et al., 1998; Wacker J.R., Wagner B.K., Briese V., et al., 2006).
В іншому дослідженні використання урапідилу асоціювалося зі значно меншим впливом на гемодинамічні парметри новонароджених, ніж внутрішньовенне введення дигідралазину (Schulz M., Wacker J., Bastert G., 2001). Незважаючи на такий досить обмежений досвід застосування у вагітних у деяких країнах (Франція, Німеччина, Австрія) урапідил рекомендований для зниження АТ у комплексній терапії прееклампсії та еклампсії.
Застосування інгібіторів АПФ і нітропрусиду натрію у вагітних є протипоказаним.
Гіпертензивний криз унаслідок гіперсимпатикотонії
Найбільш часто цей вид ГК обумовлений уживанням засобів симпатоміметичної дії, таких як кокаїн чи амфетаміни, рідше спостерігається у хворих із феохромоцитомою, а також при одночасному прийомі інгібіторів моноаміноксидази та продуктів харчування, що містять тираміни (тверді сири, алкогольні напої, білкові суміші). Розвиток гіперсимпатикотонії можливий також у пацієнтів, які різко відмінили прийом клонідину або бета-адреноблокаторів.
При лікуванні ГК такого роду не слід використовувати бета-адреноблокатори, принаймні як препарати першого ряду. Блокада бета-адренорецепторів може підвищити вміст катехоламінів у плазмі крові та посилити активацію альфа-адренорецепторів. Наслідком такої активації є спазм коронарних артерій із розвитком гострої ішемії міокарда, прогресуюче підвищення АТ та збільшення летальністі (Lange R.A., Cigarroa R.G., Flores E.D. et al., 1990; Pitts W.R., Lange R.A., Cigarroa J.E. et al., 1997; Hollander J.E., 1995).
Навіть лабеталол, що протягом тривалого часу теоретично розглядався як ідеальний препарат для лікування цієї категорії хворих, не підтвердив свою ефективність у клініці за рахунок переважної блокади бета-адренорецепторів (Gay G.R., Loper K.A., 1987; Dusenberry S.J., Hicks M.J., Mariani P.J., 1987; Spivey W.H., Schoffstall J.M., Kirkpatrick R. et al., 1990; Catravas J.D., Waters I.W., 1981; Boehrer J.D., Moliterno D.J., Willard J.E. et al., 1993).
Препаратами вибору для лікування даної категорії хворих є периферичні a-адреноблокатори (в Україні лише урапідил) чи нітрогліцерин/нітропрусид у комбінації з діазепамом. Можливе використання верапамілу (Hollander J.E., 2008).
Періопераційна гіпертензія
Періопераційна гіпертензія спостерігається приблизно у 25 % пацієнтів із супутньою АГ. З огляду на значну поширеність гіпертонічної хвороби (у 2009 році в Україні зареєстровано близько 12 млн хворих) проблема передопераційної підготовки, інтра- та післяопераційного ведення цих хворих є дуже актуальною у зв’язку з високим ризиком серцево-судинних ускладнень та смерті на тлі коливань артеріального тиску. Окремою проблемою є також підвищення ризику геморагічних ускладнень.
Періопераційне підвищення АТ найчастіше спостерігають під час ввідного наркозу; інтаропераційне — за рахунок стимуляції симпатичної нервової системи у відповідь на біль; у ранній післянаркозний період — через біль, гіпотермію, гіпоксію або перенавантаження рідиною під час хірургічного втручання; через 24–48 годин після операції — у відповідь на перерозподіл рідини з позасудинного простору до судин. Постопераційне підвищення АТ може бути також обумовлене відміною антигіпертензивної терапії. Найчастіше підвищення АТ спостерігається при операціях на сонних артеріях, черевній аорті, периферичних артеріях, органах черевної або грудної порожнини. Підвищення діастолічного АТ > 110 мм рт.ст. є передопераційним маркером розвитку серцево-судинних подій під час операції та одразу ж після неї. Таким чином, усі пацієнти, які приймають антигіпертензивну терапію, повинні продовжувати її прийом безпосередньо до проведення операції, включаючи ранок перед втручанням.
Передопераційна гіпертензія
У більшості випадків преопераційна АГ відповідає критеріям неускладненого гіпертензивного кризу. Підвищення АТ не призводить до уражання органів-мішеней, а тільки становить потенційну загрозу для хворого. Крім того, у більшості випадків перед оперативним втручанням є достатньо часу для адекватного зниження АТ. Втім, сам факт передопераційної гіпертензії (систАТ > 180 мм рт.ст. або діастаз > 110 мм рт.ст.) у чоловіків пов’язаний із більш ніж 3–4-разовим підвищенням ризику смерті після несерцевого хірургічного втручання. Тому планові операції слід відстрочити до адекватного контролю АТ.
Суттєве підвищення АТ у пацієнтів перед невідкладним хірургічним втручанням без безпосереднього ураження органів-мішеней теж розглядається як неускладнений ГК. У цьому випадку зниження АТ необхідно проводити безпосередньо перед операцією бажано препаратами короткої дії, що дозволить попередити виникнення кровотеч та ураження життєво важливих органів під час та після операції.
Особливу увагу слід звертати на пацієнтів, які приймають клонідин для контролю АТ. Раптова відміна препарату може призвести до рикошетного синдрому з розвитком гіпертензивного кризу, подібного до феохромоцитоми, особливо у хворих, які приймають бета-адреноблокатори. Тому перед проведенням планового втручання необхідно поступово перевести хворого на прийом інших антигіпертензивних препаратів або прийняти клонідин перед невідкладною операцією. У разі розвитку рикошетного синдрому використовують внутрішньом’язове введення клофеліну.
При шунтуванні периферичних судин, аортокоронарному шунтуванні, ендартеректомії сонної артерії, резекції внутрішньомозкової пухлини та операціях із видалення артеріальної аневризми контроль АТ під час втручання є особливо важливим для попередження ускладнень, тому передопераційна підготовка цієї категорії хворих повинна проводитися дуже ретельно.
Як ускладнені розглядають передопераційні гіпертензивні кризи у пацієнтів із гострою дисекцією аорти, гіпертензією вагітних та феохромоцитомою. Ці стани потребують агресивного зниження АТ перед операцією та під час неї за принципами, рекомендованими для цих нозологій.
Інтра- та післяопераційна гіпертензія
Гостре підвищення систолічного чи середнього АТ на 20 % і більше під час хірургічної операції розглядають як ускладнений гіпертензивний криз. Найчастіше гіпертензивні кризи виникають під час операцій на серці, магістральних судинах (сонна артерія, аорта), нирках, голові та шиї, нейрохірургічних втручаннях та операціях із приводу травм (опіки, травми голови).
Постопераційна гіпертензія визначається як підвищення систолічного АТ > 190 мм рт.ст. та/ або діастолічного АТ > 100 мм рт.ст. за результатами 2 послідовних вимірювань. Розвиток гіпертензії, яка є досить частим явищем у ранньому післяопераційному періоді, пов’язують зі збільшенням тонусу симпатичної нервової системи та збільшенням судинного опору. Підвищення АТ, як правило, починається через приблизно 10–20 хвилин після втручання та триває до 4–6 годин. Відсутність адекватного лікування значно збільшує ризик хворих щодо розвитку кровотечі, цереброваскулярної події чи інфаркту міокарда. Поширеність постопераційної гіпертензії варіює від 4 до 35 % залежно від популяції хворих та виду оперативного втручання. Найбільший ризик відмічено у хворих з операціями на серці та магістральних судинах.
Лікування періопераційної гіпертензії
Попередження периопераційної гіпертензії є найефективнішою мірою для покращення результатів її лікування. У більшості хворих підвищення АТ під час або після операції виникає у відповідь на порушення тривалого режиму антигіпертензивної терапії. Тому рекомендовано перед втручанням (хоча б за декілька діб) перевести хворого на прийом препаратів тривалої дії, останню дозу антигіпертензивного засобу прийняти зранку перед операцією, а після неї — якнайшвидше відновити прийом звичайної терапії.
Передопераційна гіпертензія перед невідкладним оперативним втручанням проводиться за принципом лікування неускладнених гіпертензивних кризів. Наявність підвищеного АТ у пацієнтів, яким планується проведення планової операції, потребує більш ретельного підбору терапії з бажаним використанням препаратів тривалої дії. У пацієнтів з анамнезом гіпертонічної хвороби рівень діастолічного АТ у межах 110 мм рт.ст. не є приводом для затримки хірургічного втручання.
Під час та одразу ж після оперативного втручання рівень АТ рекомендовано підтримувати у межах 20 % від передопераційного. При лікуванні інтра- та постопераційної гіпертензії загальноприйнятної думки щодо темпів зниження та цільових рівнів АТ (особливо у пацієнтів не кардіологічного профілю) не існує. Рішення стосовно виду терапії часто приймається біля ліжка хворого анестезіологом і хірургом з урахуванням початкових рівнів АТ, супутньої патології та можливого ризику ускладнень. У більшості випадків метою терапії є зниження середнього АТ не більше ніж на 25 % за допомогою парентеральних антигіпертензивних засобів. У перші 30–60 хвилин терапії необхідно досягти зменшення діастолічного АТ на 10–15 % чи приблизно до 110 мм рт.ст. На фоні зниження АТ рекомендовано проводити помірну інфузійну терапію сольовими розчинами задля поповнення об’єму циркулюючої крові, відновлення перфузії та попередження стрімкого зниження АТ та гіпоперфузії життєво важливих органів (насамперед головного мозку та нирок). Повернення до вихідних рівнів АТ рекомендоване через 24–48 годин.
У пацієнтів кардіохірургічного профілю рекомендований більш агресивний підхід. Антигіпертензивну терапію в цьому випадку слід починати при рівні АТ > 140/90 мм рт.ст. або рівні середнього АТ 105 мм рт.ст. і більше.
Біль і тривога також сприяють підвищенню АТ, тому їх слід ліквідувати ще до початку антигіпертензивної терапії. Усуненню підлягають також такі можливі причини для підвищення артеріального тиску у післяопераційному періоді, як гіпотермія з ознобом, гіпоксемія, гіперкапнія, переповнення сечового міхура. Для стабілізації АТ у разі виникнення періопераційного ускладненого гіпертензивного кризу доказаним є використання урапідилу, лабеталолу та есмололу. Переваги використання того чи іншого антигіпертензивного препарату в різних категорій хірургічних хворих тестувалися в багатьох клінічних дослідженнях.
Одним із препаратів, що з успіхом зарекомендували себе в терапії періопераційної АГ є селективний альфа-адреноблокатор урапідил. Окрім блокади периферичних альфа-адренорецепторів урапідил взаємодіє з серотоніновими 5-HT1A-рецепторами судинорухового центру довгастого мозку, завдяки чому корекція АТ на фоні його прийому не спричинює розвитку рефлекторної тахікардії. Вплив урапідилу на рівень АТ та інші гемодинамічні показники в кардіохірургічних хворих із періопераційною АГ вивчалось у цілому ряді досліджень. Антигіпертензивна ефективність урапідилу була еквівалентна активності нітропрусида натрію та фентоламіну та була кращою, ніж у нітрогліцерину. Урапідил також з успіхом використовувався в ряді досліджень для лікування періопераційної гіпертензії в загальнохірургічній практиці.
1. Верещагин Н.В., Суслина З.А., Максимова М.Ю. Артериальная гипертония и цереброваскулярная патология: современный взгляд на проблему // Кардиология. — М.: Медиа-Сфера, 2004. — Т. 44, № 3. — С. 4-8.
2. Сидоренко Б.А., Преображенский Д.В., Носенко Н.С. Гипертензивные кризы: классификация и современное лечение // Кардиология. — 2002. — № 2. — С. 88-94.
3. Сіренко Ю.М. Діагностичні та лікувальні заходи при гіпертензивних кризах.
4. Adams H.P., del Zoppo G., Alberts M.J. et al. Guidelines for the Early Management of Adults With Ischemic Stroke: a guideline from the American Heart Association/American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups: the American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists // Stroke 2007; 38: 1655-711.
5. Aggarwal M., Khan I.A. Hypertensive crisis: hypertensive emergencies and urgencies // Cardiol. Clin. Feb 2006; 24(1): 135-46.
6. Ahmed N., Wahlgren N.G. Effects of blood pressure lowering in the acute phase of total anterior circulation infarcts and other stroke subtypes // Cerebrovasc. Dis. 2003; 15: 235-243.
7. Amraoui F., van Montfrans G.A., van den Born B.J. Value of retinal examination in hypertensive encephalopathy // J. Hum. Hypertens. Oct 29 2009.
8. Anagnostopoulos C.E., Prabhakar M.J., Kittle C.F. Aortic dissections and dissecting aneurysms // Am. J. Cardiol. 1972; 30: 263-73.
9. Anderson C.S., Huang Y., Wang J.G. et al. Intensive Blood Pressure Reduction in Acute Cerebral Haemorrhage Trial (INTERACT): a randomised pilot trial // Lancet Neurol. 2008; 7: 391-9.
10. Anile C., Zanghi F., Bracali A. et al. Sodium nitroprusside and intracranial pressure // Acta Neurochir. 1981; 58: 203-211.
11. Antihypertensive Treatment of Acute Cerebral Hemorrhage (ATACH) investigators. Antihypertensive treatment of acute cerebral hemorrhage // Critical Care Medicine 2010; 38(2): 637-648,
12. Aslanyan S., Fazekas F., Weir C.J., Horner S., Lees K.R.; GAIN International Steering Committee and Investigators. Effect of blood pressure during the acute period of ischemic stroke on stroke outcome: a tertiary analysis of the GAIN International Trial // Stroke. 2003; 34: 2420-2425.
13. Aslanyan S., Weir C.J., Lees K.R.; GAIN International Steering Committee and Investigators. Elevated pulse pressure during the acute period of ischemic stroke is associated with poor stroke outcome // Stroke. 2004; 35: e153-e155.
14. Ault M.J., Ellrodt A.G. Pathophysiological events leading to the end-organ effects of acute hypertension // Am. J. Emerg. Med. 1985; 3, 10-15.
15. Balser J.R., Martinez E.A., Winters B.D. et al. Beta-adrenergic blockade accelerates conversion of postoperative supraventricular tachyarrhythmias // Anesthesiology. 1998; 89: 1052-9.
16. Bambakidis N.C., Selman W.R. Subarachnoid hemorrhage // Critical care neurology and neurosurgery / J.I. Suarez, ed. — Totowa, N.J.: Humana Press, 2004. — 365-77.
17. Barbe F., Su J.B., Guyene T.T. et al. Bradykinin pathway is involved in acute hemodynamic effects of enalaprilat in dogs with heart failure // Am. J. Physiol. 1996; 270: H1985-92.
18. Bederson J.B., Connolly E.S., Batjer H.H. et al. Guidelines for the Management of Aneurysmal Subarachnoid Hemorrhage. A Statement for Healthcare Professionals From a Special Writing Group of the Stroke Council, American Heart Association // Stroke. 2009; 40: 994.
19. Belfort M.A., Anthony J., Saade G.R. et al. A comparison of magnesium sulfate and nimodipine for the prevention of eclampsia // N. Engl. J. Med. 2003; 348: 304-311.
20. Bennett N.M., Shea S. Hypertensive emergency: case criteria, sociodemographic profile, and previous care of 100 cases // Am. J. Public. Health. 1988; 78: 636-640.
21. Blumenfeld J.D., Laragh J.H. Management of hypertensive crises: the scientific basis for treatment decisions // Am. J. Hypertens. 2001; 14: 1154-1167
22. Boehrer J.D., Moliterno D.J., Willard J.E. et al. Influence of labetalol on cocaine-induced coronary vasoconstriction in humans // Am. J. Med. 1993; 94: 608-610.
23. Britton M., Carlsson A., de Faire U. Blood pressure course in patients with acute stroke and matched controls // Stroke. 1986; 17: 861-4.
24. Broderick J., Connolly S., Feldmann E. et al. Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group // Stroke. 2007; 38: 2001-23.
25. Buch J. Urapidil, a dual-acting antihypertensive agent: current usage considerations // Adv. Ther (2010) 27(7): 1-18.
26. Bugnicourt J.M., Duru C., Picard C., Godefroy O. Decrease in blood pressure after intravenous administration of urapidil during recombinant tissue plasminogen activator thrombolysis for acute ischemic stroke // Clin. Ther. 2008; 30(9): 1675-80.
27. Carhuapoma J.R., Wang P.Y. Beauchamp N.J. et al. Diffusion-weighted MRI and proton MR spectroscopic imaging in the study of secondary neuronal injury after intracerebral hemorrhage // Stroke. 2000; 31: 726-32.
28. Carlberg B., Asplund K., Hagg E. The prognostic value of admission blood pressure in patients with acute stroke // Stroke. 1993; 24: 1372-5.
29. Castillo J., Leira R., Garcia M.M. et al. Blood pressure decrease during the acute phase of ischemic stroke is associated with brain injury and poor stroke outcome // Stroke. 2004; 35: 520-6.
30. Catravas J.D., Waters I.W. Acute cocaine intoxication in the conscious dog: studies on the mechanism of lethality // J. Pharmacol. Exp. Ther. 1981; 217: 350-356.
31. Characteristics and management of patients presenting to the emergency department with hypertensive urgency // J. Clin. Hypertens. 2006; Vol. 8: 12-18.
32. Chen Z.M., Pan H.C., Chen Y.P. et al. Early intravenous then oral metoprolol in 45,852 patients with acute myocardial infarction: randomised placebo-controlled trial // Lancet. 2005; 366(9497): 1622-1632.
33. Chobanian A.V., Bakris G.L., Black H.R. et al. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension. 2003; 42: 1206-52.
34. Claassen J., Hirsch L.J., Kreiter K.T., Du E.Y., Connolly E.S., Emerson R.G., Mayer S.A. Quantitative continuous EEG for detecting delayed cerebral ischemia in patients with poor-grade subarachnoid hemorrhage // Clin. Neurophysiol. 2004; 115: 2699-2710.
35. ClinicalTrials.gov. Antihypertensive Treatment in Acute Cerebral Hemorrhage-II. http://clinicaltrials.gov/
36. Coetzee E.J., Dommisse J., Anthony J. A randomised controlled trial of intravenous magnesium sulphate versus placebo in the management of women with severe pre-eclampsia // Br. J. Obstet. Gynaecol. 1998; 105: 300-303.
37. Cohn J.N., Franciosa J.A., Francis G.S. et al. Effect of shortterm infusion of sodium nitroprusside on mortality rate in acute myocardial infarction complicated by left ventricular failure: results of a Veterans Administration cooperative study // N. Engl. J. Med. 1982; 306: 1129-1135.
38. Cressman M.D., Vidt D.G., Gifford R.W. Jr et al. Intravenous labetalol in the management of severe hypertension and hypertensive emergencies // Am. Heart J. 1984; 107: 980-5.
39. Cunningham F.G. Severe preeclampsia and eclampsia: systolic hypertension is also important // Obstet Gynecol. 2005; 105: 237-238.
40. Davis S.M., Broderick J., Hennerici M. et al. Hematoma growth is a determinant of mortality and poor outcome after intracerebral hemorrhage // Neurology. 2006; 66: 1175-81.
41. De Leeuw P.W., van Es P.N., de Bruyn H.A., Birkenhдger W.H. Renal haemodynamic and neurohumoral responses to urapidil in hypertensive man // Drugs. 1988; 35 (suppl. 6): 74-77.
42. Diercks D.B., Ohman E.M. Hypertension with acute coronary syndrome and heart failure // Ann. Emerg. Med. Mar 2008; 51(3 Suppl): S34-6.
43. Dusenberry S.J., Hicks M.J., Mariani P.J. Labetalol treatment of cocaine toxicity [letter] // Ann. Emerg. Med. 1987; 16: 235.
44. Eggebrecht H., Schmermund A., von Birgelen C. et al. Resistant hypertension in patients with chronic aortic dissection // J. Hum. Hypertens. 2005; 19: 227-31.
45. Elatrous S., Nouira S., Ouanes Besbes L. et al. Short-term treatment of severe hypertension of pregnancy: prospective comparison of nicardipine and labetalol // Intensive Care Med. 2002; 28: 1281-6.
46. Elkayam U., Kulick D., McIntosh N. et al. Incidence of early tolerance to hemodynamic effects of continuous infusion of nitroglycerin in patients with coronary artery disease and heart failure // Circulation. 1987; 76: 577-84.
47. Elliott W.J. Clinical features in the management of selected hypertensive emergencies // Prog. Cardiovasc. Dis. 2006; 48: 316-25.
48. Erbel R., Engberding R., Daniel W. et al. Echocardiography in diagnosis of aortic dissection // Lancet. 1989; 1: 457-61.
49. Estrera A.L., Miller C.C. III, Safi H.J. et al. Outcomes of medical management of acute type B aortic dissection // Circulation. 2006; 114: I384-I389.
50. Evaluation and treatment of atients with severely elevated BP in academic emergency departments: A multicenter study // Ann. Emerg. Med. 2006; Vol. 47: 230-236.
51. Fisher C.M., Roberson G.H., Ojemann R.G. Cerebral vasospasm with ruptured saccular aneurysm: the clinical manifestations // Neurosurgery. 1977; 1: 245-248.
52. Fitzgerald P. Endorcine disorders // Current medical diagnosis and treatment / McPhee S., Papadakis M., editor. — New York: McGraw Hill Lange, 2010. — 1058-1061.
53. Flanigan J.S., Vitberg D. Hypertensive emergency and severe hypertension: what to treat, who to treat, and how to treat // Med. Clin. North. Am. 2006; 90: 439-51.
54. Fozard J., Mir A. Are 5-HT reseptors involved in the antihypertensive effect of urapidil? // Br. J. of Pharm. 1987; 90: 24.
55. Friederich J.A., Butterworth J.F. Sodium nitroprusside: twenty years and counting // Anesth Analg 1995; 81: 152-162.
56. Fujii Y., Takeuchi S., Sasaki O., Minakawa T., Koike T., Tanaka R. Ultra-early rebleeding in spontaneous subarachnoid hemorrhage // J. Neurosurg. 1996; 84: 35-42.
57. Galcera-Tomas J., Castillo-Soria F.J., Villegas-Garcia M.M. et al. Effects of early use of atenolol or captopril on infarct size and ventricular volume: A double-blind comparison in patients with anterior acute myocardial infarction // Circulation. 2001; 103: 813-819.
58. Gay G.R., Loper K.A. The use of labetalol in the management of cocaine crisis // Ann. Emerg. Med. 1988; 17: 282-283.
59. Geeganage C.M., Bath P.M.W. Relationship between Therapeutic Changes in Blood Pressure and Outcomes in Acute Stroke: A Metaregression // Hypertension 2009; 54; 775-781.
60. GISSI-3: effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6-week mortality and ventricular function after acute myocardial infarction. Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico // Lancet. 1994; 343(8906): 1115-1122.
61. Gцb E., Barankay A., Richter J.A. Control of hypertension during cardiopulmonary bypass with urapidil and phentolamine // Arzneimittelforschung. 1981; 31: 1479-1481.
62. Gobbel G.T., Chan T.Y., Chan P.H. Nitric oxide- and superoxide-mediated toxicity in cerebral endothelial cells // J. Pharmacol. Exp. Ther. 1997; 282: 1600-1607.
63. Goldstein L.B. Blood pressure management in patients with acute ischemic stroke // Hypertension. 2004; 43: 137-141.
64. Gomez Angelats E., Bragulat Baur E. Hypertension, hypertensive crisis, and hypertensive emergency: approaches to emergency department care // Emergencias 2010; 22: 209-219.
65. Gosse P., Tauzin-Fin P., Sesay M.B. et al. Preparation for surgery of phaeochromocytoma by blockade of alphaadrenergic receptors with urapidil: what dose? // J. Hum. Hypertens. 2009; 23: 605-609.
66. Graves J.W. Prevalence of blood pressure cuff sizes in a referral practice of 430 consecutive adult hypertensives // Blood Press Monit. 2001; 6: 17-20.
67. Gray R.J., Bateman T.M., Czer L.S. et al. Comparison of esmolol and nitroprusside for acute post-cardiac surgical hypertension // Am. J. Cardiol. 1987; 59: 887-91.
68. Gray R.J. Managing critically ill patients with esmolol. An ultra short-acting beta-adrenergic blocker // Chest. 1988; 93: 398-403.
69. Gregorini L., Marco J., Kozakova M. et al. a-Adrenergic blockade improves recovery of myocardial perfusion and function after coronary stenting in patients with acute myocardial infarction // Circulation 1999; 99: 482-90.
70. Gregorini L., Marco J., Palombo C. et al. Postischemic left ventricular dysfunction is abolished by alpha-adrenergic blocking agents // J. Am. Coll Cardiol. 1998; 31: 992-1001.
71. Griswold W.R., Reznik V., Mendoza S.A. Nitroprusside-induced intracranial hypertension [letter] // JAMA. 1981; 246: 2679-2680.
72. Grossman E., Ironi A.N., Messerli F.H. Comparative tolerability profile of hypertensive crisis treatments // Drug Saf. 1998; 19: 99-122.
73. Grossman E., Messerli F.H, Grodzicki T., Kowey P. Should a moratorium be placed on sublingual nifedipine capsules given for hypertensive emergencies and pseudoemergencies? // JAMA. 1996; 276: 1328-1331.
74. Hagan P.G., Nienaber C.A., Isselbacher E.M. et al. The International Registry of Acute Aortic Dissection (IRAD): new insights into an old disease // JAMA. 2000; 283: 897-903.
75. Hall V.A., Guest J.M. Sodium nitroprusside-induced cyanide intoxication and prevention with sodium thiosulphate prophylaxis // Am. J. Crit. Care 1992; 2: 19-27.
76. Hartmann A., Buttinger C., Rommel T. et al. Alteration of intracranial pressure, cerebral blood flow, autoregulation and carbon dioxide-reactivity by hypotensive agents in baboons with intracranial hypertension // Neurochirurgia. 1989; 32: 37-43.
77. Healton E.B., Brust J.C., Feinfeld D.A., Thomson G.E. Hypertensive encephalopathy and the neurologic manifestations of malignant hypertension // Neurology. Feb 1982; 32(2): 127-32.
78. Heilpern K. Pathoprysiology of hypertension // Ann. Emerg. Med. 2008: 51 (3 Suppl): S5-6.
79. Herlitz J., Edvardsson N., Holmberg S. et al. Goteborg Metoprolol Trial: effects on arrhythmias // Am. J. Cardiol. 1984; 53: 27D–31D.
80. Herlitz J., Hjalmarson A., Swedberg K. et al. Effects on mortality during five years after early intervention with metoprolol in suspected acute myocardial infarction // Acta Med Scand. 1988; 223: 227-231.
81. Hess W. Urapidil versus clonidine. Acute haemodynamic effects during control of intraoperative hypertensive episodes // Drugs. 1990; 40(suppl. 4): 77-79.
82. HIirst A.E. Jr., Johns V.J. Jr., Kime S.W. Jr. Dissecting aneurysm of the aorta: a review of 505 cases // Medicine (Baltimore) 1958; 37: 217-79.
83. Hirai N., Kawano H., Yasue H. et al. Attenuation of nitrate tolerance and oxidative stress by an angiotensin II receptor blocker in patients with coronary spastic angina // Circulation. 2003; 108: 1446-50.
84. Hiratzka L.F., Bakris G.L., Beckman J.A. et al. ACCF/AHA/AATS/ACR/ ASA/ SCA/SCAI/SIR/ STS/SVM guidelines for the diagnosis and management of patients with thoracic aortic disease // Circulation. 2010; 121: e266-e369.
85. Hirschl M.M., Binder M., Bur A. et al. Impact of the renin-angiotensin-aldosterone system on blood pressure response to intravenous enalaprilat in patients with hypertensive crises // J. Hum. Hypertens. 1997; 11: 177-83.
86. Hjalmarson A., Herlitz J., Holmberg S. et al. The Goteborg metoprolol trial. Effects on mortality and morbidity in acute myocardial infarction: Limitation of infarct size by beta blockers and its potential role for prognosis // Circulation. 1983; 67(6 Pt 2): I26-I32.
87. Hollander J.E. Cocaine intoxication and hypertension // Ann Emerg Med. Mar 2008; 51(3 Suppl): S18-20.
88. Hollander J.E. The management of cocaine-associated myocardial ischemia // N. Engl. J. Med. 1995; 333: 1267-1272.
89. Huey J., Thomas J.P., Hendricks D.R. et al. Clinical evaluation of intravenous labetalol for the treatment of hypertensive urgency // Am. J. Hypertens. 1988; 1: 284S–289S.
90. Hussein S., Seifert V. The postoperative treatment of hypertension with urapidil in patients with cerebrovascular aneurysms // Anasth Intensivther Notfallmed. 1989 Dec; 24(6): 373-6.
91. Immink R.V., van den Born B.J., van Montfrans G.A., Koopmans R.P., Karemaker J.M., van Lieshout J.J. Impaired cerebral autoregulation in patients with malignant hypertension // Circulation. Oct 12 2004; 110(15): 2241-5.
92. Indications for ACE inhibitors in the early treatment of acute myocardial infarction: systematic overview of individual data from 100,000 patients in randomized trials. ACE Inhibitor Myocardial Infarction Collaborative Group // Circulation. 1998; 97: 2202-2212.
93. Izumi Y., Benz A.M., Clifford D.B. et al. Neurotoxic effects of sodium nitroprusside in rat hippocampal slices // Exp. Neurol. 1993; 121: 14-23.
94. Johnston K.C., Mayer S.A. Blood pressure reduction in ischemic stroke: a two-edged sword? // Neurology. 2003; 61: 1030-1031.
95. Jorgensen H.S., Nakayama H., Christensen H.R. et al. Blood pressure in acute stroke. The Copenhagen Stroke Study // Cerebrovasc. Dis. 2002; 13: 204-9.
96. Jorgensen H.S., Nakayama H., Raaschou H.O. et al. Effect of blood pressure and diabetes on stroke in progression // Lancet. 1994; 344: 156-9.
97. Jurgensen H.J., Andersen M.P., Bechsgaard P. et al. Effect of acute and long-term beta-adrenergic blockade with alprenolol in definite or suspected myocardial infarction. Study design, patient characteristics and conduct of the study // Acta medica Scandinavica. 1984; 680: 8-17.
98. Kanot J., Allonen H., Kleimola T. et al. Pharmacokinetics of labetalol in healthy volunteers // Int. J. Clin. Pharmacol. Ther. Toxicol. 1981; 19: 41-44.
99. Kaplan N.M. Management of hypertensive emergencies // Lancet. 1994; 344: 1335-1338.
100. Kassell N.F., Kongable G.L., Torner J.C., Adams H.P. Jr, Mazuz H. Delay in referral of patients with ruptured aneurysms to neurosurgical attention // Stroke. 1985; 16: 587-590.
101. Kazui S., Naritomi H., Yamamoto H. et al. Enlargement of spontaneous intra-cerebral hemorrhage. Incidence and time course // Stroke. 1996; 27: 1783-7.
102. Keith N.M., Wagener H.P., Barker N.W. Some different types of essential hypertension: their course and prognosis // Am. J. Med. Sci. 1939; 197: 332-43.
103. Ketch T., Biaggioni I., Robertson R.M. et al. Four faces of baroreflex failure. Hypertensive crisis, volatile hypertension, orthostatic tachycardia and malignant vagotonia // Circulation. 2002; 105: 2518-2523.
104. Khoynezhad A., Plestis K.A. Managing emergency hypertension in aortic dissection and aortic aneurysm surgery // J. Card. Surg. 2006; 21 (suppl 1): S3-S7.
105. Kidwell C.S., Saver J.L., Mattiello J. et al. Diffusion-perfusion MR evaluation of perihematomal injury in hyperacute intracerebral hemorrhage // Neurology. 2001; 57: 1611-7.
106. Kitiyakara C., Guzman N.J. Malignant hypertension and hypertensive emergencies // J. Am. Soc. Nephrol. 1998; 9: 133-42.
107. Klompas M. Does this patient have an acute thoracic aortic dissection? // JAMA. 2002; 287: 2262-72.
108. Kloner R.A., Hutter A.M., Emmick J.T. et al. Time course of the interaction between tadalafil and nitrates // J. Am. Coll. Cardiol. 2003; 42: 1855-60.
109. Koch S., Romano J.G., Forteza A.M. et al. Rapid blood pressure reduction in acute intracerebral hemorrhage: feasibility and safety // Neurocrit. Care. 2008; 8: 316-21.
110. Kondo T., Brock M., Bach H. Effect of intra-arterial sodium nitroprusside on intracranial pressure and cerebral autoregulation // Jpn. Heart J. 1984; 25: 231-237.
111. Koonin L.M., MacKay A.P., Berg C.J. et al. Pregnancy-related mortality surveillance. United States, 1987–1990. Morb Mortal Wkly Rep 1997; CDC Surveillance Summaries 46: 17–36.
112. Kozakova M., Marco J., Heusch G. et al. The α1-adrenergic blocker urapidil improves contractile function in patients 3 months after coronary stenting: A randomized, double-blindedstudy // American Heart Journal. 2004; Vol. 147, № 2: L2-L7.
113. Lange R.A., Cigarroa R.G., Flores E.D. et al. Potentiation of cocaine-induced coronary vasoconstriction by beta-adrenergic blockade // Ann. Intern. Med. 1990; 112: 897-903.
114. Lavrijssen A.T., Kroon A.A., Fuss-Lejeune M., Schiffers P.M., de Leeuw P.W. Renal haemodynamics and sodium excretory capacity during urapidil treatment in patients with essential hypertension // J. Hypertens. 2000; 18: 963-969.
115. Leonardi-Bee J., Bath P.M., Phillips S.J. et al. Blood pressure and clinical outcomes in the International Stroke Trial // Stroke. 2002; 33: 1315-20.
116. Levy P., Compton S., Welch R. et al. Treatment of severe decompensated heart failure with high-dose intravenous nitroglycerin: a feasibility and outcome analysis // Ann. Emerg. Med. 2007; 50: 144-52.
117. Linfors E.W., Feussner J.R., Blessing C.L. et al. Spurious hypertension in the obese patient: effect of sphygmomanometer cuff size on prevalence of hypertension // Arch. Intern. Med. 1984; 144: 1482-1485.
118. Lloyd-Jones D.M., Evans J.C., Levy D. Hypertension in adults across the age spectrum: current outcomes and control in the community // JAMA. 2003; 290: 199-206.
119. Lucas M.J., Leveno K.J., Cunningham F.G. A comparison of magnesium sulfate with phenytoin for the prevention of eclampsia // N. Engl. J. Med. 1995; 333: 201-205.
120. Mabie W.C., Gonzalez A.R., Sibai B.M. et al. A comparative trial of labetalol and hydralazine in the acute management of severe hypertension complicating pregnancy // Obstet Gynecol. 1987; 70: 328-33.
121. Madani R., Al-Hashmi M., Bliss R., Lennard T.W.J. Ectopic pheochromocytoma: does the rule of tens apply? // World J. Surg. 2007; 31: 849-854. Available at: http://www.springerlink.com/content/f401572886u41812. Accessed January 6, 2010.
122. Mann T., Cohn P.F., Holman L.B. et al. Effect of nitroprusside on regional myocardial blood flow in coronary artery disease:results in 25 patients and comparison with nitroglycerin // Circulation 1978; 57: 732-738.
123. Marik P.E., Varon J. Hypertensive Crises: Challenges and Management // Chest. — 2007. — Vol. 131. — P. 1949-1962.
124. Martin J.F., Higashiama E., Garcia E. et al. Hypertensive crisis profile. Prevalence and clinical presentation // Arq. Bras. Cardiol. 2004; 83: 125-36.
125. Martin J.N. Jr, Thigpen B.D., Moore R.C. et al. Stroke and severe preeclampsia and eclampsia: a paradigm shift focusing on systolic blood pressure // Obstet. Gynecol. 2005; 105: 246-254.
126. Marx P.G., Reid D.S. Labetalol infusion in acute myocardial infarction with systemic hypertension // Br. J. Clin. Pharmacol. 1979; 8: 233S-238S.
127. Masuda Y., Yamada Z., Morooka N. et al. 1991. Prognosis of patients with medically treated aortic dissections // Circulation. 84: III7-III13.
128. McAreavey D., Robertson J.I. Angiotensin converting enzyme inhibitors and moderate hypertension // Drugs. 1990; 40: 326-45.
129. McGregor E., Isles C.G., Jay J.L., Lever A.F., Murray G.D. Retinal changes in malignant hypertension // Br. Med. J. 1986; 1: 233-234.
130. Mehta R.H., O’Gara P.T., Bossone E. et al. Acute type A aortic dissection in the elderly: clinical characteristics, management, and outcomes in the current era // J. Am. Coll. Cardiol. 2002; 40: 685-92.
131. Mehta R.H., Suzuki T., Hagan P.G, et al. Predicting death in patients with acute type A aortic dissection // Circulation. 2002; 105: 200-6.
132. Mooss A.N., Hilleman D.E., Mohiuddin S.M. et al. Safety of esmolol in patients with acute myocardial infarction treated with thrombolytic therapy who had relative contraindications to beta-blocker therapy // Ann. Pharmacother. 1994; 28: 701-3.
133. Morgenstern L.B. et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage. A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association // Stroke. 2010; 41: 2108.
134. Muzzi D.A., Black S., Losasso T.J. et al. Labetalol and esmolol in the control of hypertension after intracranial surgery // Anesth. Analg. 1990; 70: 68-71.
135. Nakamura Y., Yasuda M., Fujimori H. et al. Cytotoxic effect of sodium nitroprusside on PC12 cells // Chemosphere 1997; 34: 317-324.
136. National Heart Lung and Blood Institute. The seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. www.nhlb.nih.gov/guidelines/hypertension/jnc7full.pdf (accessed 2009 Jun 22).
137. National Heart Lung Blood Institute. Hypertension Facts. Available at: http://www.nhlbi.nih.gov/. Accessed January 6, 2010.
138. National Heart, Lung, and Blood Institute. New analyses regarding the safety of calcium-channel blockers: a statement for health professional from the National Heart, Lung, and Blood Institute. Bethesda (MD): U.S. Dept. of Health and Human Services; 1995.
139. Nienaber C.A., Sievers H.H. Intramural hematoma in acute aortic syndrome: more than one variant of dissection? // Circulation. 2002; 106: 284-5.
140. Niknahad H., O’Brien P.J. Involvement of nitric oxide in nitroprusside-induced hepatocyte cytotoxicity // Biochem. Pharmacol. 1996; 51: 1031-1039.
141. O’Connor R.E., Brady W., Brooks S.C. et al. 2010 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science. Part 10: Acute Coronary Syndromes // Circulation. 2010; 122: S787-S817.
142. O’Gara P.T., DeSanctis R.W. Acute aortic dissection and its variants. Toward a common diagnostic and therapeutic approach // Circulation. 1995; 92: 1376-8.
143. Ohkuma H., Tsurutani H., Suzuki S. Incidence and significance of early aneurysmal rebleeding before neurosurgical or neurological management // Stroke. 2001; 32: 1176-1180.
144. Ohwaki K., Yano E., Nagashima H. et al. Blood pressure management in acute intracerebral hemorrhage: relationship between elevated blood pressure and hematoma enlargement // Stroke. 2004; 35: 1364-7.
145. Okonofua E.C., Simpson K.N., Jesri A. et al. Therapeutic inertia is an impediment to achieving the Healthy People 2010 blood pressure control goals // Hypertension. 2006; 47: 345-351.
146. Oliveira-Filho J., Silva S.C., Trabuco C.C., Pedreira B.B., Sousa E.U., Bacellar A. Detrimental effect of blood pressure reduction in the first 24 hours of acute stroke onset // Neurology. 2003; 61: 1047-1051.
147. Olmos M., Vidarte M.A., Ballester J.A., Lasuen J., Escobar A. Efficacy of a single dose of urapidilfor preventing arterial hypertension during the pre-bypass period in coronary surgery // Rev. Esp. Anestesiol. Reanim. 2000; 47: 337-342.
148. Olsen K.S., Svendsen L.B., Larsen FS. et al. Effect of labetalol on cerebral blood flow, oxygen metabolism and autoregulation in healthy humans // Br. J. Anaesth. 1995; 75: 51-4.
149. O’Malley K., Segal J.L., Israili Z.H. et al. Duration of hydralazine action in hypertension // Clin. Pharmacol. Ther. 1975; 18: 581-6.
150. Oral captopril versus placebo among 13,634 patients with suspected acute myocardial infarction: interim report from the Chinese Cardiac Study (CCS-1) // Lancet. 1995; 345(8951): 686-687.
151. Pancioli A.M. Hypertension management in neurologic emergencies // Ann. Emerg. Med. Mar 2008; 51(3 Suppl): S24-7.
152. Pasch T., Schulz V., Hoppenshauser G. Nitroprusside-induced formation of cyanide and its detoxication with thiosulphate during deliberate hypotension // J. Cardiovasc. Pharmacol. 1983; 5: 77-85.
153. Pearce C.J., Wallin J.D. Labetalol and other agents that block both a- and b-adrenergic receptors // Cleve. Clin. J. Med. 1994; 61: 59-69.
154. Phillips S.J. Pathophysiology and management of hypertension in acute ischemic stroke // Hypertension. 1994; 23: 131-136.
155. Pitts W.R., Lange R.A., Cigarroa J.E. et al. Cocaine-induced myocardial ischemia and infarction: pathophysiology, recognition, and management // Prog. Cardiovasc. Dis. 1997; 40: 65-76.
156. Potter J., Mistri A., Brodie F. et al. Controlling hypertension and hypotension immediately post stroke (CHHIPS) — a randomised controlled trial // Health Technol Assess 2009; 13(9): 1-73.
157. Potter J.F. Malignant hypertension in the elderly // Q. J. Med. 1995; 88: 641-647.
158. Powers W.J., Zazulia A.R., Videen T.O. et al. Autoregulation of cerebral blood flow surrounding acute (6 to 22 hours) intracerebral hemorrhage // Neurology. 2001; 57: 18-24.
159. Powers W.J. Acute hypertension after stroke: the scientific basis for treatment decisions // Neurology. 1993; 43 (pt 1): 461-467.
160. Prehn J.H., Backhauss C., Karkoutly C. et al. Neuroprotective properties of 5-HT1A receptor agonists in rodent models of focal and global cerebral ischemia // Eur. J. Pharmacol. 1991; 203: 213-222.
161. Puchstein C., Van Aken H., Zander J., Lawin P. The use of urapidil in the postoperative period // Anaesthesist. 1984; 33: 224-227.
162. Qureshi A.I., Ezzeddine M.A., Nasar A. et al. Prevalence of elevated blood pressure in 563,704 adult patients with stroke presenting to the ED in the United States // Am. J. Emerg. Med. 2007; 25: 32-8.
163. Qureshi A.I., Mohammad Y.M., Yahia A.M. et al. A prospective multicenter study to evaluate the feasibility and safety of aggressive antihypertensive treatment in patients with acute intracerebral hemorrhage // J. Intensive Care Med. 2005; 20: 34-42.
164. Qureshi A.I., Wilson D.A., Hanley D.F. et al. No evidence for an ischemic penumbra in massive experimental intracerebral hemorrhage // Neurology. 1999; 52: 266-72.
165. Qureshi A.I. Acute hypertensive response in patients with stroke: pathophysiology and management // Circulation. 2008; 118: 176-187.
166. Randomised trial of intravenous atenolol among 16 027 cases of suspected acute myocardial infarction: ISIS-1. First International Study of Infarct Survival Collaborative Group // Lancet. 1986; 2: 57-66.
167. Reduction of infarct size by the early use of intravenous timolol in acute myocardial infarction. International Collaborative Study Group // Am. J. Cardiol. 1984; 54: 14E-15E.
168. Rehman F., Mansoor G.A., White W.B. «Inappropriate» physician habits in prescribing oral nifedipine capsules in hospitalized patients // Am. J. Hypertens. 1996; 9(10 Pt 1): 1035-9.
169. Rhoades R., Planzer R. Human Physiology. 3rd ed. Fort Worth: Saunders College Publishing; 1996.
170. Rhoney D., Peacock W.F. Intravenous therapy for hypertensive emergencies, part 1 // Am. J. Health Syst. Pharm. 2009 August 1, 66: 1343-1352.
171. Rinkel G.J., Feigin V.L., Algra A., van den Bergh W.M., Vermeulen M., Gijn J. Calcium antagonists for aneurysmal subarachnoid hemorrhage // Cochrane Database Syst. Rev. 2005; 1: CD000277-CD000277.
172. Robin E.D., McCauley R. Nitroprusside-related cyanide poisoning: time (long past due. for urgent, effective interventions // Сhest 1992; 102: 1842-1845.
173. Robinson T.G., Potter J.F., Ford G.A. et al. Effects of antihypertensive treatment after acute stroke in the Continue Or Stop post-Stroke Antihypertensives Collaborative Study (COSSACS): a prospective, randomised, open, blinded-endpoint trial // The Lancet Neurology. 2010; 9: 767-775.
174. Rosei E.A., Salvetti M., Farsang C. Treatment of hypertensive urgencies and emergencies. European Society of Hypertension scientific newsletter: update on hypertension management, 2006; 7: № 28.
175. Rosei E.A., Trust P.M., Brown J.J. et al. Intravenous labetalol in severe hypertension // Lancet. 1975; 2: 1093-4.
176. Sandset E.C. et al. The angiotensin-receptor blocker candesartan for treatment of acute stroke (SCAST): a randomised, placebo-controlled, double-blind trial // The Lancet. 2011; 377: 741-750.
177. Schilling S., Hartel C., Gehl H.B., Sperner J. MRI findings in acute hypertensive encephalopathy // Eur. J. Neurol. May 2003; 10(3): 329-30.
178. Schrader J., Luders S., Kulschewski A. et al. Acute Candesartan Cilexetil Therapy in Stroke Survivors Study Group. The ACCESS Study: evaluation of Acute Candesartan Cilexetil Therapy in Stroke Survivors // Stroke. 2003; 34: 1699-1703.
179. Schreiber W., Woisetschlager C., Binder M. et al. The nitura study — effect of nitroglycerin or urapidil on hemodynamic, metabolic and respiratory parameters in hypertensive patients with pulmonary edema // Intensive Care Medicine 1998; Vol. 24, 6: 557-563.
180. Schulz M., Wacker J., Bastert G. Effect of Urapidil in antihypertensive therapy of preeclampsia on newborns [in German] // Zentralbl Gynakol. 2001; 123: 529-533.
181. Semplicini A., Maresca A., Boscolo G., Sartari M., Rocchi R., Giantinv et al. Hypertension in acute ischemic stroke: a compensatory mechanism or an additional damaging factor? // Arch. Intern. Med. 2003; 163: 211-8.
182. Shayne P.H., Pitts S.R. Severely increased blood pressure in the emergency department // Ann. Emerg. Med. Apr 2003; 41(4): 513-29.
183. Sheppard D., DiStefano S., Byrd R.C. et al. Effects of esmolol on airway function in patients with asthma // J. Clin. Pharmacol. 1986; 26: 169-74.
184. Sibai B.M. Diagnosis, prevention, and management of eclampsia // Obstet. Gynecol. 2005; 105: 402-410.
185. Singh P.P., Dimich I., Sampson I. et al. A comparison of esmolol and labetalol for the treatment of perioperative hypertension in geriatric ambulatory surgical patients // Can. J. Anaesth. 1992; 39: 559-62.
186. Spivey W.H., Schoffstall J.M., Kirkpatrick R. et al. Comparison of labetalol, diazepam, and haloperidol for the treatment of cocaine toxicity in a swine mode [abstract] // Ann. Emerg. Med. 1990; 19: 467-468.
187. Stead L.G., Gilmore R.M., Decker W.W. et al. Initial emergency department blood pressure as predictor of survival after acute ischemic stroke // Neurology. 2005; 65: 1179-83.
188. Strandgaard S., Olesen J., Skinhoj E. et al. Autoregulation of brain circulation in severe arterial hypertension // BMJ. 1973; 1: 507-510.
189. Suarez J.I., Tarr R.W., Selman W.R. Aneurysmal subarachnoid hemorrhage // N. Engl. J. Med. Jan 26 2006; 354(4): 387-96.
190. Sundt T.M. Jr, Kobayashi S., Fode N.C., Whisnant J.P. Results and complications of surgical management of 809 intracranial aneurysms in 722 cases: related and unrelated to grade of patient, type of aneurysm, and timing of surgery // J. Neurosurg. 1982; 56: 753-765.
191. Suzuki T., Mehta R.H., Ince H. et al. Clinical profiles and outcomes of acute type B aortic dissection in the current era: lessons from the International Registry of Aortic Dissection (IRAD) // Circulation. 2003; 108 (suppl 1): II312–II317.
192. Swedberg K., Held P., Kjekshus J. et al. Effects of the early administration of enalapril on mortality in patients with acute myocardial infarction. Results of the Cooperative New Scandinavian Enalapril Survival Study II (CONSENSUS II) // N. Engl. J. Med. 1992; 327: -678-84.
193. Sykoraa M., Diedlera J., Polia S. et al. Blood Pressure Course in Acute Stroke Relates to Baroreflex Dysfunction // Cerebrovasc. Dis. 2010; 30: 172-179.
194. Tisdale J.E., Huang M.B., Borzak S. et al. Risk factors for hypertensive crisis: importance of out-patient blood pressure control // Fam. Pract. 2004; 21, 420-424.
195. Trimarchi S., Nienaber C.A., Rampoldi V. et al. Role and results of surgery in acute type B aortic dissection: insights from the International Registry of Acute Aortic Dissection (IRAD) // Circulation. 2006; 114: I357-I364.
196. Tsai T.T., Bossone E., Isselbacher E.M. et al. Clinical characteristics of hypotension in patients with acute aortic dissection // Am. J. Cardiol. 2005; 95: 48-52.
197. Tsai T.T., Fattori R., Trimarchi S. et al. Long-term survival in patients presenting with type B acute aortic dissection: insights from the International Registry of Acute Aortic Dissection // Circulation. 2006; 114: 2226-31.
198. Tsai T.T., Nienaber C.A., Eagle K.A. Acute aortic syndromes // Circulation. 2005; 112: 3802-13.
199. Tsou T.P., Yen Z.S., Fang C.C. et al. Hypertensive encephalopathy // J. Emerg. Med. Jul 2004; 27(1): 85-6.
200. Tumlin J.A., Dunbar L.M., Oparil S. et al. Fenoldopam, a dopamine agonist, for hypertensive emergency: a multicenter randomized trial: fenoldopam Study Group // Acad. Emerg. Med. 2000; 7: 653-662.
201. Umana J.P., Lai D.T., Mitchell R.S. et al. Is medical therapy still the optimal treatment strategy for patients with acute type B aortic dissections? // J. Thorac. Cardiovasc. Surg. 2002; 124: 896-910.
202. Vaidya C.K., Ouellette J.R. Hypertensive urgency and emergency. Hospital Physician, March 2007: 43-50.
203. Van de Werf F., Bax J., Betriu A. et al. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: the Task Force on the Management of ST-Segment Elevation Acute Myocardial Infarction of the European Society of Cardiology // Eur. Heart J., 2008, 29(23): 2909-2945.
204. Van der Stroom J., van Wezel I., Vergroesen J. et al. Comparison of the effects of urapidil and sodium nitroprusside on haemodinamic state, myocardial metabolism and function in patients during coronary artery surgery // Br. J. of Anaesth. 1996; 76: 645-651.
205. Van Zwieten P.A., Blauw G.J., van Brummelen P. Pharmacological profile of antihypertensive drugs with serotonin receptor and alpha-adrenoceptor activity // Drugs. 1990;40(suppl. 4): 1-8.
206. Varon J., Marik P.E. Clinical review: the management of hypertensive crises // Crit. Care. 2003; 7: 374-84.
207. Varon J. Treatment of acute severe hypertension: current and newer agents // Drugs. 2008; 68: 283-97.
208. Vemmos K.N., Tsivgoulis G., Spengos K. et al. U-shaped relationship between mortality and admission blood pressure in patients with acute stroke // J. Intern. Med. 2004; 255: 257-65.
209. Vesey C.J., Cole P.V., Simpson P.J. Cyanide and thiocyanate concentrations following sodium nitroprusside infusion in man // Br. J. Anaesth. 1976; 48: 651-659.
210. Vidt D.G. Hypertensive Crises. Cleveland Clinic. Center for Continuing Education // www.clevelandclinicmeded.com
211. Vigil-De Gracia P., Lasso M., Ruiz E. et al. Severe hypertension in pregnancy: hydralazine or labetalol. A randomized clinical trial // Eur. J. Obstet. Gynecol. Reprod. Biol. 2006; 128: 157-62.
212. Wacker J., Werner P., Walter-Sack I., Bastert G. Treatment of hypertension in patients with preeclampsia: a prospective parallel-group study comparing dihydralazine with urapidil // Nephrol. Dial. Transplant. 1998; 13: 318-325.
213. Wacker J.R., Wagner B.K., Briese V. et al. Antihypertensive therapy in patients with preeclampsia: A prospective randomised multicentre study comparing dihydralazine with urapidil // Eur. J. Obstet. Gynecol. Reprod. Biol. 2006; 127: 160-165.
214. Wahlgren N.G., MacMahon D.G., DeKeyser J., Indredavik B., Ryman T. Intravenous Nimodipine West European Stroke Trial (INWEST) of nimodipine in the treatment of acute ischaemic stroke // Cerebrovasc. Dis. 1994; 4: 204-21.
215. Wallace J.D., Levy L.L. Blood pressure after stroke // JAMA. 1981; 246: 2177-2180.
216. Wallach R., Karp R.B., Reves J.G. et al. Pathogenesis of paroxysmal hypertension developing during and after coronary bypass surgery: a study of hemodynamic and humoral factors // Am. J. Cardiol. 1980; 46, 559-565.
217. Wallin J.D. Adrenoreceptors and renal function // J. Clin. Hyperten. 1985; 1: 171-178.
218. Webster J., Petrie J.C., Jeffers T.A., Lovell H.G. Accelerated hypertension—patterns of mortality and clinical factors affecting outcome in treated patients // Q. J. Med. 1993; 86: 485-93.
219. Willmot M., Leonardi-Bee J., Bath P.M. High blood pressure in acute stroke and subsequent outcome: a systematic review // Hypertension. 2004; 43: 18-24.
220. Wьsten R., Hemelrijck J., Mattheussen M., Lauvers T., Anger C., van Aken H. Der einfluss von nifidepin und urapidil auf die autoregulation der zerebralen durchbtuling in gegenwart einer intrakraniellen raumforderung [in German] // Anasth. Intensivther. Notfallmed. 1990; 25: 140-145.
221. Zampaglione B., Pascale C., Marchisio M. et al. Hypertensive urgencies and emergencies. Prevalence and clinical presentation // Hypertension. 1996; 27: 144-7.
222. Zanchetti A. Addition of urapidil or metoprolol to the treatment of hypertensive non-responders to nifedipine monotherapy: efficacy and metabolic effects. Italian Urapidil Study Group. Blood Press Suppl. 1995;3:38-46
223. Zazulia A.R., Diringer M.N., Videen T.O. et al. Hypoperfusion without ischemia surrounding acute intracerebral hemorrhage // J. Cereb. Blood. Flow. Metab. 2001; 21: 804-10.
224. Zhang Y., Reilly K.H., Tong W., Xu T., Chen J., Bazzano L.A., Qiao D., Ju Z., Chen C.S., He J. Blood pressure and clinical outcome among patients with acute stroke in Inner Mongolia, China // J. Hypertens. 2008; 26: 1446-1452.