Журнал «Боль. Суставы. Позвоночник» Том 15, №4, 2025
Вернуться к номеру
Аналіз рівнів лептину та впливу уратзнижувальної терапії у пацієнтів з подагрою та метаболічним синдромом
Авторы: Коваленко В.М. (1, 2), Крилова А.С. (1)
(1) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(2) - ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска Національної академії медичних наук України», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
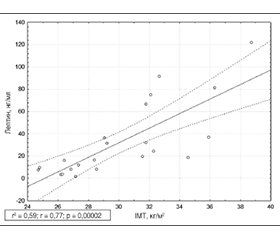
Актуальність. Лептин як один із прозапальних адипокінів бере участь у патогенезі як подагри, так і метаболічного синдрому, проте вплив уратзнижувальної терапії при поєднанні цих патологій є недостатньо вивченим. Мета: проаналізувати рівень лептину в сироватці крові пацієнтів з подагрою та метаболічним синдромом та вплив на нього фебуксостату. Матеріали та методи. У дослідження включено 33 пацієнти, які були розділені на 2 групи: групу дослідження — 22 пацієнти з подагрою та метаболічним синдромом (2 жінки, 20 чоловіків) та групу контролю — 11 осіб (3 жінки, 8 чоловіків) без ревматологічного захворювання. Проведено аналіз індексу маси тіла (ІМТ), рівнів сечової кислоти, лептину, інтерлейкіну (IL) 1 та IL-6 у сироватці крові в обох групах. Застосовували методи анкетування та біомедичної статистики. Для лікування подагри в досліджуваній групі використано фебуксостат у дозі 60–80 мг 1 раз на добу, тривалість спостереження становила 6 місяців. Результати. Рівень лептину у досліджуваній групі становив 19,11 нг/мл (IQR 8,22–36,73) та був вірогідно вищим за відповідний показник у контрольній групі (11,13 нг/мл; IQR 5,91–16,86; р < 0,05). Рівень лептину в досліджуваній групі мав сильний зв’язок з ІМТ та рівнем IL-6 (r = 0,77; p = 0,00002), а також помірний зв’язок між рівнями IL-1 та IL-6 (r = 0,46; p = 0,03). У досліджуваній групі на фоні призначення фебуксостату виявлено вірогідне зменшення рівня сечової кислоти з 478,0 мкмоль/л (IQR 428,0–533,0) до 295,50 мкмоль/л (IQR 220,5–353,0) (р = 0,0004) та зниження рівня лептину, IL-1 та IL-6 (р < 0,05 для обох показників). У невеликій підгрупі пацієнтів з подагрою та метаболічним синдромом (n = 10) відзначено зменшення маси тіла без додаткових дієтичних рекомендацій. Висновки. Отримані дані підтверджують значення лептину у патогенезі подагри та метаболічного синдрому та ефективність фебуксостату як уратзнижувального препарату у цієї когорти пацієнтів.
Background. Leptin, as one of the pro-inflammatory adipokines, is involved in the pathogenesis of both gout and metabolic syndrome, however, the effect of urate-lowering therapy in the combination of these diseases is not sufficiently studied. The purpose was to analyse the level of leptin and the effect of febuxostat in patients with gout and metabolic syndrome. Materials and methods. The study included 33 patients divided into a study group (20 men and two women with gout and metabolic syndrome) and a control group (8 men and three women without rheumatological disease). The body mass index (BMI), serum uric acid, leptin, IL-1, and IL-6 levels were analysed. Questionnaire and biomedical statistics methods were used. Febuxostat was used for the treatment of gout in the study group, at a dose of 60–80 mg once a day; the duration of observation was 6 months. Results. The leptin level in the study group was 19.11 ng/ml (IQR 8.22–36.73) and was significantly higher than in the control group (11.13 ng/ml; IQR 5.91–16.86; p ≤ 0.05). Leptin level had a strong correlation with BMI and IL-6 levels (r = 0.77, p = 0.00002), and there was a medium-strength correlation between the levels of interleukins (IL-1 and IL-6) (r = 0.46, p = 0.03). After febuxostat administration in the study group, a significant decrease in uric acid levels was observed (478.0 μmol/l (IQR 428.0–533.0) vs. 295.5 μmol/l (IQR 220.5–353.0); p = 0.0004). There was a significant decrease in serum leptin, IL-1, and IL-6 levels (p < 0.05). In a small subgroup of patients with gout and metabolic syndrome (n = 10), a decrease in body weight was noted without additional dietary recommendations. Conclusion. Our results confirmed the importance of leptin in the pathogenesis of gout and metabolic syndrome and the effectiveness of febuxostat as a urate-lowering therapy in these patients.
лептин; фебуксостат; подагра; метаболічний синдром
leptin; febuxostat; gout; metabolic syndrome
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Hess PL, Al-Khalidi HR, Friedman DJ, et al. The Me–tabolic Syndrome and Risk of Sudden Cardiac Death: The Atherosclerosis Risk in Communities Study. J Am Heart Assoc. 2017;6(8):e006103. doi: 10.1161/JAHA.117.006103.
- González-Senac NM, Bailén R, Torres RJ, de Miguel E, Puig JG. Metabolic syndrome in primary gout. Nucleosides Nucleotides Nucleic Acids. 2014;33(4-6):185-91. doi: 10.1080/15257770.2013.853785.
- Ter Horst R, van den Munckhof ICL, Schraa K, et al. Sex-Specific Regulation of Inflammation and Metabolic Syndrome in Obesity. Arterioscler Thromb Vasc Biol. 2020;40(7):1787-1800. doi: 10.1161/ATVBAHA.120.314508.
- Obradovic M, Sudar-Milovanovic E, Soskic S, Essack M, Arya S, Stewart AJ, et al. Leptin and Obesity: Role and Clinical Implication. Front Endocrinol (Lausanne). 2021;12:585887. doi: 10.3389/fendo.2021.585887.
- Otero M, Lago R, Lago F, et al. Leptin, from fat to inflammation: old questions and new insights. FEBS Lett. 2005;579:295-301. doi: 10.1016/j.febslet.2004.11.024.
- Azamar-Llamas D, Hernández-Molina G, Ramos-Ávalos B, Furuzawa-Carballeda J. Adipokine Contribution to the Pathogenesis of Osteoarthritis. Mediators Inflamm. 2017;2017:5468023. doi: 10.1155/2017/5468023.
- Neogi T, Jansen TL, Dalbeth N, et al. 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis. 2015;74(10):1789-98. doi: 10.1136/annrheumdis-2015-208237.
- Alberti KG, Zimmet P, Shaw J. Metabolic syndrome — a new world-wide definition. A Consensus Statement from the International Diabetes Federation. Diabet Med. 2006;23(5):469-80. doi: 10.1111/j.1464-5491.2006.01858.x.
- Fam AG. Gout, diet, and the insulin resistance syndrome. J Rheumatol. 2002;29(7):1350-5. PMID: 12136887.
- Chen JH, Pan WH, Hsu CC, et al. Impact of obesity and hypertriglyceridemia on gout development with or without hyperuricemia: a prospective study. Arthritis Care Res (Hoboken). 2013;65(1):133-40. doi: 10.1002/acr.21824.
- Yu Y, Yang J, Fu S, et al. Leptin Promotes Monosodium Urate Crystal-Induced Inflammation in Human and Murine Models of Gout. J Immunol. 2019;202(9):2728-2736. doi: 10.4049/jimmunol.1801097.
- Fruehwald-Schultes B, Peters A, Kern W, et al. Serum leptin is associated with serum uric acid concentrations in humans. Metabolism. 1999;48(6):677-80.
- García-Méndez S, Rivera-Bahena CB, Montiel-Hernández JL, Xibillé-Friedmann D, Álvarez-Hernández E, Peláez-Ballestas I, et al. A Prospective Follow-Up of Adipocytokines in Cohort Patients With Gout: Association With Metabolic Syndrome But Not With Clinical Inflammatory Findings: Strobe-Compliant Article. Medicine (Baltimore). 2015;94(26):e935. doi: 0.1097/MD.0000000000000935.
- Oliviero F, Ramonda R, Punzi L. New horizons in osteoarthritis. Swiss Med Wkly. 2010;140:w13098. doi: 10.4414/smw.2010.13098.
- Girigoswami K, Arunkumar R, Girigoswami A. Management of hypertension addressing hyperuricaemia: introduction of nano-based approaches. Ann Med. 2024;56(1):2352022. doi: 10.1080/07853890.2024. 2352022.
- Higa Y, Hiasa M, Tenshin H, et al. The Xanthine Oxidase Inhibitor Febuxostat Suppresses Adipogenesis and Activates Nrf2. Antioxidants (Basel). 2023;12(1):133. doi: 10.3390/antiox12010133.
- Dong M, Cui Z, Liu Y, et al. Effects of Febuxostat Therapy on Circulating Adipokine Profiles in Patients with Overweight or Obesity and Asymptomatic Hyperuricemia: A Randomized Controlled Study. Obes Facts. 2024;17(5):524-534. doi: 10.1159/000540701.
- Орлова І.В., Станіславчук М.А. Ефективність уратознижувальної терапії із застосуванням алопуринолу та фебуксостату у хворих на подагру. Вісник наукових досліджень. 2018;3:34-38.
- Neilson J, Bonnon A, Dickson A, Roddy E. Guideline Committee. Guideline Committee. Gout: diagnosis and management-summary of NICE guidance. BMJ. 2022;378:o1754. doi: 10.1136/bmj.o1754.
- Nomura J, Kobayashi T, So A, Busso N. Febuxostat, a Xanthine Oxidoreductase Inhibitor, Decreases NLRP3-dependent Inflammation in Macrophages by Activating the Purine Salvage Pathway and Restoring Cellular Bioenerge–tics. Sci Rep. 2019;9(1):17314. doi: 10.1038/s41598-019-53965-x.
- Hao G, Duan W, Sun J, Liu J, Peng B. Effects of febuxostat on serum cytokines IL-1, IL-4, IL-6, IL-8, TNF-α and COX-2. Exp Ther Med. 2019;17(1):812-816. doi: 10.3892/etm.2018.6972.