Журнал «Здоровье ребенка» Том 20, №4, 2025
Вернуться к номеру
Роль серотоніну та мелатоніну у формуванні клінічних проявів функціональних гастроінтестинальних розладів, що супроводжуються абдомінальним болем, у дітей в умовах воєнного стану
Авторы: Слюсар Н.А., Кривопустов С.П.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
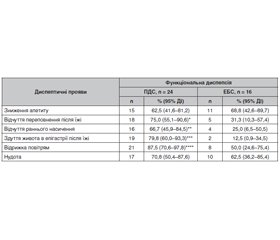
Актуальність. Функціональна диспепсія та синдром подразненого кишечника — найбільш поширені функціональні гастроінтестинальні розлади у дітей шкільного віку. Метаболіти триптофану, зокрема серотонін та мелатонін, беруть участь у патогенезі функціональних гастроінтестинальних розладів у дітей, модулюючи їх клінічні прояви, що особливо виражено в умовах підвищеного стресового навантаження. Мета: вивчити роль серотоніну та мелатоніну у формуванні клінічних проявів функціональних гастроінтестинальних розладів, що супроводжуються абдомінальним болем, у дітей в умовах воєнного стану. Матеріали та методи. У дослідженні взяли участь 74 пацієнти віком від 6 до 17 років із функціональними гастроінтестинальними розладами. Усі пацієнти пройшли клінічне обстеження, що включало оцінку інтенсивності абдомінального болю та рівня тривожності. Додатково було проведено визначення концентрації серотоніну в сироватці крові та рівня мелатоніну натще у зразках слини. Результати. При проведенні дослідження виявлено вищу інтенсивність абдомінального болю у дітей з епігастральним больовим синдромом та синдромом подразненого кишечника з діареєю порівняно з пацієнтами з постпрандіальним дистрес-синдромом та синдромом подразненого кишечника із запором (р < 0,001). У дітей з функціональною диспепсією значно частіше реєструвалися диспептичні симптоми, як-от відчуття переповнення (p = 0,016), раннє насичення (p = 0,024), здуття живота в епігастрії (p < 0,001) та відрижка (p = 0,025), тоді як між варіантами синдрому подразненого кишечника диспептичні прояви не відрізнялися. Виявлені диференційовані зміни рівнів серотоніну та мелатоніну (р < 0,05): їх зниження при постпрандіальному дистрес-синдромі та синдромі подразненого кишечника із запором і підвищення при синдромі подразненого кишечника з діареєю, що вказує на різні патофізіологічні механізми функціональних гастроінтестинальних розладів. Кореляційний аналіз виявив взаємозв’язки між інтенсивністю абдомінального болю, тривожністю й концентраціями серотоніну та мелатоніну, що підтверджує роль нейрогормональних змін у патогенезі цих нозологій. Висновки. Результати дослідження підтверджують патогенетичну роль серотоніну та мелатоніну у формуванні клінічних проявів функціональної диспепсії та синдрому подразненого кишечника, що створює передумови для розробки нових патогенетично обґрунтованих терапевтичних стратегій.
Background. Functional dyspepsia and irritable bowel syndrome are the most prevalent functional gastrointestinal disorders among school-aged children. Tryptophan metabolites, including serotonin and melatonin, are involved in the pathogenesis of functional gastrointestinal disorders in children by modulating their clinical manifestations, with these effects being particularly pronounced under increased stress conditions. The purpose was to examine the role of serotonin and melatonin in the development of clinical manifestations of functional gastrointestinal disorders associated with abdominal pain in children during wartime. Materials and methods. A total of 74 children aged 6–17 years diagnosed with functional gastrointestinal disorders were enrolled in the study. All patients underwent clinical examination that included evaluation of abdominal pain severity and anxiety levels. Laboratory analyses included measurements of serum serotonin and fasting salivary melatonin concentrations. Results. The study demonstrated significantly greater abdominal pain intensity in children with epigastric pain and diarrhea-predominant irritable bowel syndrome compared to those with postprandial distress syndrome and constipation-predominant irritable bowel syndrome (p < 0.001). Patients with functional dyspepsia exhibited significantly higher prevalence of dyspeptic symptoms, including postprandial fullness (p = 0.016), early satiety (p = 0.024), epigastric bloating (p < 0.001), and belching (p = 0.025), while no differences in dyspeptic manifestations were observed between irritable bowel syndrome subtypes. Notably, distinct patterns of serotonin and melatonin alterations were identified (p < 0.05): their decrease in postprandial distress syndrome and constipation-predominant irritable bowel syndrome versus an elevation in diarrhea-predominant irritable bowel syndrome, suggesting divergent pathophysiological mechanisms underlying these functional gastrointestinal disorders. Correlation analysis revealed associations between abdominal pain intensity, anxiety, and concentrations of serotonin and melatonin, thereby supporting the role of neurohormonal changes in the pathogenesis of these conditions. Conclusions. Our results substantiate the pathogenetic involvement of serotonin and melatonin in the development of clinical manifestations of functional dyspepsia and irritable bowel syndrome, which creates the prerequisites for the development of new pathogenetically justified therapeutic strategies.
функціональна диспепсія; синдром подразненого кишечника; абдомінальний біль; серотонін; мелатонін; діти
functional dyspepsia; irritable bowel syndrome; abdominal pain; serotonin; melatonin; children
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Волосовець О.П., Крючко Т.О., Марушко Ю.В., Шадрін О.Г., Волосовець Т.М. та ін. Патоморфоз хвороб органів травлення алергічного та неалергічного генезу у дітей України в динаміці 25-річного спостереження. Світ медицини та біології. 2022;3(81):40-45. doi: 10.26724/2079-8334-2022-3-81-40-45.
- Бєлоусова О.Ю., Зімницька Т.В., Казарян Л.В. Оцінка якості життя в дітей із поєднанням функціональної диспепсії та синдрому подразненого кишечника. Сучасна педіатрія. Україна. 2023;1(129):23-27. doi: 10.15574/SP.2023.129.23.
- Krynicka P, Kaczmarczyk M, Skonieczna-Żydecka K, Cembrowska-Lech D, Podsiadło K et al. The burden of irritable bowel syndrome and functional dyspepsia in Poland: a cross-sectional study from West Pomeranian Voivodship. BMC Gastroenterol. 2025 Jan 9;25(1):8. doi: 10.1186/s12876-024-03580-6.
- Vermeijden NK, de Silva L, Manathunga S, Spoolder D, Korte–rink J et al. Epidemiology of Pediatric Functional Abdominal Pain Disorders: A Meta-Analysis. Pediatrics. 2025 Feb 1;155(2):e2024067677. doi: 10.1542/peds.2024-067677.
- Недельська С.М., Самохін І.В., Кряжев О.В., Ярцева Д.О., Бессікало Т.Х., Кляцька Л.І. Функціональні розлади шлунково-кишкового тракту у дітей різних вікових груп (огляд літератури). Запорізький медичний журнал. 2024;26(1):66-71. https://doi.org/10.14739/2310-1210.2024.1.290950.
- Vernon-Roberts A, Alexander I, Day AS. Systematic Review of Pediatric Functional Gastrointestinal Disorders (Rome IV Criteria). J. Clin. Med. 2021;10(21):5087. https://doi.org/10.3390/jcm10215087.
- Heuckendorff S, Johansen MN, Overgaard C, Johnsen SP, Thomsen JL et al. Six-year-old children had greater risks of functional gastrointestinal disorders if their parents had mental health conditions. Acta Paediatr. 2022 Oct;111(10):2029-2037. doi: 10.1111/apa.16459.
- Слюсар Н.А., Волосовець О.П., Кривопустов С.П., Салтанова С.Д. Вплив нейротрансмітерів на перебіг функціональних гастроінтестинальних розладів, асоційованих з порушеннями емоційно-вольової сфери, що обумовлені стресом, у дітей. Здоров’я дитини. 2024;19(4):50-60.
- Roth W, Zadeh K, Vekariya R, Ge Y, Mohamadzadeh M. Tryptophan Metabolism and Gut-Brain Homeostasis. Int J Mol Sci. 2021 Mar 15;22(6):2973. doi: 10.3390/ijms22062973.
- Dinevari FM, Jafarzadeh F, Sarmadian JA, Abbasian S, Nikniaz Z, Riazi A. The effect of melatonin on irritable bowel syndrome patients with and without sleep disorders: a randomized double-blinded placebo-controlled trial study. BMC Gastroenterol. 2023 Apr 25;23(1):135. doi: 10.1186/s12876-023-02760-0.
- Chen KH, Zeng BY, Zeng BS, Sun CK, Cheng YS et al. The efficacy of exogenous melatonin supplement in ameliorating irritable bowel syndrome severity: A meta-analysis of randomized controlled trials. J Formos Med Assoc. 2023 Mar;122(3):276-285. doi: 10.1016/j.jfma.2022.10.001.
- Tao E, Zhu Z, Hu C, Long G, Chen B et al. Potential roles of enterochromaffin cells in early life stress-induced irritable bowel syndrome. Front Cell Neurosci. 2022;16:837166. doi: 10.3389/fncel.2022.837166.
- Schiopu CG, Stefanescu C, Bolos A, Diaconescu S, Gilca-Blanariu GE et al. Functional Gastrointestinal Disorders with Psychiatric Symptoms: Involvement of the Microbiome-Gut-Brain Axis in the Pathophysiology and Case Management. Microorganisms. 2022 Nov 7;10(11):2199. doi: 10.3390/microorganisms10112199.
- Guzel T, Mirowska-Guzel D. The Role of Serotonin Neurotransmission in Gastrointestinal Tract and Pharmacotherapy. Molecules. 2022. Mar;27(5):1680. doi: 10.3390/molecules27051680.
- Najjar SA, Hung LY, Margolis KG. Serotonergic Control of Gastrointestinal Development, Motility, and Inflammation. Compr Physiol. 2023 Jun 26;13(3):4851-4868. doi: 10.1002/cphy.c220024.
- Matiș L, Daina LG, Maris L, Ghitea TC, Trifan DF et al. Variety of Serotonin Levels in Pediatric Gastrointestinal Disorders. Diagnostics (Basel). 2023 Dec 15;13(24):3675. doi: 10.3390/diagnostics13243675.
- Fowler S, Hoedt EC, Talley NJ, Keely S, Burns GL. Circadian Rhythms and Melatonin Metabolism in Patients with Disorders of Gut-Brain Interactions. Front Neurosci. 2022 Mar 9;16:825246. doi: 10.3389/fnins.2022.825246.
- Vaccaro R, Casini A, Severi C, Lamazza A, Pronio A et al. Serotonin and Melatonin in Human Lower Gastrointestinal Tract. Diagnostics (Basel). 2023 Jan 5;13(2):204. doi: 10.3390/diagnostics13020204.
- Oh A, Koehler A, Yonker M, Troester M. Sleep Disorders and Chronic Pain Syndromes in the Pediatric Population. Semin Pediatr Neurol. 2023 Dec;48:101085. doi: 10.1016/j.spen.2023.101085.
- Семен М.О., Личковська О.Л. Рівень особистісної тривожності та соматизації у дітей з синдромом подразненого кишечника. Здоров’я дитини. 2023;18(1):53-59 doi: 10.22141/2224-0551.18.1.2023.1559.
- Bradshaw S, Brinkley A, Scanlan B, Hopper L. The burden and impact of recurrent abdominal pain — exploring the understanding and perception of children and their parents. Health Psychol Behav Med. 2022 Sep 21;10(1):888-912. doi: 10.1080/21642850.2022.2121710.
- Volosovets OP, Vyhovska OV, Kryvopustov SP, Mozyrska OV, Yemets OV et al. Problems of providing medical care to children of Ukraine as a result of russian aggression. Child’s Health. 2023;18(3):9-13. doi: https://doi.org/10.22141/2224-0551.18.3.2023.1578.
- Індекс майбутнього (Індекс добробуту дітей). Укрінформ. [Internet]. 2024 р. Лютий 28 [cited 2025 May 2]. Доступно з: https://www.ukrinform.ua/rubric-society/3833388-riven-dobrobutu-ditej-v-ukraini-visij-serednogo.html.
- Чабан О.С., Хаустова О.О. Медико-психологічні наслідки дистресу війни в Україні: що ми очікуємо та що потрібно враховувати при наданні медичної допомоги. Укр. мед. часопис. 2022;4(150). doi: 10.32471/umj.1680-3051.150.232297.
- Hyams JS, Di Lorenzo C, Saps M, Shulman RJ, Staiano A, Tilburg M. Childhood functional gastrointestinal disorders: child/adolescent. Gastroenterology. 2016;150(6):1456-68. doi.Org/10.1053/j.gastro.2016.02.015.
- Наказ Міністерства охорони здоров’я України від 28 червня 2022 року № 1122. Методичні рекомендації щодо знеболення постраждалих на етапах евакуації.
- Марушко Т.В., Козачук В.Г., Тараненко Т.В., Смульська Н.Є. Синдром підвищеної тривоги як фактор порушення поведінки та самопочуття дитини під час воєнного стану. Здоров’я України 21 сторіччя. 2024;4 (565):48-49.