Вступ
Афазія є одним з найбільш інвалідизуючих наслідків ішемічного інсульту [12]. Вона не тільки впливає на здатність людини до спілкування, але й має серйозні наслідки щодо якості життя, самооцінки та соціальних взаємодій. Постінсультна афазія може проявлятися в різних формах — від труднощів з пошуком слів до повної втрати мовлення, розуміння, читання або письма [3–5].
Мовна й логопедична терапія (МЛТ) залишається золотим стандартом реабілітації пацієнтів з афазією. Хоча в багатьох пацієнтів спостерігається певний ступінь спонтанного відновлення в перші тижні та місяці після інсульту, користь МЛТ у поліпшенні цього відновлення й забезпеченні довготривалого покращання добре задокументована [6]. Однак ступінь відновлення варіює, і приблизно одна третина пацієнтів, які перенесли інсульт, продовжують жити з хронічною афазією [7]. Така варіабельність підкреслює необхідність додаткових методів лікування, які можуть посилити ефекти МЛТ і дати надію тим, хто має стійкі розлади мовлення [3].
Церебролізин, біологічний препарат, що складається з низькомолекулярних пептидів і амінокислот, було досліджено завдяки його перспективним нейропротекторним і нейротрофічним властивостям. Позитивні властивості пояснюються здатністю Церебролізину імітувати дію ендогенних нейротрофічних факторів, що сприяє нейропротекції та неврологічному відновленню [8]. Корисні ефекти Церебролізину пов’язані зі зменшенням окисного стресу, запалення й апоптозу в головному мозку [9]. Результати кількох клінічних досліджень свідчать про його терапевтичний потенціал у пацієнтів з неврологічними розладами, включно з гострим ішемічним інсультом [10–15]. Ці дослідження повідомляли про поліпшення клінічних результатів, зменшення об’єму інфаркту та покращене неврологічне відновлення. Церебролізин загалом добре переносився в клінічних випробуваннях і був включений до кількох клінічних настанов [16–18].
Хоча використання Церебролізину у відновленні після ішемічного інсульту добре вивчене, його специфічна ефективність у поліпшенні мовної функції, особливо при нефлюентній афазії, потребує подальших досліджень. У дослідженні, яке оцінювало ефективність Церебролізину в пацієнтів з афазією Брока після першого гострого ішемічного інсульту в басейні лівої середньої мозкової артерії, було продемонстровано, що Церебролізин, використаний як допоміжна терапія, може привести до вірогідного поліпшення порівняно з плацебо [19].
Попри ці результати, аналіз наукової літератури виявив значний дефіцит досліджень, які безпосередньо вивчали б роль Церебролізину в лікуванні афазії. Недостатня кількість досліджень, спрямованих на вивчення відновлення мовної функції за допомогою Церебролізину, підкреслює наявність значної прогалини в сучасних клінічних знаннях. Клінічне дослідження ESCAS (Ефективність і безпека Церебролізину в лікуванні афазії після гострого ішемічного інсульту) було розроблено для заповнення цієї прогалини. Оцінюючи синергічний ефект Церебролізину та МЛТ, це дослідження мало на меті надати нові знання, які можуть покращити терапевтичні підходи до реабілітації пацієнтів з нефлюентною афазією.
Матеріали та методи
Дослідження ESCAS було проспективним рандомізованим подвійним сліпим академічним дослідженням, спрямованим на оцінку ефективності й безпеки Церебролізину в комбінації з логопедичною терапією порівняно з плацебо (фізіологічний розчин) у комбінації з логопедичною терапією для лікування нефлюентної афазії після гострого ішемічного інсульту. Усі дані та матеріали були оприлюднені в Harvard Dataverse і доступні за посиланням: https://doi.org/10.7910/DVN/Z8WAKW.
Дослідження проводилося після затвердження препарату Європейським агентством з лікарських засобів і його реімбурсації в кількох країнах світу з метою вивчення його ефектів на ширшу популяцію пацієнтів з інсультом і клінічних результатів, отже, воно було класифіковане як постмаркетингове дослідження (фаза 4).
Фокус дослідження на нефлюентну афазію дозволив використовувати об’єктивні методи оцінки результатів, забезпечивши комплаєнс пацієнтів. Не допускалося супутнє застосування Церебролізину для відновлення рухової активності. Набір пацієнтів тривав із червня 2020 року по жовтень 2022 року у двох румунських інсультних центрах (лікарні швидкої допомоги Cluj у Клуж-Напока та лікарні швидкої допомоги Pius Brînzeu в Тімішоарі), послідовно залучаючи відповідних пацієнтів з інсультом. Проведення дослідження було схвалено Комітетом з етики Університету медицини та фармації Iuliu Hațieganu (Клуж-Напока, Румунія; ref: 122/24.03.2020), а також відповідною комісією місцевої лікарні. Дослідження, а також супровідний протокол клінічного дослідження і протокол статистичного аналізу були проспективно зареєстровані в Міжнародному стандартному ідентифікаторі рандомізованих контрольованих досліджень з ідентифікатором ISRCTN54581790 (https://doi.org/10.1186/ISRCTN54581790) [20] і подані на основі рекомендацій CONSORT (Зведені стандарти звітності про дослідження) [21].
Критерії включення в дослідження:
— радіологічне (комп’ютерна або магнітно-резонансна томографія) та клінічне підтвердження гострого ішемічного інсульту в зоні лівої середньої мозкової артерії;
— наявність нефлюентної афазії;
— включення в дослідження між 3-м і 5-м днем після інсульту;
— праворукість;
— щоденне використання румунської мови як рідної;
— підписання інформованої згоди.
Критерії виключення з дослідження:
— наявність в анамнезі симптомного ішемічного або геморагічного інсульту;
— тяжкі порушення розуміння, які можуть ускладнити сприйняття інформованої згоди або інструкцій, наприклад флюентна афазія (афазія Верніке) або глобальна афазія;
— наявність в анамнезі епілепсії або електроенцефалографічно підтверджених епілептичних розрядів;
— тяжка хронічна ниркова або печінкова недостатність, що визначається рівнем аспартатамінотрансферази (AST) або аланінамінотрансферази (ALT) в чотири рази більше від норми або рівнем креатиніну > 4 мг/дл;
— наявність небезпечних для життя захворювань;
— необоротні порушення слуху або зору, які можуть ускладнити обстеження;
— наявність нейродегенеративних або психіатричних захворювань.
Процедура дослідження
Після початку дослідження учасники були розподілені на 2 групи лікування і було здійснено перший візит (на 3–5-й день після інсульту). Цей базовий візит (день 0) передбачав збір демографічних даних та історії хвороби учасників. Комплексні оцінки проводилися з використанням таких інструментів, як Western Aphasia Battery (WAB) і National Institutes of Health Stroke Scale (NIHSS). Через місяць дослідження, а саме на 30 ± 3-й день, було здійснено другий візит. Під час нього оцінки проводилися за допомогою WAB, NIHSS, індексу Бартел (BI) і модифікованої шкали Ренкіна (mRS). Будь-які побічні явища (ПЯ) або серйозні побічні явища (СПЯ), які виникли в учасників, також були ретельно задокументовані. Через два місяці після базового візиту, на 60 ± 3-й день, відбувся третій візит. Було зроблене таке саме оцінювання показників, як і під час попереднього візиту, включно з моніторингом будь-якого ПЯ або СПЯ. Четвертий і останній візит відбувся на 90 ± 3-й день. Ця заключна сесія віддзеркалювала оцінки й процедури моніторингу другого і третього візитів. Паралельно з візитами учасники проходили лікування за структурованою схемою: отримували внутрішньовенну інфузію 30 мл Церебролізину (розведеного у фізіологічному розчині, загальний об’єм 250 мл) або фізіологічного розчину (250 мл), а також їм проводилися сеанси логопедичної терапії тривалістю одну годину на день протягом 10 днів із 2-тижневими інтервалами, що становило загалом 3 цикли лікування протягом періодів з 1-го по 14-й день дослідження, з 29-го по 42-й і з 57-го по 70-й день. Загальний обсяг МЛТ для обох груп становив 30 годин.
Сеанси логопедичної терапії проводили нейро-психологи, які мають досвід щодо МЛТ, оскільки в цій галузі не існує додаткової сертифікації національного рівня. Задля забезпечення узгодженості терапевтичного підходу і матеріалів зміст і ресурси для логопедичної терапії були стандартизовані в усіх навчальних центрах з використанням принципів і практичних застосувань, описаних у розділі IV «Оцінка та реабілітація» посібника з афазії Alfredo Ardila (Міжнародний університет Флориди, 2014). Під час індивідуальних логопедичних сеансів пацієнти отримували різні робочі матеріали для дотримання всього протоколу відновлення й охоплення широкого кола прикладів, що дозволяло їм продовжувати відновлення самостійно або за підтримки родини після завершення сеансів терапії зі спеціалістами. Інтенсивність занять було адаптовано відповідно до потреб пацієнтів, а зміст було персоналізовано з урахуванням інших бар’єрів, таких як грамотність, на основі оцінки терапевта. З огляду на обмеження, накладені пандемією, деякі сеанси проводилися дистанційно, щоб мінімізувати контакт пацієнтів з терапевтами, особливо під час широкомасштабних локдаунів у березні 2020 року.
Засліплення та рандомізація
Дослідження проводилося в подвійних сліпих умовах, і це гарантувало, що дослідники, дослідницький персонал і пацієнти не знали, яка схема лікування була призначена. Враховуючи бурштиновий колір Церебролізину, під час введення препарату використовували кольорові інфузійні системи. Рандомізацію проводили як 1 : 1 по 4 блоки, а конверти, призначені для кожного зареєстрованого пацієнта, передавали медсестрам, відповідальним за приготування інфузійного розчину, які були виключені з проведення інших процедур, пов’язаних з дослідженням, і отримали суворі вказівки не розголошувати будь-яку інформацію про призначене лікування. Лікувальні конверти відкривалися лише після того, як початкова інфузія пацієнта була готова. Пацієнтам, які відповідали критеріям включення та виключення, присвоювався випадковий номер з попередньо створеного списку. На основі цього списку запечатані непрозорі конверти для рандомізації/надзвичайних ситуацій були передані (1) в дослідницький центр на випадок, коли розкриття буде необхідним через потенційну шкоду для пацієнта; (2) особі, яка готує розчин для інфузії; і (3) координатору дослідження. Після відкриття дата і час були записані на конвертах, і вони були підписані особою, яка їх відкрила. Будь-яке передчасне розкриття досліджуваних речовин було негайно задокументовано дослідником, і про це повідомлено координатору. Засліплення дослідження було скасовано після закриття бази даних і визначення популяцій аналізу.
Оцінювання
WAB є інструментом для оцінки мовної функції в дорослих з підозрою на неврологічні розлади внаслідок інсульту, травми голови або деменції [22]. Він допомагає визначити наявність, тяжкість і тип афазії, а також встановлює вихідний рівень для моніторингу змін під час терапії, визначає ключові ділянки мовних можливостей пацієнта, які необхідно покращити під час лікування, і визначає розташування ураження, яке спричинило афазію. WAB націлений на англомовних дорослих і підлітків з неврологічним розладом віком від 18 до 89 років. WAB перевіряє як лінгвістичні навички (мовлення як таке, вільне мовлення, розуміння на слух, читання та письмо), так і нелінгвістичні навички (такі як малювання, обчислення, блок-дизайн і апраксія). У цьому дослідженні використовувалася румунська лінгвістично валідована версія WAB [23]. Коефіцієнт афазії (AQ), який використовувався для нашого аналізу, був отриманий за допомогою повного набору оцінок WAB, що охоплював субтести спонтанного мовлення, розуміння, повторення й називання. AQ, який коливається від 0 до 100, є комплексним показником загальної мовної функції, де вищі показники вказують на кращі мовні здібності та меншу тяжкість афазії. Зміна показника AQ вважається клінічно вірогідною, якщо вона перевищує мінімально важливий поріг клінічної різниці в 5 балів, оскільки це відображає вірогідне поліпшення або зниження комунікативної функції пацієнта [24–26].
NIHSS — це шкала з 15 пунктів для оцінки неврологічного дефіциту, яка охоплює рівень свідомості, погляд, поля зору, параліч обличчя, рухові функції, атаксію кінцівок, афазію, дизартрію та неуважність [27].
mRS — функціональна шкала результатів, що вимірює загальні результати [28]. Вона використовується для класифікації результатів і рівня інвалідності після інсульту. mRS — це 7-бальна порядкова шкала, де 0 балів вказує на відсутність залишкових симптомів взагалі, а 6, найгірший бал, надається у випадку смерті.
Індекс Бартел — це порядкова шкала, яка використовується для вимірювання продуктивності в повсякденній діяльності [29, 30]. Оцінюються десять змінних, що описують повсякденну діяльність і мобільність, причому вищій бал свідчить про більшу здатність функціонувати самостійно після виписки з лікарні.
Кінцеві точки дослідження
Основною метою дослідження ESCAS була оцінка ефективності Церебролізину та логопедичної терапії порівняно з плацебо (фізіологічний розчин) і логопедичною терапією через 30, 60 і 90 днів після початку лікування. Ефективність оцінювали за шкалою WAB (версія з перекладом на румунську мову) у кожній часовій точці. Первинною кінцевою точкою була зміна показника WAB-AQ від вихідного рівня до кожного періоду спостереження (30, 60 і 90 днів).
Вторинні цілі дослідження ESCAS включали: (1) оцінку ефективності Церебролізину та логопедичної терапії порівняно з плацебо (фізіологічний розчин) і логопедичною терапією через 30, 60 і 90 днів після початку лікування з використанням вимірювання моторних, неврологічних і глобальних функціональних результатів. Ці результати оцінювали за допомогою NIHSS, BI та mRS у кожній часовій точці; (2) оцінку безпеки Церебролізину та логопедичної терапії порівняно з плацебо (фізіологічний розчин) і логопедичною терапією через 30, 60 і 90 днів після початку лікування. Безпеку оцінювали шляхом порівняння частоти ПЯ та СПЯ між 2 групами лікування. Крім того, ми вимірювали специфічні серцево-судинні (такі як інсульт, інфаркт міокарда, атеросклероз, стеноз судин, а також їх рецидиви, але не обмежуючись цим переліком), гематологічні (включно з анемією та дефіцитом вітаміну B9 або B12) побічні ефекти, побічні ефекти з боку ниркової системи (включно з гіперуремією, гіперурикемією та інфекціями сечовивідних шляхів) і метаболічні (включно з дисліпідемією, цукровим діабетом і атеросклерозом) побічні ефекти. Оцінка вторинних результатів була зосереджена на оцінці змін у балах за шкалою NIHSS від базового рівня до кожної точки спостереження (30, 60 і 90 днів). Слід зазначити, що оцінювання за mRS та індексом Бартел розпочалося через 30 днів після базового рівня, з подальшим оцінюванням змін, які виявлялися під час кожного подальшого спостереження. Дослідження також відстежувало частоту ПЯ та СПЯ.
Популяції дослідження
Популяція за протоколом (PP) включала всіх учасників дослідження, які дотримувалися протоколу дослідження, отримували лікування, що відповідає групі, до якої вони були віднесені після рандомізації, мали щонайбільше мінімальні відхилення від протоколу і не мали пропущених значень при оцінці за WAB і NIHSS під час візитів 2, 3 або 4 або пропущених значень за mRS і BI під час візитів 3 або 4. Популяція «намір лікувати» (ITT) включала всіх учасників дослідження, які були зареєстровані в дослідженні та рандомізовані, незалежно від подальшого дотримання ними протоколу чи передчасного припинення участі. Цей набір аналізів використовувався для оцінки ефективності досліджуваного лікування з урахуванням пацієнтів, які не дотримуються протоколу (невідповідність, відмова від лікування, СПЯ, непередбачені події), таким чином краще подавалися очікувані результати лікування в клінічній практиці. У популяцій PP та ITT використовувалися однакові статистичні процедури. Популяція безпеки включала всіх учасників дослідження, які були зареєстровані в дослідженні й отримали принаймні 1 дозу лікування, незалежно від подальшого дотримання ними протоколу або передчасного припинення. На відміну від ITT, аналіз популяції безпеки зосереджувався на побічних і дрібних побічних ефектах, викликаних лікуванням, таким чином оцінювали параметри безпеки продуктів.
Визначення розміру вибірки
Перед клінічним дослідженням ми визначили розмір вибірки для дослідження ESCAS за допомогою аналізу потужності з використанням G*Power, 3.1.9.7 [31]. Припустивши середній розмір ефекту d = 0,5, помилку альфа = 0,05 і бета = 0,2 з коефіцієнтом розподілу 1 для U-тесту Вілкоксона — Манна — Уїтні між 2 групами, ми отримали розмір вибірки 53 пацієнти на групу. Щоб забезпечити похибку для таких ситуацій, як відмова пацієнта, СПЯ або порушення протоколу, ми вирішили залучити принаймні 120 пацієнтів для нашого дослідження — по 60 осіб для кожної групи.
Аналіз даних
Ми використовували Microsoft Excel 2019 (Microsoft Corporation, Redmond, WA) для підготовки й очищення даних і R, v. 4.3.1 і v. 4.4.2 (R Core Team, Vienna, Austria) і RStudio (Posit Software, PBC, Boston, MA) для аналізу даних, завантажуючи ggplot2 [32], readxl [33], xlsx [34], MANOVA.RM [35] і psych [36]. Для порівняння числових значень парних вибірок було обчислено диференціальні значення для кожної пари значень і використано тест Вілкоксона зі знаковим рангом з розташуванням нульової гіпотези = 0. Для порівняння числових значень непарних вибірок було виконано критерії рангової суми Вілкоксона з нульовою гіпотезою різниці розташування, що дорівнює 0.
Враховуючи використання кількох тестів, ми використали корекцію Бонферроні для коригування значень P. Для WAB-AQ і NIHSS значення P порівнянь між вихідним рівнем і наступними відвідуваннями були скориговані на коефіцієнт 6, а значення P порівнянь між групами лікування щодо зміни від вихідного рівня були скориговані на коефіцієнт 3. Для mRS і індексу Бартел значення P порівнянь між візитами 2 і 3, 2 і 4 відповідно було скориговано на коефіцієнт 4, а значення P порівняння між оцінками під час відвідувань 2, 3 і 4 відповідно були скориговані на коефіцієнт 3.
Для порівняння різниці в поширеності варіантів 1 дихотомічної або номінальної змінної серед груп іншої дихотомічної або номінальної змінної (тобто перевірка зв’язку між 2 дихотомічними/номінальними змінними) використовувався тест χ2 або, якщо його припущення були порушені (переважно через невелику кількість пацієнтів у будь-якій групі), використовувався точний критерій Фішера. Там, де це було застосовано, повідомлялося про двостороннє значення P. Помилка типу 1 вважалася рівною альфа = 0,05, тому результати вважалися статистично вірогідними для P < 0,05. Основною оцінкою ефекту лікування була різниця в середній зміні показника WAB-AQ порівняно з початковим рівнем між групою Церебролізину і групою плацебо на 30, 60 і 90-й день відповідно. Крім того, ефект d Cohen і пов’язаний з ним довірчий інтервал (ДІ) були обчислені за допомогою пакета psych. Повний протокол статистичного аналізу було опубліковано до розкриття бази даних [20].
Крім того, у вибірці за протоколом ми використовували функцію повторних вимірювань, яка забезпечує надійний дисперсійний аналіз змішаних моделей на основі повторної вибірки, який не залежить від нормальності та гомоскедастичності даних, для оцінки відмінностей у клінічних балах через кількість візитів (як змінна в межах суб’єктів), лікування (як змінна між суб’єктами), а також їх взаємодію. Функцію було виконано з 10 000 ітерацій (значення за замовчуванням), без розпаралелювання і з початковим числом 19 990 304, повертаючи значення P до 10 знаків після коми. Ми повідомили про значення P, отримані шляхом повторної вибірки.
Результати
Дослідження включало 132 дорослих пацієнтів у період із червня 2020 року по жовтень 2022 року, коли було досягнуто достатнього розміру вибірки, з яких 123 пацієнти відповідали критеріям популяції ITT (візит 2: Церебролізин n = 61, плацебо n = 63; візит 3: Церебролізин n = 59, плацебо n = 63; візит 4: Церебролізин n = 58, плацебо n = 62) і 120 для популяції PP (Церебролізин n = 58, плацебо n = 62). Блок-схема зарахування пацієнтів за протоколом доступна на рис. 1. Аналіз групових відмінностей, проведений на популяції PP, продемонстрував результати, майже аналогічні таким у популяції ITT. Демографічні характеристики та рівні показників на початку дослідження доступні в табл. 1. Продемонстровано, що вихідні дані в обох групах були порівнянними.
Різниця показників WAB-AQ на початку дослідження
Для кожного пацієнта ми проаналізували відмінності між значеннями WAB під час наступних візитів і значеннями WAB на початковому рівні. Подані результати PP (додаткові аналізи доступні в таблицях S5-S8), а дані ITT доступні в додатковому матеріалі (таблиці S1-S4). Під час другого візиту група Церебролізину продемонструвала середнє збільшення порівняно з початковим рівнем на 17,366 ± 10,303 (95% ДІ 14,567–20,075), що є статистично вірогідним порівняно з вихідним рівнем (P < 0,001); група плацебо також продемонструвала середнє збільшення порівняно з вихідним рівнем на 10,266 ± 9,688 (95% ДІ 7,806–12,726; P < 0,001), що було нижче, ніж у групі Церебролізину, з різницею між середніми значеннями 7,099 (95% ДІ 3,478–10,721) бала (значення Р скориговано для кількох порівнянь; P < 0,001). Коефіцієнт d Cohen для різниці в поліпшенні між групами дорівнював 0,717 (95% ДІ 0,346–1,085), що означає середній або виражений ефект Церебролізину в поєднанні з логопедичною терапією щодо відновлення мовної функції порівняно з плацебо.
Під час третього візиту в групі Церебролізину було відзначено середнє збільшення порівняно з вихідним рівнем на 28,166 ± 13,601 (95% ДІ 24,589–31,742) бала (P < 0,001). Група плацебо також мала збільшення на 14,798 ± 16,231 (95% ДІ 10,676–18,92) бала (P < 0,001), зі статистично вірогідною різницею між групами щодо підвищення середнього бала на 13,368 (95% ДІ 7,966–18,77; P < 0,001). Коефіцієнт d Cohen дорівнював 0,898 (95% ДІ 0,52–1,272), демонструючи виражений ефект Церебролізину порівняно з плацебо.
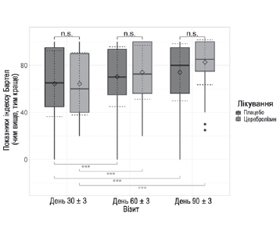
До четвертого візиту група Церебролізину досягла середнього збільшення на 35,579 ± 16,316 (95% ДІ 31,289–39,869; P < 0,001), а група плацебо продемонструвала середнє збільшення на 20,774 ± 12,486 бала (95% ДІ 17,603–23,945; P < 0,001), що було статистично вірогідно нижчим порівняно з групою Церебролізину з 14,805 (95% ДІ 9,521–20,089) бала (P < 0,001; рис. 2). Коефіцієнт d Cohen дорівнював 1,032 (95% ДІ 0,649–1,412), що вказувало на виражений ефект Церебролізину порівняно з плацебо.
Різниця показників за NIHSS на початку дослідження
Під час другого візиту показники за NIHSS продемонстрували статистично вірогідне зниження як у групі Церебролізину (3,069 ± 1,918 [95% ДІ 2,565–3,573]; P < 0,001), так і в групі плацебо (2,274 ± 1,32 [95% ДІ 1,939–2,609]; P < 0,001). Зниження, як правило, було вищим у групі Церебролізину на 0,795 (95% ДІ 0,194–1,395) бала (P = 0,058 з поправкою на численні порівняння). Коефіцієнт d Cohen = 0,49 (95% ДІ 0,125–0,852) для порівняння зниження між групами лікування продемонстрував середній розмір ефекту Церебролізину порівняно з плацебо.
Під час третього візиту група Церебролізину продемонструвала більше зниження показників за NIHSS (4,914 ± 2,786 [95% ДІ 4,181–5,646]) порівняно з групою плацебо (3,306 ± 1,807 [95% ДІ 2,848–3,765]), при цьому різниця між групами була статистично вірогідною (1,607 [95% ДІ 0,75–2,465]; P = 0,001). Коефіцієнт d Cohen становив 0,695 (95% ДІ 0,325–1,062), демонструючи середній або виражений ефект Церебролізину порівняно з плацебо.
До четвертого візиту спостерігалося статистично вірогідно більше зниження в групі Церебролізину (6,069 ± 3,260 [95% ДІ 5,212–6,926]) порівняно з групою плацебо (3,984 ± 2,161 [95% ДІ 3,435–4,533]), при цьому різниця між групами була статистично вірогідною (2,085 [95% ДІ 1,076–3,094]; P < 0,001). Коефіцієнт d Cohen дорівнював 0,765 (95% ДІ 0,393–1,135), що вказує на значно виражений ефект Церебролізину порівняно з плацебо (рис. 3).
mRS: аналіз вимірювань під час візитів 2, 3 і 4
Під час другого візиту середній бал у групі Церебролізину становив 2,931 ± 1,153, тоді як у групі плацебо він становив 2,839 ± 1,176, без статистично вірогідних відмінностей між групами (різниця між середніми значеннями 0,092 [95% ДІ від –0,329 до 0,513]; P > 0,999 з поправкою на численні порівняння). d Cohen = 0,08 (95% ДІ від –0,278 до 0,438), що свідчить про відсутність ефекту Церебролізину порівняно з плацебо в абсолютних значеннях mRS.
Під час третього візиту середній бал для групи Церебролізину становив 2,345 ± 1,101, тоді як у групі плацебо він становив 2,532 ± 1,224, без статистично вірогідних відмінностей між групами (0,187 [95% ДІ від –0,233 до 0,608]; P > 0,999). Коефіцієнт d Cohen = 0,162 (95% ДІ від –0,197 до 0,52), що свідчить про відсутність ефекту Церебролізину порівняно з плацебо в абсолютних значеннях mRS.
Під час останнього візиту середній бал для групи Церебролізину становив 1,759 ± 1,048, тоді як середній бал для групи плацебо становив 2,258 ± 1,280, з тенденцією до нижчих балів у групі Церебролізину порівняно з групою плацебо (0,499 [95% ДІ 0,078–0,921]; P = 0,081). Коефіцієнт d Cohen = 0,429 (95% ДІ 0,066–0,791), що демонструє малий або середній розмір ефекту Церебролізину порівняно з плацебо в абсолютних значеннях mRS.
Слід зазначити, що для обох груп значення під час третього та четвертого візитів були вірогідно знижені порівняно з показниками під час другого візиту (P < 0,001 з поправкою на багаторазові порівняння; рис. 4), а середнє зниження було більшим у групі Церебролізину порівняно з групою плацебо як для візиту 3 (0,28 [95% ДІ 0,093–0,466]; P = 0,01), так і для візиту 4 (0,592 [95 %) ДІ 0,315–0,868]; P < 0,001). Коефіцієнт d Cohen для порівняння зменшення mRS між групами дорівнював 0,548 (95% ДІ 0,182–0,912; середній розмір ефекту) і –0,79 (95% ДІ 0,416–1,16; великий розмір ефекту) для візитів 3 і 4 відповідно.
Індекс Бартел: аналіз вимірювань під час візиту 2, 3 і 4
Під час другого візиту середній бал у групі Церебролізину становив 64,310 ± 26,448, тоді як середній бал у групі плацебо становив 64,355 ± 28,000, без статистично вірогідної різниці між групами (різниця між середніми значеннями –0,044 [95% ДІ від –9,887 до 9,798]; P > 0,999 скориговано для кількох порівнянь). Коефіцієнт d Cohen = 0,002 (95% ДІ від –0,356 до 0,36), що не демонструє різниці ефекту між групами.
Під час третього візиту середній бал для групи Церебролізину становив 74,052 ± 22,950, тоді як у групі плацебо він дорівнював 70,323 ± 25,299, без статистично вірогідних відмінностей між групами (3,729 [95% ДІ від –4,994 до 12,453]; P > 0,999). Коефіцієнт d Cohen = = 0,155 (95% ДІ від –0,203 до 0,514), що не демонструє різниці ефектів між групами.
Під час останнього візиту середній бал для групи Церебролізину становив 82,586 ± 19,108, тоді як середній бал для групи плацебо становив 74,032 ± 24,240, без статистично вірогідних відмінностей між групами (8,554 [95% ДІ 0,687–16,421]; P = 0,153). Коефіцієнт d Cohen = 0,394 (95% ДІ 0,031–0,754), що показує невеликий розмір ефекту Церебролізину порівняно з плацебо для абсолютних значень індексу Бартел.
Треба зазначити, що в обох групах показники індексу Бартел під час третього та четвертого візиту були вірогідно знижені порівняно з другим візитом (P < 0,001 з поправкою на численні порівняння; рис. 5), а середнє збільшення було вищим у групі Церебролізину порівняно з групою плацебо як для візиту 3 (3,774 [95% ДІ 0,91–6,637]; P = 0,015), так і для візиту 4 (8,598 [95% ДІ 3,711–13,486]; P = 0,004). Різниця між групами в підвищенні значень індексу Бартел під час візитів 3 і 4 порівняно з другим візитом показала, що коефіцієнт d Cohen дорівнює 0,482 (95% ДІ 0,117–0,844; середній розмір ефекту Церебролізину порівняно з плацебо) і 0,65 (95% ДІ 0,282–1,017; середній або великий розмір ефекту Церебролізину порівняно з плацебо) відповідно.
Модель MANOVA на основі повторної вибірки
Для оцінки ефектів Церебролізину за клінічними шкалами в популяції РР було проведено дисперсійний аналіз змішаних моделей на основі повторної вибірки (табл. 2). З урахуванням ненормального розподілу даних було обрано дисперсійний аналіз на основі повторної вибірки через його надійність в обробці складних розподілів даних.
/52.jpg)
Що стосується основного результату цього дослідження (WAB-AQ), то при аналізі необроблених балів за 4 візити було встановлено статистично вірогідні відмінності між візитами (статистика типу Вальда [WTS] = 454,407; df = 3, P < 0,001; статистика типу ANOVA [ATS] = 252,908; df1 = 2,061; df2 = ∞, P < 0,001; на основі повторної вибірки P < 0,001), а також були статистично вірогідні відмінності, пов’язані з терміном взаємодії (візит — група) (WTS = 31,386; df = 3, P < 0,001; ATS = 19,768; df 1 = 2,061; df2 = ∞, P < 0,001; на основі повторної вибірки P < 0,001). Проте не було статистично вірогідних відмінностей між групами лікування (WTS = 0,327; df = 1, P = 0,567; ATS = 0,327, df1 = 1, df2 = 153,003; P = 0,568; на основі повторної вибірки P = 0,569). Хоча основний ефект лікування сам по собі не був вірогідним, вірогідна взаємодія вказує на те, що користь Церебролізину при афазії, за оцінкою WAB, стає більш вираженою із часом.
При аналізі відмінностей між показниками WAB-AQ під час наступних візитів порівняно з вихідним рівнем були виявлені статистично вірогідні відмінності між візитами (WTS = 238,11; df = 2, P < 0,001; ATS = 125,34; df1 = 1,936; df2 = ∞, P < 0,001; на основі повторної вибірки P < 0,001), між групами (WTS = 28,423; df = 1, P < 0,001; ATS = 28,423; df1 = 1, df2 = 151,93; P < 0,001; на основі повторної вибірки P < 0,001), а також статистично вірогідна взаємодія між групою лікування та візитом (WTS = 17,699; df = 2, P < 0,001; ATS = 10,188; df1 = 1,936; df2 = ∞, P < 0,001; на основі повторної вибірки P < 0,001).
Аналіз безпеки
Що стосується ПЯ, то не було вірогідної різниці в кількості пацієнтів із СПЯ між 2 групами (P = 0,381). Про загальні ПЯ повідомили 43,9 % пацієнтів у групі Церебролізину і 30,3 % у групі плацебо, хоча різниця не була статистично вірогідною (P = 0,105). Середня кількість побічних ефектів на одного пацієнта становила 0,894 у групі Церебролізину і 0,636 у групі плацебо (немає різниці між кількістю побічних ефектів у кожного пацієнта між групами; P = 0,134). Зокрема, для таких категорій ПЯ, як неврологічні, психіатричні, респіраторні, пов’язані з імунною системою та офтальмологічні, обидві групи мали однакові показники без істотних відмінностей. Найвищі відмінності в побічних ефектах між групами спостерігалися з боку шлунково-кишкового тракту (4,5 % у групі Церебролізину повідомили про побічні ефекти, тоді як у групі плацебо не було зареєстровано жодного; P = 0,244) і з боку кістково-суглобової системи (жодних побічних явищ не було зареєстровано в групі Церебролізину, тоді як 6,1 % пацієнтів у групі плацебо повідомили про ПЯ; P = 0,119).
Обговорення
Дослідження ESCAS мало на меті оцінити ефективність і безпеку Церебролізину в поєднанні з логопедичною терапією порівняно з плацебо (фізіологічним розчином) у поєднанні з логопедичною терапією для лікування нефлюентної афазії після гострого ішемічного інсульту. Цей підхід ґрунтується на результатах дослідження Jianu та інших, які досліджували роль Церебролізину в пацієнтів з афазією Брока після гострого ішемічного інсульту лівої середньої мозкової артерії. У результатах дослідження спостерігали вірогідне поліпшення мовних функцій, про що свідчать оцінки за шкалою WAB, підкреслюючи переваги Церебролізину порівняно з плацебо при застосуванні його як додаткового лікування [19]. Аналіз MANOVA надає докази того, що ефект лікування Церебролізином змінюється із часом. Це особливо очевидно у вірогідних ефектах взаємодії, які спостерігаються для шкал WAB, NIHSS і mRS. Отримані дані свідчать про те, що Церебролізин прискорює відновлення залежно від часу, що потенційно робить його цінним препаратом у реабілітації після інсульту.
Переглядаючи наші результати, можна зазначити, що демографічні характеристики й базові показники в групах Церебролізину і плацебо були порівняними між собою. Це гарантує, що будь-які спостережувані відмінності в результатах можна віднести до таких, що викликані досліджуваним лікуванням, а не зумовлені відмінностями між групами на базовому рівні.
Первинною кінцевою точкою в цьому дослідженні була зміна показників WAB від початкового рівня до кожного контрольного періоду через 30, 60 і 90 днів. Результати продемонстрували вірогідне поліпшення WAB-AQ як для груп Церебролізину, так і для груп плацебо в кожній часовій точці порівняно з вихідним рівнем. Ці висновки вказують на те, що використання логопедичної терапії як частини стандартної допомоги призвело до помітного зменшення невираженої афазії із часом. Однак важливо відзначити, що поліпшення, які спостерігалися в групі Церебролізину, були стабільно вірогідно більш вираженими, ніж у групі плацебо, з великими чисельними відмінностями. Це надає прямі докази на підтримку застосування Церебролізину на додаток до МЛТ у періоді реабілітації пацієнта з нефлюентною афазією після інсульту.
Вимірювання вторинних результатів, включно з NIHSS, індексом Бартел і mRS, також проводили для оцінки моторних, неврологічних і глобальних функціональних результатів.
Подібно до показників за WAB у групі плацебо реєструвалося вірогідне поліпшення цих показників у кожен момент часу порівняно з вихідним рівнем, що вказує на те, що логопедична терапія мала позитивний вплив на загальне одужання. Проте в групі Церебролізину спостерігалося вірогідно більш виражене поліпшення за всіма показниками порівняно з групою плацебо, що ще більше підтверджує роль Церебролізину у функціональному відновленні пацієнтів після інсульту.
Аналіз безпеки включав оцінку ПЯ і СПЯ в обох групах лікування. Під час дослідження не було виявлено жодних проблем стосовно безпеки Церебролізину. Частота ПЯ і СПЯ була подібною між групами Церебролізину та плацебо, що свідчить про те, що додавання Церебролізину до логопедичної терапії не призводило до підвищення ризику ПЯ [14, 17, 18, 37].
Результати цього дослідження дають цінну інформацію про потенційні переваги додавання Церебролізину до логопедичної терапії в реабілітації пацієнтів з постінсультною нефлюентною афазією. Виявлені тенденції свідчать про те, що Церебролізин може мати позитивний вплив на реабілітацію. Ці висновки потребують подальших підтверджень у більших великих дослідженнях з довшим періодом спостереження, щоб визначити, чи може Церебролізин статистично вірогідно покращити результати лікування пацієнтів. Крім того, хоча ми спостерігали поліпшення показників коефіцієнта афазії у групах плацебо, важливо визнати, що спонтанне неврологічне відновлення після інсульту також може призвести до цих позитивних результатів, і їх не можна пов’язувати виключно з логопедичною терапією.
Важливо визнати деякі обмеження цього дослідження, які можуть вплинути на можливість узагальнення результатів. Розмір вибірки, хоча й визначений шляхом ретельного аналізу потужності, міг обмежити можливість виявлення невеликих, але клінічно значущих відмінностей між групами лікування. Іншим визнаним обмеженням нашого дослідження є відсутність контролю за певними міжіндивідуальними змінними, такими як об’єм ураження, тяжкість інсульту та когнітивні порушення, що могло додатково вплинути на результати нашого дослідження.
Висновки
Дослідження ESCAS є важливим кроком у вивченні Церебролізину як допоміжної терапії для реабілітації пацієнтів з нефлюентною афазією після гострого ішемічного інсульту. Тенденції до поліпшення результатів при застосуванні Церебролізину свідчать про необхідність більш масштабних клінічних досліджень для підтвердження наших результатів. Афазія залишається складним станом, і пошук додаткових методів лікування, які можуть покращити одужання та якість життя пацієнтів, є надзвичайно важливим. Майбутні дослідження з більшим розміром вибірки, більшою тривалістю спостереження і більш суворим підходом до відбору учасників можуть дати більш чіткі відповіді щодо ефективності Церебролізину в реабілітації нефлюентної афазії.
Оригінал статті опубліковано
в Stroke. 2025;56:00-00. DOI: 10.1161/
STROKEAHA.124.049834
Список литературы
1. Huppertz V, Guida S, Holdoway A, Strilciuc S, Baijens L, Schols JMGA, van Helvoort A, Lansink M, Muresanu DF. Impaired nutritional condition after stroke from the hyperacute to the chronic phase: a systematic review and meta-analysis. Front Neurol. 2021;12:780080. doi: 10.3389/fneur.2021.780080.
2. GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Neurol. 2021;20:795-820. doi: 10.1016/S1474-4422(21)00252-0.
3. Brady MC, Kelly H, Godwin J, Enderby P, Campbell P. Speech and language therapy for aphasia following stroke. Cochrane Database Syst Rev. 2016;2016:CD000425. doi: 10.1002/14651858.CD000425.pub4.
4. Berthier ML. Poststroke aphasia: epidemiology, pathophysiology and treatment. Drugs Aging. 2005;22:163-182. doi: 10.2165/00002512-200522020-00006.
5. Butler RA, Lambon Ralph MA, Woollams AM. Capturing multidimensionality in stroke aphasia: mapping principal behavioural components to neural structures. Brain. 2014;137:3248-3266. doi: 10.1093/brain/awu286.
6. Brady MC, Ali M, VandenBerg K, Williams LJ, Williams LR, Abo M, et al. Complex Speech-Language Therapy Interventions for Stroke-Related Aphasia: The RELEASE Study Incorporating a Systematic Review and Individual Participant Data Network Meta-Analysis. National Institute for Health and Care Research; 2022. Accessed March 12, 2024. http://www.ncbi.nlm.nih.gov/books/NBK584830.
7. Marebwa BK, Fridriksson J, Yourganov G, Feenaughty L, Rorden C, Bonilha L. Chronic post-stroke aphasia severity is determined by fragmentation of residual white matter networks. Sci Rep. 2017;7:8188. doi: 10.1038/s41598-017-07607-9.
8. Muresanu DF. Neuroplasticity and neurorecovery. Stroke: Practical Guide for Clinicians. In: Bornstein NM, ed. 2009. doi: https://doi.org/10.1159/isbn.978-3-8055-9100-3.
9. Muresanu DF, Buzoianu A, Florian SI, von Wild T. Towards a roadmap in brain protection and recovery. J Cell Mol Med. 2012;16:2861-2871. doi: 10.1111/j.1582-4934.2012.01605.x.
10. Muresanu DF, Heiss WD, Hoemberg V, Bajenaru O, Popescu CD, Vester JC, et al. Cerebrolysin and Recovery After Stroke (CARS): a randomized, placebo- controlled, double-blind, multicenter trial. Stroke. 2016;47:151-159. doi: 10.1161/STR0KEAHA.115.009416.
11. Guekht A, Vester J, Heiss WD, Gusev E, Hoemberg V, Rahlfs VW, et al. Safety and efficacy of Cerebrolysin in motor function recovery after stroke: a meta-analysis of the CARS trials. Neurol Sci. 2017;38:1761-1769. doi: 10.1007/s10072-017-3037-z.
12. Amiri-Nikpour MR, Nazarbaghi S, Ahmadi-Salmasi B, Mokari T, Tahamtan U, Rezaei Y. Cerebrolysin effects on neurological outcomes and cerebral blood flow in acute ischemic stroke. Neuropsychiatr Dis Treat. 2014;10:2299-2306. doi: 10.2147/NDT.S75304.
13. Brainin M. Cerebrolysin: a multi-target drug for reco–very after stroke. Expert Rev Neurother. 2018;18:681-687. doi: 10.1080/14737175.2018.1500459.
14. Muresanu DF, Livint Popa L, Chira D, Dabala V, Hapca E, Vlad I, et al. Role and impact of cerebrolysin for ischemic stroke care. J Clin Med. 2022;11:1273. doi: 10.3390/jcm11051273.
15. Muresanu DF, Vester JC. Prospective Meta-Analysis (PMA) of the cerebrolysin trials in neuroprotection and neurorecovery after traumatic brain injury (CAPTAIN I and CAPTAIN II). 2016. Accessed March 12, 2024. https://ssnn.ro/images/Images/Research/PMA15062016.pdf.
16. Beghi E, Binder H, Birle C, Bornstein N, Diserens K, Groppa S, et al. European Academy of Neurology and European Federation of Neurorehabilitation Societies guideline on pharmacological support in early motor rehabilitation after acute ischaemic stroke. Eur J Neurol. 2021;28:2831-2845. doi: 10.1111/ene.14936.
17. Strilciuc S. Safety of Cerebrolysin for neurorecovery after acute ischemic stroke: a systematic review and meta-analysis of twelve randomized-controlled trials; 2021. Accessed March 12, 2024. https://osf.io/k3c5p.
18. Bornstein NM, Guekht A, Vester J, Heiss WD, Gusev E, Homberg V, et al. Safety and efficacy of Cerebrolysin in early post-stroke recovery: a meta-analysis of nine randomized clinical trials. Neurol Sci. 2018;39:629-640. doi: 10.1007/s10072-017-3214-0.
19. Jianu DC, Muresanu DF, Bajenaru O, Popescu BO, Deme SM, Moessler H, Meinzingen SZ, Petrica L. Cerebrolysin adjuvant treatment in Broca’s aphasics following first acute ischemic stroke of the left middle cerebral artery. J Med Life. 2010;3:297-307.
20. Muresanu DF, Verisezan Rosu O. Can Cerebrolysin improve aphasia after ischemic stroke? 2024. Accessed March 12, 2024. http://www.isrctn.com/ISRCTN54581790.
21. Schulz KF, Altman DG, Moher D; CONSORT Group. –CONSORT 2010 statement: updated guidelines for reporting parallel group randomised trials. BMC Med. 2010;8:18. doi: 10.1186/1741-7015-8-18.
22. Shewan CM, Kertesz A. Reliability and validity characteristics of the Western Aphasia Battery (WAB). J Speech Hear Disord. 1980;45:308-324. doi: 10.1044/jshd.4503.308.
23. Kory Calomfirescu S. Romanian version of Western Aphasia Battery. Afazia n accidentele vasculare cerebrale. In: Kory Calomfirescu S, Kory-Mercea M, Lolos R, eds.1996;3:74-95.
24. Ellis C, Peach RK, Rothermich K. Relative weight analysis of the Western Aphasia Battery. Aphasiology. 2021;35:1281-1292. doi: 10.1080/02687038.2020.1787947.
25. Gilmore N, Dwyer M, Kiran S. Benchmarks of significant change after aphasia rehabilitation. Arch Phys Med Rehabil. 2019;100:1131-1139.e87 doi: 10.1016/j.apmr.2018.08.177.
26. Clark HM, Utianski RL, Duffy JR, Strand EA, Botha H, Josephs KA, Whitwell JL. Western Aphasia Battery-revised profiles in primary progressive aphasia and primary progressive apraxia of speech. Am J Speech Lang Pathol. 2020;29:498-510. doi: 10.1044/2019_AJSLP-CAC48-18-0217.
27. Meyer BC, Hemmen TM, Jackson CM, Lyden PD. Modified National Institutes of Health Stroke Scale for use in stroke clinical trials: prospective reliability and validity. Stroke. 2002;33:1261-1266. doi: 10.1161/01.str.0000015625.87603.a7.
28. Van Swieten JC, Koudstaal PJ, Visser MC, Schouten HJ, Van Gijn J. Interobserver agreement for the assessment of handicap in stroke patients. Stroke. 1988;19:604-607. doi: 10.1161/01.str.19.5.604.
29. Collin C, Wade DT, Davies S, Horne V. The Barthel ADL Index: a reliability study. Int Disabil Stud. 1988;10:61-63. doi: 10.3109/09638288809164103.
30. Mahoney FI, Barthel DW. Functional evaluation: the Barthel index. Md State Med J. 1965;14:61-65.
31. Kang H. Sample size determination and power analysis –using the G*Power software. J Educ Eval Health Prof. 2021;18:17. doi: 10.3352/jeehp.2021.18.17.
32. Wickham H, Chang W, Henry L, Pedersen TL, Takahashi K, Wilke C, Woo K, Yutani H, Dunnington D, van den Brand T, et al. ggplot2: create elegant data visualisations using the grammar of gra–phics; 2024. Accessed March 12, 2024. https://cran.r-project.org/web/packages/ggplot2/index.html.
33. Wickham H, Bryan J. readxl: read excel files; 2023. https://CRAN.R-project.org/package = readxl.
34. Dragulescu A, Arendt C. xlsx: read, write, format excel 2007 and excel 97/2000/XP/2003 files; 2020. https://cran.r-project.org/web/packages/xlsx/index.html.
35. Friedrich S, Konietschke F, Pauly M. MANOVA.RM: resampling-based analysis of multivariate data and repeated measures designs; 2023. Accessed March 12, 2024. https://cran.r-project.org/web/packages/MANOVA.RM/index.html.
36. Revelle W. psych: procedures for psychological, psychometric, and personality research; 2024. Accessed March 12, 2024. https://cran.r-project.org/web/packages/psych/index.html.
37. Ziganshina LE, Abakumova T, Vernay L. Cerebrolysin for acute ischaemic stroke. Cochrane Database Syst Rev. 2016;12:CD007026. doi: 10.1002/14651858.CD007026.pub4.
/52_2.jpg)

/49.jpg)
/50.jpg)
/51.jpg)
/52.jpg)