Международный эндокринологический журнал Том 20, №8, 2024
Вернуться к номеру
Діагностичні маркери тяжкого діабетичного макулярного набряку у пацієнтів з цукровим діабетом 2-го типу
Авторы: Сук С.А. (1), Могілевський С.Ю. (2)
(1) - Київська міська клінічна офтальмологічна лікарня «Центр мікрохірургії ока», м. Київ, Україна
(2) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
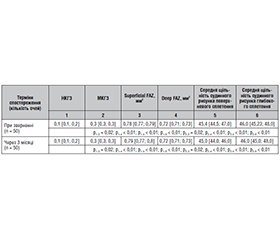
Актуальність. Діабетичний макулярний набряк (ДМН) є поширеною причиною захворювання очей, що загрожує зору, у пацієнтів із цукровим діабетом (ЦД) 2-го типу. В патогенезі ДМН головну роль відіграє руйнування гематоретинального бар’єра в результаті підвищення фактора росту ендотелію судин (VEGF) та експресії прозапальних цитокінів. Це руйнування призводить до гіперпроникності судин із подальшим формуванням ДМН. З появою методів оптичної когерентної томографії (ОКТ) розширюються можливості дослідження маркерів раннього виявлення та прогнозування ДМН, що є актуальним завданням сучасної офтальмології. Мета: дослідити діагностичні маркери тяжкого діабетичного макулярного набряку у пацієнтів з ЦД 2-го типу. Матеріали та методи. Під спостереженням знаходилося 680 пацієнтів (1296 очей) української популяції з непроліферативною діабетичною ретинопатією (НПДР) та ЦД 2-го типу. У цих пацієнтів досліджували характер і частоту розвитку ДМН. 203 пацієнтам (360 очей) з ДМН лікування не проводилося через їх відмову, із цієї групи було виділено очі з тяжким діабетичним макулярним набряком (ДМН 3), саме ця група пацієнтів була метою нашого дослідження. Методи офтальмологічних досліджень включали збір анамнезу, візометрію, рефрактометрію, біомікроскопію заднього відрізка ока, пневмотонометрію, фотографування очного дна, ОКТ, ОКТ-ангіографію, мікропериметрію. Проводилась статистична обробка даних. Термін спостереження — 3 місяці. Результати. При зверненні ДМН 3 було зафіксовано на 50 очах (13,89 %). Некоригована гострота зору (НКГЗ) в середньому становила 0,15 ± 0,01. Максимально коригована гострота зору (МКГЗ) в середньому становила 0,32 ± 0,01. За даними оптичної когерентної томографії (ОКТ), Area thickness становила 355,68 ± 1,80 мкм, Min in fovea — 358,54 ± 2,40 мкм, Central sector — 401,06 ± 2,09 мкм, Volume — 10,42 ± 0,10 мм3, NFL + GCL + IPL average — 138,3 ± 0,7 мкм, NFL + GCL + IPL min — 122,78 ± 0,60 мкм, GCL — 97,2 ± 1,0 мкм, NFL — 42,12 ± 0,20 мкм. За даними ОКТ-ангіографії (ОКТА), площа поверхні поверхневої фовеальної аваскулярної зони (superficial FAZ) в середньому становила 0,780 ± 0,002 мм2, площа поверхні глибокої фовеальної аваскулярної зони (deep FAZ) — 0,720 ± 0,002 мм2. Середня щільність судинного рисунка поверхневого сплетення — 45,68 ± 0,2 %, в глибокому — 46,46 ± 0,2 %. Через 3 місяці ДМН 3 було зафіксовано на 50 очах (13,89 %) у пацієнтів з НПДР та ЦД 2-го типу. Некоригована гострота зору у цих пацієнтів в середньому становила 0,14 ± 0,01. Максимально коригована гострота зору в середньому становила 0,32 ± 0,01. За даними ОКТ, Area thickness становила 357,62 ± 1,80 мкм, Min in fovea — 360,04 ± 2,40 мкм, Central sector — 403,52 ± 2,10 мкм, Volume — 10,67 ± 0,10 мм3, NFL + GCL + IPL average — 139,26 ± 0,40 мкм, NFL + GCL + IPL min — 124,38 ± 0,30 мкм, GCL — 98,94 ± 0,30 мкм, NFL — 42,42 ± 0,20 мкм. За даними ОКТА, superficial FAZ — 0,780 ± 0,002 мм2, deep FAZ — 0,720 ± 0,002 мм2, середня щільність судинного рисунка поверхневого сплетення — 45,17 ± 0,2 %, середня щільність судинного рисунка глибокого сплетення — 46,22 ± 0,2 %. Висновки. У пацієнтів української популяції з ЦД 2-го типу частота ДМН 3 в середньому становила 13,89 %. Встановлено вірогідний зв’язок НКГЗ та МКГЗ при ДМН 3 у пацієнтів з ЦД 2-го типу з показниками ОКТ, а саме: Area thickness, Min in fovea, Central sector, NFL + GCL + IPL average, NFL + GCL + IPL min, GCL та NFL (р < 0,01). Встановлено вірогідну залежність НКГЗ та МКГЗ при ДМН 3 у пацієнтів з ЦД 2-го типу від стану мікроциркуляції макулярної ділянки за даними показників ОКТА, а саме: від superficial FAZ, deep FAZ, середньої щільності судинного рисунка поверхневого та глибокого сплетення (р < 0,01).
Background. Diabetic macular edema (DME) is one of the common causes of vision loss in patients with type 2 diabetes mellitus (DM). In the pathogenesis of DME, the main role is played by the breakdown of the blood-retinal barrier as a result of an increase in vascular endothelial growth factor and the expression of pro-inflammatory cytokines. This breakdown leads to hyperpermeability of the vessels with subsequent formation of DME. With the emergence of the optical coherence tomography (OCT), the possibilities of studying markers for early detection and prediction of DME are expanding, which is an urgent task of modern ophthalmology. The purpose of the study was to investigate diagnostic markers of severe diabetic macular edema in patients with type 2 diabetes. Materials and methods. Six hundred and eighty patients (1296 eyes) of the Ukrainian population with nonproliferative diabetic retinopathy and type 2 DM were under observation. The nature and frequency of DME development were studied in them. Two hundred and three patients (360 eyes) with DME were not treated due to refusal. Eyes with severe diabetic macular edema (DMN3) were selected from this group, and these patients was the target of our study. Ophthalmic examination methods included: history taking, visometry, refractometry, posterior ocular biomicroscopy, pneumotonometry, fundus photography, OCT, OCT angiography, microperimetry. Statistical data processing was carried out. The observation period was 3 months. Results. During referral of the patients, DME3 was detected in 50 eyes (13.89 %). The average uncorrected visual acuity (UCVA) was 0.15 ± 0.01. Maximum corrected visual acuity (MCVA) averaged 0.32 ± 0.01. According to OCT, area thickness was 355.68 ± 1.80 μm, min in fovea — 358.54 ± 2.40 μm, central sector — 401.06 ± 2.09 μm, volume — 10.42 ± 0.10 mm3, nerve fiber layer (NFL) + ganglion cell layer (GCL) + inner plexiform layer (IPL) average — 138.3 ± 0.7 μm, NFL + GCL + IPL min — 122.78 ± 0.60 μm, GCL — 97.2 ± 1.0 μm, NFL — 42.12 ± 0.20 μm. According to OCT angiography, the surface area of the superficial foveal avascular zone (FAZ) was on average 0.780 ± 0.002 mm2, the surface area of the deep FAZ was 0.720 ± 0.002 mm2. The average density of the vascular pattern of the superficial plexus was 45.68 ± 0.20 %, deep plexus — 46.46 ± 0.20 %. After 3 months, DME3 was recorded in 50 eyes (13.89 %) in patients with nonproliferative diabetic retinopathy and type 2 DM. UCVA in them averaged 0.14 ± 0.01, MCVA averaged 0.32 ± 0.01. According to OCT data, area thickness was 357.62 ± 1.80 μm, min in fovea — 360.04 ± 2.40 μm, central sector — 403.52 ± 2.10 μm, volume — 10.67 ± 0.10 mm3, NFL + GCL + IPL average — 139.26 ± 0.40 μm, NFL + GCL + IPL min — 124.38 ± 0.30 μm, GCL — 98.94 ± 0.30 μm, NFL — 42.42 ± 0.20 μm. According to the OCT angiography, superficial FAZ was 0.780 ± 0.002 mm2, deep FAZ was 0.720 ± 0.002 mm2, the average density of the vascular pattern of the superficial plexus was 45.17 ± 0.20 %, the average density of the vascular pattern of the deep plexus was 46.22 ± 0.20 %. Conclusions. In patients of the Ukrainian population with type 2 DM, the average frequency of DME 3 was 13.89 %. There was a reliable relationship between UСVA and MCVA in DME 3 in patients with type 2 diabetes and OCT indicators, namely area thickness, min in fovea, central sector, NFL + GCL + IPL average, NFL + GCL + IPL min, GCL and NFL (p < 0.01). A significant relationship was found between UСVA and MCVA in DME 3 in patients with type 2 diabetes and the state of microcirculation of macular zone according to the OCT angiography indicators such as superficial FAZ, deep FAZ, average density of the vascular pattern of the superficial and deep plexus (p < 0.01).
цукровий діабет 2-го типу; діабетичний макулярний набряк; оптична когерентна томографія; ангіографія
type 2 diabetes mellitus; diabetic macular edema; optical coherence tomography; angiography
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Romero-Aroca P. Managing diabetic macular edema: The leading cause of diabetes blindness. World J Diabetes. 2011 Jun 15;2(6):98-104. doi: 10.4239/wjd.v2.i6.98. PMID: 21860693; PMCID: PMC3158878.
- Teo ZL, Tham YC, Yu M, Chee ML, Rim TH, Cheung N, Bikbov MM, et al. Global Prevalence of Diabetic Retinopathy and Projection of Burden through 2045: Systematic Review and Meta-ana–lysis. Ophthalmology. 2021 Nov;128(11):1580-1591. doi: 10.1016/j.ophtha.2021.04.027. Epub 2021 May 1. PMID: 33940045.
- Daruich A, Matet A, Moulin A, Kowalczuk L, Nicolas M, Sellam A, Rothschild PR, et al. Mechanisms of macular edema: Beyond the surface. Prog Retin Eye Res. 2018 Mar;63:20-68. doi: 10.1016/j.preteyeres.2017.10.006. Epub 2017 Nov 7. PMID: 29126927.
- Gundogan FC, Yolcu U, Akay F, Ilhan A, Ozge G, Uzun S. Dia–betic Macular Edema. Pak J Med Sci. 2016 Mar-Apr;32(2):505-10. doi: 10.12669/pjms.322.8496. PMID: 27182271; PMCID: PMC4859054.
- Romero-Aroca P, Baget-Bernaldiz M, Pareja-Rios A, Lopez-Galvez M, Navarro-Gil R, Verges R. Diabetic Macular Edema Pathophysiology: Vasogenic versus Inflammatory. J Diabetes Res. 2016;2016:2156273. doi: 10.1155/2016/2156273. Epub 2016 Sep 28. PMID: 27761468; PMCID: PMC5059543.
- Tan GS, Cheung N, Simó R, Cheung GC, Wong TY. Diabetic macular oedema. Lancet Diabetes Endocrinol. 2017 Feb;5(2):143-155. doi: 10.1016/S2213-8587(16)30052-3. Epub 2016 Aug 3. PMID: 27496796.
- Ruia S, Saxena S, Cheung CMG, Gilhotra JS, Lai TY. Spectral domain optical coherence tomography features and classification systems for diabetic macular edema: a review. The Asia-Paci–fic Journal of Ophthalmology. 2016;5(5):360-367. DOI: 10.1097/APO.0000000000000218.
- Spaide RF, Klancnik JM Jr, Cooney MJ. Retinal vascular layers imaged by fluorescein angiography and optical coherence tomo–graphy angiography. JAMA Ophthalmology. 2015;(133):45-50. DOI: 10.1001/jamaophthalmol.2014.3616.
- Chatziralli I. Editorial-Suboptimal response to intra–vitreal anti-VEGF treatment for patients with diabetic macular edema: is there any point in switching treatment. Eur Rev Med Pharmacol Sci. 2018;22(15):5047-5050. DOI: 10.26355/eurrev_201808_15648.
- Sun JK, Aiello LP, Abràmoff MD, Antonetti DA, Dutta S, Pragnell M, Levine SR, Gardner TW. Updating the Staging System for Diabetic Retinal Disease. Ophthalmology. 2021 Apr;128(4):490-493. doi: 10.1016/j.ophtha.2020.10.008. Epub 2020 Nov 17. PMID: 33218709; PMCID: PMC8378594.
- Suk SA. Evaluation of the state of microcirculation of the central retinal zone at different degrees of severity of diabetic macular edema in patients with type 2 diabetes. Archives of Ophthalmology of Ukraine. 2023;11(2):32-35. DOI: https://doi.org/10.22141/2309-8147.11.2.2023.325.
- Sun Z, Tang F, Wong R, Lok J, Szeto SK, Chan JC, Cheung CY. OCT angiography metrics predict progression of diabetic retinopathy and development of diabetic macular edema: a prospective study. Ophthalmology. 2019;126(12):1675-1684. DOI: 10.1016/j.ophtha.2019.06.016.
- Lee J, Moon BG, Cho AR, Yoon YH. Optical Coherence Tomography Angiography of DME and Its Association with Anti-VEGF Treatment Response. Ophthalmology. 2016 Nov;123(11):2368-2375. doi: 10.1016/j.ophtha.2016.07.010. Epub 2016 Sep 6. PMID: 27613201.
- Moein HR, Eduardo A, Carl B, Emily D, Ricardo N, André J, et al. Optical coherence tomography angiography to detect macular capillary ischemia in patients with inner retinal changes after resolved diabetic macular edema. Retina. 2018;38:2277-84. DOI: 10.1097/IAE.0000000000001902.
- AttaAllah HR, Mohamed AAM, Ali MA. Macular vessels density in diabetic retinopathy: Quantitative assessment using optical coherence tomography angiography. Int. Ophthalmology. 2019;39:1845-1859. DOI: 10.1007/s10792-018-1013-0.
- Pankiv V, Yuzvenko T, Pashkovska N, Pankiv I. The relationship between serum vitamin D concentrations and development of diabetic retinopathy in type 2 diabetes mellitus. International Journal of Endocrinology (Ukraine). 2022;18(8):432-435. https://doi.org/10.22141/2224-0721.18.8.2022.1221.
- Balaratnasingam C, Inoue M, Ahn S, McCann J, Dhrami-Gavazi E, Yannuzzi LA, Freund KB. Visual Acuity Is Correlated with the Area of the Foveal Avascular Zone in Diabetic Retinopathy and Retinal Vein Occlusion. Ophthalmology. 2016 Nov;123(11):2352-2367. doi: 10.1016/j.ophtha.2016.07.008. Epub 2016 Aug 11. PMID: 27523615.
- Lazăr AS, Stanca HT, Tăbăcaru B, Danielescu C, Munteanu M, Stanca S. Quantitative Parameters Relevant for Diabetic Macular Edema Evaluation by Optical Coherence Tomography Angiography. Medicina (Kaunas). 2023 Jun 10;59(6):1120. doi: 10.3390/medicina59061120. PMID: 37374324; PMCID: PMC10300947.
- Chu Z, Lin J, Gao C, Xin C, Zhang Q, Chen CL, Roisman L, et al. Quantitative assessment of the retinal microvasculature using optical coherence tomography angiography. J Biomed Opt. 2016 Jun 1;21(6):66008. doi: 10.1117/1.JBO.21.6.066008. PMID: 27286188; PMCID: PMC4901200.
- Kim AY, Chu Z, Shahidzadeh A, Wang RK, Puliafito CA, Kashani AH. Quantifying Microvascular Density and Morphology in Diabetic Retinopathy Using Spectral-Domain Optical Cohe–rence Tomography Angiography. Investig. Ophthalmology Vis. Sci. 2016;57:362-370. PMCID: PMC4968771. DOI: 10.1167/iovs.15-18904.
- Spaide RF. Retinal vascular cystoid macular edema: Review and new theory. Retina. 2016;36:1823-1842. DOI: 10.1097/IAE.0000000000001158.
- Ting DSW, Tan GSW, Agrawal R, Yanagi Y, Sie NM, Wong CW, San Yeo IY, et al. Optical Coherence Tomographic Angiography in Type 2 Diabetes and Diabetic Retinopathy. JAMA Ophthalmology. 2017 Apr 1;135(4):306-312. doi: 10.1001/jamaophthalmol.2016.5877. PMID: 28208170.