Вступ
Дефіцит вітаміну D є глобальною проблемою охорони здоров’я, він вражає людей будь-якої етнічної приналежності та віку [1]. Окрім метаболізму кальцію та мінералізації кісток, вітамін D регулює проліферацію та диференціацію клітин, захищає численні тканини від окиснювального пошкодження, відіграє роль в імунітеті й метаболізмі та контролює експресію численних генів. Вітамін D зв’язується з рецепторами (VDR), підкласом ядерних рецепторів, які містяться майже в усіх клітинах організму і необхідні для регуляції різноманітних біологічних процесів. Вважається, що дефіцит вітаміну D змінює VDR, що призводить до дисфункції багатьох органів [2, 3].
Загальновідомо, що вітамін D має значний вплив на розвиток і перебіг автоімунних захворювань, зокрема цукрового діабету 1-го типу (ЦД1), оскільки відіграє важливу роль у регуляції імунної відповіді, знижуючи активність Т-хелперів типу 1 і цитотоксичних Т-лімфоцитів, які відповідальні за автоімунне ураження β-клітин [4]. У свою чергу, дефіцит вітаміну D погіршує регуляцію цієї імунної відповіді та сприяє розвитку автоімунних процесів, підвищуючи ризик розвитку і прогресування ЦД1.
За даними Міжнародної діабетичної федерації (IDF), у 2022 році приблизно у 8,75 мільйонів осіб у всьому світі був діагностований ЦД1, 84 % з них становили дорослі [5]. З огляду на неухильний приріст щорічної кількості нових випадків ЦД1, особливо в країнах з обмеженим сонячним випромінюванням, дослідження можливостей корекції дефіциту вітаміну D у цієї категорії осіб є актуальним завданням.
Латентний автоімунний діабет дорослих (LADA) є найбільш поширеним (до 12 % усіх випадків діабету серед дорослого населення) фенотипом автоімунного ЦД, який має ознаки як ЦД1, так і цукрового діабету 2-го типу (ЦД2). LADA, як і ЦД1, виникає внаслідок автоімунного процесу, що призводить до поступового руйнування β-клітин [6]. На сьогодні немає остаточного розуміння, чи є LADA іншою сутністю, чи підтипом ЦД1 із повільнішим руйнуванням клітин, що виробляють інсулін. У Стандартах надання допомоги при цукровому діабеті Американської діабетичної асоціації (ADA) LADA включено до категорії ЦД1 для зазначення можливості автоімунного руйнування β-клітин у дорослих [7]. Проте, на відміну від класичного ЦД1, LADA розвивається повільніше, часто зберігаючи часткову функцію β-клітин на ранніх стадіях захворювання, а також характеризується ознаками інсулінорезистентності, що поєднує його з метаболічними порушеннями, притаманними ЦД2. У свою чергу, існують переконливі докази ролі дефіциту вітаміну D у механізмах розвитку й прогресування ЦД2 [8, 9].
З огляду на вищезазначене дефіцит вітаміну D при LADA, окрім потенціювання автоімунного ураження β-клітин, може також посилювати інсулінорезистентність і сприяти погіршенню вуглеводного обміну й прогресуванню інших метаболічних порушень, зокрема дисліпідемії. Численні обсерваційні дослідження свідчать про зв’язок між вищими рівнями вітаміну D у сироватці крові й сприятливим ліпідним профілем [10], що, з одного боку, зменшує ризик серцево-судинних ускладнень, а з іншого — сприяє зниженню загального системного запалення, яке є основним чинником інсулінорезистентності.
Отже, вивчення ефекту вітаміну D при автоімунному діабеті є важливим напрямком для поліпшення довгострокового прогнозу як у випадках класичного ЦД1, так і в пацієнтів з LADA.
Метою дослідження було з’ясувати ефективність застосування холекальциферолу в комплексному лікуванні пацієнтів з різними фенотипами цукрового діабету 1-го типу.
Матеріали та методи
Проведено скринінгове обстеження 96 пацієнтів з різними фенотипами ЦД1 (46 — із класичним ЦД1 і 50 — з LADA) на предмет визначення сироваткового рівня вітаміну D. Нормальні рівні вітаміну D реєструвались у 13 % осіб з ЦД1 і 10 % пацієнтів з LADA. Ще 8,7 і 18 % пацієнтів з ЦД1 і LADA відповідно були виключені з дослідження у зв’язку з наявністю супутньої патології, яка може погіршувати метаболізм вітаміну D.
До подальшого дослідження були залучені 72 пацієнти віком від 19 до 59 років з різними фенотипами автоімунного ЦД і недостатнім статусом вітаміну D: 36 осіб з LADA (група 1) і 36 — з класичним ЦД1 (група 2). Групу LADA становили 23 чоловіки і 13 жінок віком від 38 до 59 років, ЦД1 — 21 чоловік і 15 жінок віком від 19 до 51 року. На момент дослідження тривалість захворювання пацієнтів з LADA становила 7 [4,0; 10,0] років, із ЦД1 — 10 [8,0; 14,0] років.
Діагноз ЦД встановлювався відповідно до Уніфікованого клінічного протоколу первинної, екстреної та спеціалізованої медичної допомоги «Цукровий діабет 1 типу у дорослих» [11] і Стандартів надання допомоги при цукровому діабеті ADA 2024 року [7], LADA — згідно з рекомендаціями Товариства імунології цукрового діабету [12] і Консенсусної заяви міжнародної експертної панелі з LADA [13]. Останньою запропоновані розширені характеристики LADA, які включають вік маніфестації ЦД — понад 30 років; сімейний/особистий анамнез автоімунітету; нижчу частоту метаболічного синдрому порівняно із ЦД2; водночас відсутність різниці в серцево-судинних наслідках для пацієнтів з LADA і хворих на ЦД2; більш повільне зниження рівнів С-пептиду, ніж при ЦД1; позитивність щодо антитіл до декарбоксилази глутамінової кислоти (antiGAD) як найбільш чутливого маркера (рідше — до інших антитіл — ICA, IA-2A ab, ZnT8A і тетраспаніну-7); відсутність потреби в інсулінотерапії на початку діабету.
Усі пацієнти з класичним ЦД1 перебували на базисно-болюсній схемі інсулінотерапії. 27,8 % пацієнтів з LADA отримували пероральні цукрознижувальні препарати (ПЦЗП), решта — інсулінотерапію, зокрема в поєднанні з ПЦЗП.
Обстеженим обох груп визначали антропометричні дані (ріст і масу тіла з наступним обчисленням індексу маси тіла (ІМТ), окружність талії (ОТ) та окружність стегон (ОС) для розрахунку співвідношення ОТ/ОС), сироватковий рівень 25(OH)D, показники вуглеводного обміну (глікемію натще, глікований гемоглобін (HbA1с), С-пептид, antiGAD). Пацієнтам з LADA, які не перебували на інсулінотерапії, визначали рівень інсулінемії та індекс інсулінорезистентності НОМА (HOMA-IR). Ліпідний спектр крові вивчали за вмістом у крові загального холестерину (ЗХ), триацилгліцеролів (ТГ), холестерину ліпопротеїнів низької (ХС ЛПНЩ), дуже низької (ХС ЛПДНЩ) і високої щільності (ХС ЛПВЩ), а також обчислювали індекс атерогенності (ІА).
Пацієнти були розподілені на групи залежно від статусу вітаміну D: концентрації < 20 нг/мл вважали дефіцитом, між 21 і 29 нг/мл — недостатністю, а сироваткові рівні > 30 нг/мл — нормальним рівнем [14].
З метою оцінки ефективності лікування пацієнти кожної групи були поділені на дві підгрупи. Підгрупа А (основна) групи 1 (20 осіб) і підгрупа А (основна) групи 2 (20 осіб) отримували у комплексному лікуванні препарат Відеїн (холекальциферол) 20 000 МО (АТ «Київ–ський вітамінний завод») по одній капсулі на тиждень упродовж трьох місяців; підгрупа B групи 1 (16 осіб) і підгрупа B групи 2 (16 осіб) — тільки стандартну (базисну) терапію. Вибір препарату зумовлений тим, що прийом холекальциферолу в дозі 20 000 МО один раз на тиждень характеризується низкою фармакологічних та клінічних переваг. Завдяки тривалому періоду напіврозпаду вітаміну D (15–20 діб) забезпечується стабільна концентрація 25(OH)D у сироватці крові без значних коливань. Така схема зручна для пацієнтів, знижує ризик пропуску доз і полегшує дотримання режиму терапії, особливо в довгостроковій перспективі. Даний режим є корисним у пацієнтів з порушеннями всмоктування чи коморбідними станами, що обмежують можливість щоденного прийому препаратів. Усім пацієнтам досліджувані показники встановлювали в динаміці лікування (до і через 3 місяці).
Математичну обробку отриманих даних проводили за допомогою програм Statistiсa 13.3 StatSoft Inc., Microsoft Excel 2016. Кількісні дані наведені у вигляді медіани (Me) і міжквартильного інтервалу (Q25–Q75). Для встановлення вірогідності відмінностей у групах спостереження використовували непараметричний U-критерій Манна — Уїтні, у динаміці лікування — критерій Уїлкоксона. Для проведення кореляційного аналізу при ненормальному розподілі вибірки використовували непараметричний коефіцієнт кореляції рангів Спірмена.
Результати
На першому етапі вивчали особливості досліджуваних показників залежно від статусу вітаміну D. Характеристика антропометричних даних, показників вуглеводного, ліпідного обмінів, рівня 25(OH)D і кальцію крові у хворих на класичний ЦД1 і LADA залежно від статусу вітаміну D наведена в табл. 1.
У групі пацієнтів із ЦД1 у 52,8 % встановлено дефіцит, а в 47,2 % — недостатність вітаміну D, з LADA — у 55,6 і 44,4 % відповідно. При цьому в осіб з LADA в групі дефіциту вітаміну D встановлені вірогідно нижчі (у 1,7 раза, р = 0,011) рівні 25(OH)D, ніж у відповідній підгрупі пацієнтів із класичним ЦД1.
За даними антропометричних досліджень, нормальна маса тіла за показником ІМТ спостерігалась у 77,3 % пацієнтів із ЦД1 і 44,1 % — з LADA. В осіб із ЦД1 недостатня маса тіла встановлена в 4,5 %, надмірна вага — у 18,2 %. У 29,4 % пацієнтів з LADA зареєстровано надлишкову масу тіла, у 26,5 % — ожиріння (у 20,6 % — І ступеня, у 5,9 % — ІІ ступеня відповідно). Метаболічно нездоровий фенотип розподілу жирової тканини за абдомінальним типом встановлено в 44,1 % пацієнтів з LADA і 18,2 % — із ЦД1.
При ЦД1 антропометричні показники, такі як ІМТ та ОТ, статистично не відрізнялися при міжгруповому порівнянні, проте співвідношення ОТ/ОС було вищим в осіб із ЦД1 у групі дефіциту порівняно з таким в осіб з недостатністю вітаміну D на 14,3 % (р < 0,05). У пацієнтів із ЦД1 обох груп відзначалось суттєве підвищення показника глікемії натще, HbА1с відносно референтних значень, що свідчить про незадовільну компенсацію вуглеводного обміну, а також підвищення antiGAD на тлі зниження рівня C-пептиду. Також у пацієнтів обох груп показники ліпідного обміну вказували на дисліпідемію різного ступеня. Водночас вірогідних відмінностей зазначених показників між групами осіб з недостатністю та дефіцитом вітаміну D не зареєстровано. Рівні загального кальцію крові не виходили за межі норми і не мали вірогідних відмінностей між підгрупами.
В осіб з LADA показники антропометрії також не демонстрували статистично значущої різниці при міжгруповому порівнянні. В обох групах виявлено значне підвищення рівня глюкози натще і HbА1с, що свідчить про поганий контроль вуглеводного обміну. Водночас між групами з недостатністю та дефіцитом вітаміну D вірогідних відмінностей цих показників не виявлено. Рівень antiGAD значно перевищував референтні значення в обох групах і був вищим на 78 % у разі дефіциту вітаміну D, ніж при його недостатності (р < 0,01). Індекс інсулінорезистентності перевищував норму і був практично однаковим в обох групах, а вміст С-пептиду значно нижчим за референтні значення і не залежав від ступеня недостатності вітаміну D. У пацієнтів з LADA обох груп діагностовано дисліпідемію, проте показники ліпідного обміну вірогідно не відрізнялись при міжгруповому порівнянні. Рівень сироваткового кальцію не виходив за межі референтних значень і не відрізнявся при міжгруповому порівнянні.
Отже, низький рівень вітаміну D поширений серед пацієнтів як з класичним ЦД1, так і з LADA. Особливо виражений дефіцит вітаміну D у пацієнтів з LADA, що свідчить про можливу роль вітаміну D у патогенезі цієї форми діабету, зокрема завдяки його імуномодулювальним властивостям і впливу на інсулінорезистентність. Щодо антропометричних характеристик, то більшість пацієнтів із ЦД1 мали нормальну масу тіла, тоді як серед осіб з LADA частіше спостерігалася надмірна вага або ожиріння. Також розподіл жирової тканини за абдомінальним типом більш характерний для пацієнтів з LADA. Хоча показники ІМТ та окружності талії не мали значних відмінностей між групами, відношення окружності талії до окружності стегон вище в пацієнтів із ЦД1 при дефіциті вітаміну D. Показники вуглеводного обміну не мали значних змін залежно від статусу вітаміну D у пацієнтів з ЦД1, однак у хворих на LADA зафіксовано суттєвіше підвищення рівня antiGAD при дефіциті вітаміну D, що вказує на більш високу автоімунну активність.
Отже, низький рівень вітаміну D асоціюється з небажаними метаболічними змінами, зокрема з підвищеною автоімунною активністю у випадку LADA, що підкреслює важливість моніторингу і корекції цього показника для поліпшення стану пацієнтів.
За даними лінійно-регресійного аналізу кореляцій між показниками вітаміну D, даними антропометрії, вуглеводного обміну і β-клітинної функції, показниками автоімунітету і ліпідного статусу, в пацієнтів з LADA реєструвались прямі кореляційні зв’язки середньої сили між рівнями вітаміну D та інсуліну (r = 0,518; р < 0,05), НОМА-IR (r = 0,437; р < 0,05); обернені кореляційні зв’язки середньої сили — між рівнем вітаміну D і концентрацією antiGAD (r = –0,698; р < 0,05), вмістом HbА1с (r = –0,330; р < 0,05), а також показником ХС ЛПНЩ (r = –0,397; р < 0,05).
Отже, аналіз результатів лінійно-регресійного аналізу свідчить про наявність значущих кореляцій між рівнем вітаміну D і ключовими метаболічними й імунологічними показниками в пацієнтів з LADA. Зокрема, встановлено прямий зв’язок між концентрацією вітаміну D і рівнем інсуліну, що свідчить про його здатність підтримувати функцію β-клітин підшлункової залози. Також вищі показники вітаміну D асоціювалися з кращою чутливістю до інсуліну (HOMA-IR).
Водночас зареєстрована чітка обернена залежність між рівнем вітаміну D і автоімунними процесами, про що свідчить зниження концентрації antiGAD у пацієнтів з вищим рівнем цього вітаміну. Крім того, у таких пацієнтів відзначається зменшення рівня HbА1с, що вказує на поліпшення вуглеводного обміну при більш задовільному статусі вітаміну D. Негативна кореляція з рівнем ХС ЛПНЩ вказує на можливу роль вітаміну D у поліпшенні ліпідного профілю, що знижує ризик серцево-судинних ускладнень.
У групі пацієнтів із ЦД1 прямі кореляційні зв’язки середньої сили встановлено між рівнями вітаміну D і ХС ЛПВЩ (r = 0,379; р < 0,05); обернені кореляційні зв’язки середньої сили — між рівнем вітаміну D і концентрацією antiGAD (r = –0,303; р < 0,05), а також вмістом ТГ (r = –0,375; р < 0,05).
Отже, у пацієнтів із ЦД1 вплив вітаміну D на досліджувані показники був схожий на такий у пацієнтів з LADA, але з деякими особливостями. Зокрема, рівень вітаміну D прямо корелював з підвищенням «корисного» ХС ЛПВЩ, що може сприяти поліпшенню стану серцево-судинної системи. Крім того, відзначалася обернена залежність між рівнем вітаміну D і концентрацією автоантитіл (antiGAD), а також рівнем ТГ, що свідчить про його позитивний вплив на ліпідний обмін.
Отримані нами дані відповідають результатам інших досліджень. Зокрема, у літературі повідомляється про сильну асоціацію між ЦД1 і низьким рівнем циркулюючого вітаміну D. Також є докази високого рівня (систематичні огляди, метааналізи) того, що адекватний статус вітаміну D у ранньому віці знижує ризик розвитку ЦД1. Повідомляється про зв’язок між поліморфізмом VDR, ризиком ЦД1 і функцією β-клітин за рівнем C-пептиду [15].
Отже, вітамін D демонструє значний вплив на обмінні процеси в пацієнтів з LADA і ЦД1. Вищі його рівні асоціюються з поліпшенням функції β-клітин, зменшенням автоімунної активності та позитивним впливом на профіль ліпідів. Особливо виражені ці ефекти в пацієнтів із LADA, що підкреслює важливість моніторингу і корекції рівня вітаміну D у цій категорії хворих.
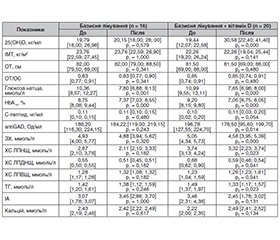
Наступним етапом нашого дослідження була оцінка динаміки антропометричних даних, показників вуглеводного, ліпідного обмінів, рівня кальцію крові у хворих на класичний ЦД1 на тлі базисної терапії та лікування з додаванням вітаміну D упродовж 3 місяців (табл. 2).
Як видно з наведених даних, у пацієнтів із класичним ЦД1 у групі базисного лікування рівень вітаміну D вірогідно не змінився, тоді як у разі додаткового прийому холекальциферолу даний показник збільшився на 57,3 % (р = 0,000).
Дані антропометрії в осіб із класичним ЦД1 не зазнали статистично значущих змін при порівнянні до і після лікування в жодній досліджуваній групі.
Вивчення показників вуглеводного обміну в динаміці лікування пацієнтів із класичним ЦД1 встановило, що рівень глікемії натще вірогідно знизився на 24,7 % у пацієнтів (р = 0,001), які отримували базисну терапію основного захворювання, але в разі додавання вітаміну D відзначалось суттєвіше зменшення (на 30,4 %) з високим ступенем вірогідності (р = 0,000). Показник HbA1c вірогідно знизився на 15,8 % на тлі базисної терапії та більшою мірою (на 23,4 %) — при додаванні вітаміну D (р = 0,000).
Рівень С-пептиду статистично не змінився до і після проведення базисного лікування пацієнтів з ЦД1, при додаванні вітаміну D мав невірогідну тенденцію до зростання. Титри antiGAD статистично значуще знизились на 9,3 % (р < 0,05) також лише в разі додавання до базисного лікування вітаміну D.
У пацієнтів із ЦД1, які отримували базисну терапію, не встановлено вірогідних змін з боку показників ліпідного обміну, тоді як у групі осіб, які додатково отримували вітамін D, реєструвалось зменшення ЗХ на 9,3 % (р = 0,000) і атерогенних фракцій ліпопротеїнів: ХС ЛПНЩ — на 11,2 % (р < 0,05), ХС ЛПДНЩ — на 13,2 % (р < 0,05), ТГ — на 10,7 % (р < 0,05) відповідно, а також незначне збільшення ХС ЛПВЩ порівняно з показником до лікування (р < 0,05).
Рівень сироваткового кальцію вірогідно не змінився в жодній групі незалежно від виду терапії.
При оцінці змін до і після лікування пацієнтів з LADA нами були отримані такі результати (табл. 3).
Рівень вітаміну D у пацієнтів з LADA, які отримували базисну терапію, не зазнав вірогідних змін, тоді як при додаванні холекальциферолу до схеми лікування спостерігалось суттєве зростання показника на 63,7 % (р = 0,000).
Заслуговує на увагу той факт, що показники ІМТ, ОТ та ОТ/ОС незначно, але вірогідно зменшилися в групі пацієнтів з LADA з додаванням до схеми лікування вітаміну D на 4,4; 3,3 і 3,3 % (р < 0,05) відповідно, чого не спостерігалось у групі порівняння.
Серед показників вуглеводного обміну в пацієнтів на базисній терапії до і після лікування реєструвалися такі зміни: рівень глікемії натще зменшився на 26,4 % порівняно з вихідним (р < 0,05), а вміст HbA1c — на 16,5 % (р = 0,000), тоді як при додаванні до стандартного лікування вітаміну D глікемія натще знизилась більш суттєво — на 36,9 % (р = 0,001), а HbA1c — на 22,8 % (р = 0,000).
На особливу увагу заслуговує той факт, що, на відміну від групи базисного лікування, в осіб, яким додатково призначався вітамін D, зареєстровано суттєве статистично значуще зниження НОМА-IR — на 31,9 % (р < 0,05), а також вірогідне зростання рівня С-пептиду — на 9,4 % (р < 0,05).
Також в осіб, що отримували додатково вітамін D, титр antiGAD вірогідно зменшився на 19,1 % (р = 0,000) без вірогідних змін у групі базисного лікування.
Дані ліпідограми в пацієнтів з LADA, які отримували базисну терапію, демонстрували зниження рівня ЗХ на 4,8 % (р < 0,05) після лікування, тоді як у групі пацієнтів, які отримували вітамін D на додаток до базисної терапії, реєструвалось більш суттєве зниження не тільки ЗХ — на 15,5 % (р = 0,000), але й ХС ЛПНЩ — на 6,9 %, ХС ЛПДНЩ — на 10,7 % і ТГ — на 9,9 % порівняно з показником до лікування (р < 0,05). Рівень сироваткового кальцію також зріс на 5,7 % у групі пацієнтів з додаванням вітаміну D до основного лікування (р < 0,05).
Обговорення
Отже, результати проведеного дослідження демонструють значний вплив вітаміну D на різні аспекти обміну речовин у пацієнтів із ЦД1, особливо з фенотипом LADA. ІМТ, ОТ і співвідношення ОТ/ОС зменшилися в групі з додатковим прийомом вітаміну D, що підтверджує його позитивний вплив на розподіл жиру. Це може пояснюватись зменшенням системного запалення, яке стимулює накопичення жирової тканини, і поліпшенням чутливості до інсуліну.
Заслуговують на увагу позитивні зміни показників вуглеводного обміну, особливо в осіб з LADA: у групі пацієнтів з додатковим прийомом холекальциферолу встановлене суттєве зменшення рівня глікемії натще і HbА1с, що вочевидь пов’язано з підвищенням чутливості до інсуліну, на користь чого свідчить значне зниження в цій групі HOMA-IR. Отримані результати відповідають даним нещодавнього метааналізу, згідно з якими додавання вітаміну D може значно знизити рівень глікемії натще, HbА1с, HOMA-IR і рівні інсуліну натще в пацієнтів із ЦД2, механізми і фенотипові риси якого притаманні LADA [9].
У свою чергу, встановлене в пацієнтів з LADA підвищення на тлі призначення вітаміну D рівня С-пептиду вказує на поліпшення функції β-клітин, що є критично важливим для управління LADA, при якому інсулінопродукуюча функція поступово погіршується з прогресуванням захворювання. Причиною цього може бути, з одного боку, встановлене нами вірогідне зниження титру antiGAD, що свідчить про зменшення автоімунної активності, з іншого — зменшення запалення завдяки імуномодулювальній дії вітаміну D. Варто зазначити, що з огляду на дуже низьку токсичність вітаміну D і відомі переваги збереження позитивності С-пептиду щодо ризику довгострокових ускладнень науковцями рекомендується розглянути можливість щоденного прийому препаратів холекальциферолу пацієнтам із ЦД1 та особам з високим його ризиком, особливо якщо вони мають недостатність вітаміну D [15].
Також нами встановлений позитивний вплив додаткового призначення вітаміну D на показники ліпідного обміну в пацієнтів з LADA зі зниженням загального холестерину, тригліцеридів і атерогенних фракцій ліпопротеїнів, що є потенційно сприятливим щодо зниження ризику серцево-судинних ускладнень, який при LADA навіть перевищує такий при ЦД2 [16]. Встановлено, що вітамін D покращує метаболізм ліпідів за рахунок зниження запального процесу і впливу на експресію генів, які регулюють рівень ліпопротеїнів у крові [17, 18].
Незначне, але статистично значуще збільшення рівня кальцію в пацієнтів з LADA на тлі прийому вітаміну D також є важливим, оскільки він є кофактором для багатьох ферментів і гормонів, які беруть участь у метаболічних процесах, включно з вуглеводним і ліпідним обміном.
Варто зазначити, що режим застосування холекальциферолу в дозі 20 000 МО (Відеїн 20 000 МО, АТ «Київ–ський вітамінний завод») один раз на тиждень був зручним для пацієнтів, препарат добре переносився, жодних побічних ефектів не зареєстровано.
Отже, додавання вітаміну D до базисної терапії впродовж 3 місяців дає плейотропні позитивні ефекти при автоімунному діабеті, особливо в осіб з LADA, сприяючи поліпшенню глікемічного контролю, зниженню інсулінорезистентності, нормалізації ліпідного профілю і зменшенню автоімунного запалення. Ці результати підтверджують необхідність корекції рівня вітаміну D для поліпшення якості лікування і зниження ризику ускладнень у цієї категорії пацієнтів.
Висновки
В осіб з автоімунним діабетом недостатній рівень вітаміну D асоціюється з несприятливими метаболічними змінами, зокрема з гіршими показниками вуглеводного і ліпідного обмінів, включно з підвищеною автоімунною активністю в пацієнтів з LADA. Включення холекальциферолу (Відеїн 20 000 МО) до основної терапії протягом трьох місяців чинить широкий позитивний вплив на стан пацієнтів з автоімунним діабетом, зокрема з LADA, сприяє поліпшенню контролю глікемії, зниженню інсулінорезистентності, стабілізації ліпідного профілю, зменшенню автоімунного запалення і запобіганню втраті функції β-клітин. Отримані результати підкреслюють важливість корекції рівня вітаміну D для підвищення ефективності лікування і зниження ризику ускладнень у пацієнтів із ЦД1, особливо з LADA.
Внесок авторів. Пашковська Н.В. — концепція і дизайн дослідження, аналіз отриманих даних, редагування тексту; Царик І.О. — збирання й обробка матеріалів, написання тексту.
Отримано/Received 19.09.2024
Рецензовано/Revised 22.11.2024
Прийнято до друку/Accepted 25.11.2024

/35.jpg)
/37.jpg)
/38.jpg)