Журнал «Медицина неотложных состояний» Том 20, №7, 2024
Вернуться к номеру
Апалічний синдром токсичного генезу: діагностичні критерії
Авторы: N.V. Kurdil (1), A.O. Volosovets (2), O.V. Ivashchenko (2), V.S. Lisovska (1), H.M. Balan (1), O.M. Rozhkova (3), V.V. Andriushchenko (4)
(1) - State Enterprise “L.I. Medved’s Research Center of Preventive Toxicology, Food and Chemical Safety of the Ministry of Health of Ukraine”, Kyiv, Ukraine
(2) - Shupyk National Healthcare University of Ukraine, Kyiv, Ukraine
(3) - Kyiv Regional Bureau of Forensic Medical Examination, Kyiv, Ukraine
(4) - Communal Non-Commercial Enterprise “Kyiv City Clinical Emergency Hospital”, Kyiv, Ukraine
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
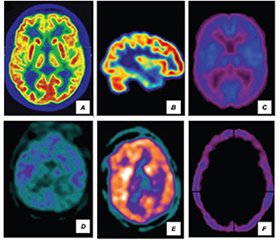
Актуальність. Світова епідемія потужних синтетичних опіоїдів і «нових» психоактивних речовин збільшила число передозувань, що викликають тривалу кому з подальшим розвитком стійкого вегетативного стану або апалічного синдрому. Мета: дослідити клінічні прояви, структурні, функціональні й патогістологічні зміни головного мозку при апалічному синдромі, який сформувався внаслідок тяжкого наркотичного отруєння (передозування). Матеріали та методи. Здійснено ретроспективний аналіз медичних даних шести осіб віком 21–38 років з наркотичними отруєннями нелегальним метадоном, психостимуляторами, барбітуратами й алкоголем. Результати. Серед пацієнтів токсикологічного відділення Київської міської клінічної лікарні швидкої медичної допомоги у 2008–2020 рр. відмічено зростання випадків апалічного синдрому з 0,025 до 0,14 ‰, що корелює з масовими отруєннями нелегальним метадоном. Ключове місце в діагностиці апалічного синдрому токсичного генезу належить неврологічній і поведінковій оцінці пацієнта, що має бути здійснена досвідченими неврологами, які спеціалізуються на консультації хворих з отруєннями. Функціональна магнітно-резонансна томографія і позитронно-емісійна томографія є сучасними стандартами діагностики вегетативних станів, проте ці методи досі важкодоступні в Україні. Зонами візуалізації патологічного процесу в головному мозку при токсичному ураженні переважно є базальні ганглії та/або таламус і зубчасті ядра, кортикальна зона сірої речовини, перивентрикулярна зона білої речовини, кортикоспінальний тракт і мозолисте тіло, характерними є асиметричне ураження білої речовини як ознака демієлінізації, тім’яно-потиличний підкірковий вазогенний набряк та ураження центрального мосту. Судово-гістологічні дослідження кори головного мозку виявили дифузну втрату нейронів, нейронофагію, сателітоз, деформовані пірамідальні нейрони з апікальними дендритами й ознаками гомогенізуючого некрозу, мікровогнища ангіоматозу та вакуолізацію нейропіля, мінералізацію тканини і помірну гліальну реакцію навколо петрифікатів. Висновки. Залишається актуальним удосконалення існуючих в системі охорони здоров’я України визначень і діагностичних критеріїв апалічного синдрому, що привертає увагу лікарів у зв’язку зі збільшенням випадків пролонгації життя пацієнтів після виходу з тривалої коми.
Background. The global epidemic of strong synthetic opioids and “new” psychoactive substances has increased the number of overdoses that cause prolonged coma with subsequent persistent vegetative state or apallic syndrome. The purpose was to investigate the clinical manifestations, functional and pathohistological changes of the brain in apallic syndrome due to severe drug poisoning (overdose). Materials and methods. A retrospective analysis of the medical data of six people aged 21–38 years with drug poisoning involving illegal methadone, psychostimulants, barbiturates and alcohol was carried out. Results. Among the patients of the toxicology department of the Kyiv City Clinical Emergency Hospital in 2008–2020, an increase in the number of cases of apallic syndrome was noted from 0.025 to 0.14 ‰, which correlates with mass poisonings with illegal methadone. A key role in the diagnosis of apallic syndrome of toxic origin belongs to the neurological and behavioural examination of the patient, which should be carried out by experienced neurologists specialising in counselling people with poisoning. Functional magnetic resonance imaging and positron emission tomography are the modern standard for diagnosing vegetative states; however, these methods are still difficult to access in Ukraine. The visualization zones of the pathological process in the brain in case of toxic damage are mainly basal ganglia and/or thalamus and dentate nucleus, cortical zone of grey matter, periventricular zone of white matter, corticospinal tract and corpus callosum; asymmetric white matter damage as a sign of demyelination; parietal-occipital subcortical vasogenic edema and lesions of the central pons are characteristic. Forensic and histological studies of the cerebral cortex revealed diffuse loss of neurons, neuronophagia, satellitosis, deformed pyramidal neurons with apical dendrites and manifestations of homogenising necrosis, angiomatosis microfoci and neuropil vacuolation, mineralization of the tissue and a moderate glial reaction around the petrifications. Conclusions. For the health care system of Ukraine, it remains relevant to improve the existing definitions and diagnostic criteria of the apallic syndrome, which attracts the attention of doctors in connection with an increase in cases of life extension of patients after waking up from a long coma.
стійкий вегетативний стан; апалічний синдром; наркотичні отруєння
persistent vegetative state; apallic syndrome; drug poisoning
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Fins JJ. Disorders of consciousness, past, present, and future. Cambridge Q Health Ethics. 2019;28:603-615. doi: 10.1017/S0963180119000719.
- Produturi GR, Kurtz JS, Brown NJ, Choi AE, Ibrahim LI, et al. The minimally conscious state: an analysis of current clinical trials re-gistered in Clinical Trials.gov. Ann Palliat Med. 2022 Jun;11(6):2131-2138. doi: 10.21037/apm-22-133.
- Van Erp WS, Aben AML, Lavrijsen JCM, Vos PE, Laureys S, Koopmans RTCM. Unexpected emergence from the vegetative state: delayed discovery rather than late recovery of consciousness. J Neurol. 2019 Dec;266(12):3144-3149. doi: 10.1007/s0041 5-019-09542-3.
- Pistarini C, Maggioni G. Disorders of Consciousness. In: Platz T, ed. Clinical Pathways in Stroke Rehabilitation: Evidence-based Clinical Practice Recommendations [Internet]. Cham (CH): Springer; 2021. doi: 10.1007/978-3-030-58505-1_1.
- Knapik P, Borowik D, Cieśla D, Trejnowska E. Epidemio–logy and clinical characteristics of patients discharged from the ICU in a vegetative or minimally conscious state. PLoS One. 2021 Jun 25;16(6):e0253225. doi: 10.1371/journal.pone.0253225.
- Zasler ND, Aloisi M, Contrada M, Formisano R. Disorders of consciousness & terminology: history, evolution and future directions. Brain Inj. 2019; 33:1684-1689. doi: 10.1080/02699052.2019.1656821.
- Golden K, Bodien YG, Giacino JT. Disorders of Consciousness: Classification and Taxonomy. Phys Med Rehabil Clin N Am. 2024 Feb;35(1):15-33. doi: 10.1016/j.pmr.2023.06.011.
- Stepan Ch, Haidiger G, Binder H. Prevalence of persistent vege–tative state/apallic syndrome in Vienna. Eur J Neurol. 2004;11:461-4866. doi: 10.1111/j.1468-1331.2004.00817.x.
- Zanin A, Masiero S, Severino MS, Calderone M, Da Dalt L, Laverda AM. A delayed methadone encephalopathy: clinical and neuroradiological findings. Journal of Child Neurology. 2010;25(6):748-751. doi: 10.1177/0883073809343318.
- Salloum S, Reyes I, Ey E, Mayne D, White K. Acute Cerebellitis and Atypical Posterior Reversible Encephalopathy Syndrome Associated with Methadone Intoxication. Case Reports. Neuropediatrics. 2020 Dec;51(6):421-424. doi: 10.1055/s-0040-1708547.
- Schnakers C. Update on diagnosis in disorders of consciousness. Expert Rev Neurother. 2020 Oct;20(10):997-1004. doi: 10.1080/14737175.2020.1796641.
- Laureys S, Celesia GG, Cohadon F, et al. Unresponsive wakefulness syndrome: a new name for the vegetative state or apallic syndrome. BMC Med. 2010;8:2-5. doi: 10.1186/1741-7015-8-68.
- Andryuishchenko VV, Kalish MM, Kurdil NV. Structure of complications, causes of mortality, clinical and morphological parallels in acute poisoning with methadone hydrochloride. Emergency medicine. 2018;2(89):104-109. doi: 10.22141/2224-0586.2.89.2018.126611 (in Ukrainian).
- Kurdil NV. Analysis of cases of fatal poisoning by narcotic and psychotropic substances in Ukraine based on the results of epidemic, clinical, forensic, and laboratory research (2015–2019). Emergency medicine. 2021;2:116-121. doi: 10.22141/2224-0586.17.2.2021.230657 (in Ukrainian).
- Kurdil N, Voroshilov K, Rozhkova O, Voytenko M, Novostroyna P, Rozovyk I. Assessment of systemic and organotoxic effects caused by the modern synthetic opioids: clinical and forensic aspects. Ukrainian journal of modern problems of toxicology. 2023;1(94):7-20. doi: 10.33273/2663-4570-2023-94-1-7-20 (in Ukrainian).
- Kurdil NV. Clinical manifestations and pathohistological signs of persistent vegetative state (apallic syndrome) caused by toxic-hypoxic brain damage in combined drug poisoning. Proceedings of the IV International Scientific and Practical Conference. Boston, USA; 2023. 232-235. Available from: https://isg-konf.com/actual-problems-of-modern-science. doi: 10.46299/ISG.2023.1.4 (in Ukrainian).
- Kurdil NV. Study of clinical, functional and pathohistological signs of persistent vegetative state of toxic genesis. Proceedings of the VIII International Scientific and Practical Conference “The basis for the further movement of scientific knowledge”, February 20–21, 2023. Dresden, Germany, by the “InterSci”. 45-50 (in Ukrainian).
- De Oliveira AM, Paulino MV, Vieira APF, McKinney AM, da Rocha AJ, et al. Imaging Patterns of Toxic and Metabolic Brain Disorders. Radiographics. 2019 Oct;39(6):1672-1695. doi: 10.1148/rg.2019190016.
- Wade DT. How often is the diagnosis of the permanent ve-getative state incorrect? A review of the evidence. Eur J Neurol. 2018 Apr;25(4):619-625. doi: 10.1111/ene.13572.
- Giacino JT, Ashwal S, Childs N, Cranford R, Jennett B, et al. The minimally conscious state. Neurology. 2002;58:349-353. doi: 10.1212/wnl.58.3.349.
- Porcaro C, Nemirovsky IE, Riganello F, Mansour Z, Cerasa A, et al. Diagnostic Developments in Differentiating Unresponsive Wakefulness Syndrome and the Minimally Conscious State. Front Neurol. 2022 Jan 13;12:778951. doi: 10.3389/fneur.2021.778951.
- Picolas C. Is the “Minimally Conscious State” Patient Minimally Self-Aware? Front Psychol. 2020 Nov 12;11:539665. doi: 10.3389/fpsyg.2020.539665.
- Dolce G, Quintieri M, Leto E, Milano M, Pileggi A, et al. Dysautonomia and Clinical Outcome in Vegetative State. J Neurotrauma. 2021 May 15;38(10):1441-1444. doi: 10.1089/neu.2008.0536.
- Kondziella D, Bender A, Diserens K, et al. European Aca-demy of Neurology guideline on the diagnosis of coma and other disorders of consciousness. Eur J Neurol. 2020;27:741-756. doi: 10.1111/ene.14151.
- Newcomer K. The minimally conscious state: much work still to be done. Ann Palliat Med. 2022 Jul;11(7):2194-2195. doi: 10.21037/apm-22-460.
- Fins J. When No One Notices: Disorders of Consciousness and the Chronic Vegetative State. J Hastings Cent Rep. 2019 Jul;49(4):14-17. doi: 10.1002/hast.1030.
- Matvienko YuO, Negrych TI, Marienko LB, Korol HM. Emergency conditions in neurology: a textbook. Lviv: Danylo Halytsky LNMU; 2020. 224 p. (in Ukrainian).
- Ferrari A, Coccia CPR, Bertolini A, Sternieri E. Methadone — metabolism, pharmacokinetics and interactions. Pharmacol Res. 2004 Dec;50(6):551-9. doi: 10.1016/j.phrs.2004.05.002.
- Wang J, Hu X, Hu Z, et al. The misdiagnosis of prolonged disorders of consciousness by a clinical consensus compared with repeated coma-recovery scale-revised assessment. BMC Neurol. 2020;20:343. doi: 10.1186/s12883-020-01924-9.
- Kulkarni VP, Kaiwen Lin K, Benbadis SR. EEG Findings in the Persistent Vegetative State. Journal of Clinical Neurophysiology. 2008;24(6):433-7. doi: 10.1097/WNP.0b013e31815c2810.
- Bai Y, Lin Y, Ziemann U. Managing disorders of consciousness: the role of electroencephalography. J Neurol. 2021 Nov;268(11):4033-4065. doi: 10.1007/s00415-020-10095-z.
- Simona De Salvo, Placido Bramanti, Silvia Marino. Clinical differentiation and outcome evaluation in vegetative and minimally conscious state patients: the neurophysiological approach. Funct Neurol. 2012 Jul-Sep;27(3):155-162.
- Bender A, Jox RJ, Grill E, Straube A, Lulé D. Persistent Vegetative State and Minimally Conscious State. A systematic review and meta-analysis of diagnostic procedures. Dtsch Arztebl Int. 2015;112:235-42. doi: 10.3238/arztebl.2015.0235.
- Patil S, Writer M, Werner Th, Revheim M-E, Hoilund-Carlsen P, Alavi A. Aging and Cerebral Glucose Metabolism: 18F-FDG-PET/CT Reveals Distinct Global and Regional Metabolic Changes in Healthy Patients. Life. 2023;13(10):2044. doi: 10.3390/life13102044.
- Rissman L, Paquette ET. Ethical and legal considerations related to disorders of consciousness. Curr Opin Pediatr. 2020;32:765-771. doi: 10.1097/MOP.0000000000000961.
- Span-Sluyter CAMFH, Lavrijsen JCM, van Leeuwen E, Koopmans RTCM. Moral dilemmas and conflicts concerning patients in a vegetativestate/unresponsive wakefulness syndrome: shared or non-shared decision making? A qualitative study of the professional perspective in two moral case deliberations. BMC Med Ethics. 2018 Feb 22;19(1):10. doi: 10.1186/s12910-018-0247-8.
- Peterson A, Owen AM, Karlawish J. Alive inside. Bioethics. 2020 Mar;34(3):295-305. doi: 10.1111/bioe.12678.
- Olaya J, Note E, Navarro MD, et al. When, how, and to what extent are individuals with unresponsive wakefulness syndrome able to progress? Functional independence. Brain Sci. 2020;10:990. doi: 10.3390/brainsci10120990.
- Wijdicks EFM. Predicting the outcome of a comatose patient at the bedside. Pract Neurol. 2020 Feb;20(1):26-33. doi: 10.1136/practneurol-2019-002359.