Резюме
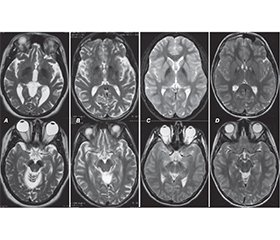
Нейродегенерації з накопиченням заліза в головному мозку (ННЗМ) становлять групу генетично детермінованих і клінічно неоднорідних форм прогресуючої неврологічної патології, пов’язаної з відкладанням заліза в базальних гангліях та інших структурах великого мозку, що, у свою чергу, призводить до порушення їх функції. Захворювання може дебютувати і проявлятися як у дитячому, так і в дорослому віці. Мета роботи: привернути увагу лікарів до важливості своєчасної діагностики нейродегенеративних захворювань, які проявляються порушеннями рухової активності і аномальним накопиченням заліза в різних структурах мозку. У клінічній картині ННЗМ переважають рухові розлади, здебільшого поєднання паркінсонізму, дистонії, пірамідної недостатності й атаксії. Ділянки відкладання заліза виявляються на МРТ як білатеральні гіподенсивні зони, у центрі яких у багатьох випадках визначаються гіперденсивні вогнища, ймовірно, за рахунок гліозу переважно в ділянці блідих куль (симптом «око тигра»). Типові нейровізуалізаційні ознаки дозволяють з високою ймовірністю встановити попередній діагноз ННЗМ за наявності, а іноді й до виникнення клінічних проявів захворювання, скорочуючи час та витрати на додаткові дослідження. У роботі описаний клінічний випадок ННЗМ, асоційованої з білком мітохондріальної мембрани, а також висвітлені новітні дані про клінічні прояви, діагностику та сучасний менеджмент такої патології. Продемонстровано можливість і важливість сучасної діагностики і терапії в дитячому віці. Генетичне обстеження залишається вирішальним для верифікації спадково-дегенеративного захворювання та визначення його форми. Аналіз літературних даних і результати власних спостережень підтверджують важливість наведених основних напрямків доступного симптоматичного лікування, а також підходи до патогенетичної терапії, які ще потребують подальших клінічних випробувань. Наведене клінічне спостереження та проведений аналіз даних літератури з проблеми ННЗМ відображають доцільність пошуку у хворих з руховими (екстрапірамідними, пірамідними, координаторними) розладами характерних нейровізуалізаційних патернів з подальшою верифікацією діагнозу шляхом молекулярно-генетичного дослідження.
Neurodegenerations with brain iron accumulation (NBIA) constitute a group of genetically determined and clinically heterogeneous forms of progressive neurological pathology associated with the accumulation of iron in the basal ganglia and other structures of the brain, which, in turn, causes their dysfunction. Both childhood and adulthood onset of the disease is possible. Objective: to draw the attention of doctors to the importance of timely diagnosis of neurodegenerative diseases, which are manifested by movement disorders and abnormal accumulation of iron in various structures of the brain. Movement disorders, mostly a combination of parkinsonism, dystonia, pyramidal insufficiency and ataxia, are dominant in the clinical picture of NBIA. Areas of iron deposition are detected on magnetic resonance imaging as bilateral hypodense zones, in the center of which hyperdense foci are determined in many cases, probably due to the gliosis, mainly in the area of the globus pallidus (eye-of-the-tiger sign). Typical neuroimaging signs help make a preliminary diagnosis of NBIA with a high probability, in the presence and sometimes even before the appearance of clinical manifestations of the disease, reducing costs and time for additional research. The paper describes a clinical case of NBIA associated with the protein of the mitochondrial membrane, and also highlights the latest data on clinical manifestations, diagnosis and modern management of this pathology. The possibility and importance of modern diagnosis and therapy in childhood have been demonstrated. Genetic examination remains crucial for the verification of the hereditary degenerative disease and determination of its form. The analysis of literature data and the results of own observations confirm the importance of the given main directions of available symptomatic treatment, as well as approaches to pathogenetic therapy, which still require further clinical trials. The given clinical observation and the analysis of literature data on the problem of NBIA reflect the expediency of searching for characteristic neuroimaging patterns in patients with motor (extrapyramidal, pyramidal, coordination) disorders with further verification of the diagnosis by means of molecular genetic research.
Список литературы
1. Антипкін Ю.Г., Кирилова Л.Г., Мірошников О.О., Юзва О.О., Сілаєва Л.Ю., Берегела О.В., Мироняк Л.А. Пантотенаткіназа-асоційована нейродегенерація (хвороба Галлервордена-Шпатца): клінічні аспекти, діагностика, лікування (огляд літератури та власні дані). Запорізький мед. журн. 2021. 23. 5(128). 715-722. doi: 10.14739/2310-1210.2021.5.222677.
2. Marchuk M, Makukh H, Semeryak O, Sharhorodska Y. Sarcotubular myopathy due to novel TRIM32 mutation in Association with Multiple Sclerosis Brain Sciences. 2021;11(8):1020. https://doi.org/10.3390/brainsci11081020.
3. Стеценко Т.І., Коноплянко Т.В. Хвороба Галлевордена-Шпатца. Сучасний погляд на етіологію, патогенез і клініку у дітей та дорослих. Сучасна педіатрія. 2013. 3. 147-150.
4. Тріщинська М.А., Свистільник В.О. Клінічний випадок синдрому сімейних судом із пароксизмальним хореоатетозом, що зумовлений мутацією гена PRRT2. Запорізький медичний журнал. 2019. 21. 6(117). 853-859. doi: 10.14739/2310-1210. 2019.6.186722.
5. Dorosh OI, Bodak KhI, Kozak YaR, Dubey LYa, Dworniak OW, Tsymbalyuk-Voloshyn IP, Dushar MI. Neurodegenerative disease with accumulation of iron in the brain in a child with hemophilia A complicated by inhibitory antibodies. Modern Pediatrics. Ukraine. 2022;8(128): 68-79. doi: 10.15574/SP.2022.128.68.
6. Romano N, Baiardi G, Pinto VM, Quintino S, Gianesin B, Sasso R, et al. Long-Term Neuroradiological and Clinical Evaluation of NBIA Patients Treated with a Deferiprone Based Iron-Chelation Therapy. J Clin Med. 2022;3;11(15):4524. doi: 10.3390/jcm11154524.
7. Marupudi N, Xiong MP. Genetic Targets and Applications of Iron Chelators for Neurodegeneration with Brain Iron Accumulation. ACS Bio Med Chem Au. 2024;11;4(3):119-130. doi: 10.1021/acsbiomedchemau.3c00066.
8. Chang X, Zhang J, Jiang Y, Wang J, Wu Y. Natural history and genotype-phenotype correlation of pantothenate kinase-associated neurodegeneration. CNS Neuroscience & Therapeutics. 2020;26(7):754-761. https://doi.org/10.1111/cns.13294.
9. Bokhari M, Zulfiqar H, Bokhari SR. Hallervorden-Spatz Disease. StatPearls. 2021. https://www.statpearls.com/ArticleLibrary/ viewarticle/22494.
10. Hinarejos I, Machuca-Arellano C, Sancho P, Espinós C. Mitochondrial Dysfunction, Oxidative Stress and Neuroinflammation in Neurodegeneration with Brain Iron Accumulation (NBIA). Antioxidants. 2020;9:1020. doi: 10.3390/antiox9101020.
11. Lehéricy S, Roze E, Goizet C, Mochel F. MRI of neurodegeneration with brain iron accumulation. Curr Opin Neurol. 2020;33:462-473. doi: 10.1097/WCO.0000000000000844.
12. Roa-Sanchez P, Bido P, Oviedo J, Huppertz HJ, Speckter H, Stoeter P. Changes in Cerebral Gray and White Matter in Patients with Pantothenate Kinase-Associated Neurodegeneration: A Long-Term Magnetic Resonance Imaging Follow-Up Study. J Mov. Disord. 2021;14:148-152. https://doi.org/10.14802/jmd.20102.
13. Incecik F, Herguner O, Bisgin А. Mitochondrial Membrane Protein-Associated Neurodegeneration: A Case Series of Six Children. Annals of Indian Academy of Neurology. 2020;23(6):802-804. doi: 10.4103/aian.AIAN_268_19.
14. Shao C, Zhu J, Ma X, Siedlak SL, Cohen ML, Lerner A, Wang W. C19orf12 ablation causes ferroptosis in mitochondrial membrane protein-associated with neurodegeneration. Free Radical Biology and Medicine. 2022;182:23-33. https://doi.org/10.1016/j.freeradbiomed.2022.02.006.
15. Hartig M, Prokisch H, Meitinger T, Klopstock T. Mitochondrial membrane protein-associated neurodegeneration (MPAN). Int Rev Neurobiol. 2013;110:73-84. 10.1016/B978-0-12-410502-7.00004-1.
16. Ramesh R, Deenadayalu A, Bhattacharjee S, Paramanandam V. C19orf12 mutation causing mitochondrial membrane-protein Associated Neurodegeneration masquerading as spastic paraplegia. Parkinsonism Relat Disord. 2021;89:146-7.
17. Kola S, Meka Sai SL, Fathima ST, Wahed A, Kandadai RM, Borgohain R. Mitochondrial Membrane Protein-Associated Neurodegeneration (MPAN): Two Phenotypes-Dystonia and Spastic Paraparesis. Annals of Indian Academy of Neurology. 2022;25(6):1200-1202. doi: 10.4103/aian.aian_658_22.
18. Hayflick SJ, Kurian MA, Hogarth P. Neurodegeneration with brain iron accumulation. Handb Clin Neurol. 2018;147:293-305. 10.1016/B978-0-444-63233-3.00019-1.
19. Hogarth P, Gregory A, Kruer MC, Sanford L, Wagoner W, Natowicz MR, et al. New NBIA subtype: genetic, clinical, pathologic, and radiographic features of MPAN. Neurology. 2013;80:268-75. 10.1212/WNL.0b013e31827e07be.
20. Hogarth P. Neurodegeneration with brain iron accumulation: diagnosis and management. J Mov Disord. 2015;8:1-13. 10.14802/jmd.14034.
21. Lee JH, Yun JY, Gregory A, Hogarth P, Hayflick SJ. Brain MRI pattern recognition in neurodegeneration with brain iron accumulation. Front Neurol. 2020;11:1024. doi: 10.3389/fneur.2020.01024.
22. Lee JH, Lee MS. Brain iron accumulation in atypical parkinsonian syndromes: in vivo MRI evidences for distinctive patterns. Front Neurol. 2019;10:74. 10.3389/fneur.2019.00074.
23. Hayflick SJ, Kruer MC, Gregory A, Haack TB, Kurian MA, Houlden HH, et al. β-Propeller protein-associated neurodegeneration: a new X-linked dominant disorder with brain iron accumulation. Brain. 2013;136(Pt 6):1708-17. doi: 10.1093/brain/awt095.
24. Bagwe-Parab S, Kaur G. Molecular targets and therapeutic interventions for iron induced neurodegeneration. Brain Res. Bull. 2020;156:1-9. 10.1016/j.brainresbull.2019.12.011.
25. Iankova V, Karin I, Klopstock T, Schneider SA. Emerging Disease-Modifying Therapies in Neurodegeneration With Brain Iron Accumulation (NBIA) Disorders. Front Neurol. 2021;15;12:629414. doi: 10.3389/fneur.2021.629414.
26. Klopstock T, Tricta F, Neumayr L, Karin I, Zorzi G, Fradette C, et al. Safety and efficacy of deferiprone for pantothenate kinase-associated neurodegeneration: a randomised, double-blind, controlled trial and an open-label extension study. Lancet Neurol. 2019;18:631-42. 10.1016/S1474-4422(19)30142-5.
27. Karin I, Büchner B, Gauzy F, Klucken A, Klopstock T. Treat Iron-Related Childhood-Onset Neurodegeneration (TIRCON)-An International Network on Care and Research for Patients With Neurodegeneration With Brain Iron Accumulation (NBIA). Front Neurol. 2021;22;12:642228. doi: 10.3389/fneur.2021.642228.
28. Hartig M, Iuso A, Haack T, et al. Absence of an Orphan Mitochondrial Protein, C19orf12, Causes a Distinct Clinical Subtype of Neurodegeneration with Brain Iron Accumulation, The American Journal of Human Genetics, 2011;89(4):543-550. https://doi.org/10.1016/j.ajhg.2011.09.007.