Международный эндокринологический журнал Том 20, №4, 2024
Вернуться к номеру
Зв’язок функції щитоподібної залози матері з плацентарною гемодинамікою під час вагітності
Авторы: O.S. Paienok (1), R.G. Protsiuk (2), A.V. Paienok (1), B.V. Zadorozhna (1), B.R. Hrytsyshyn (3), S.V. Ihnatovych (3)
(1) - Danylo Halytsky Lviv National Medical University, Lviv, Ukraine
(2) - Bogomolets National Medical University, Kyiv, Ukraine
(3) - Lviv Regional Clinical Hospital, Lviv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
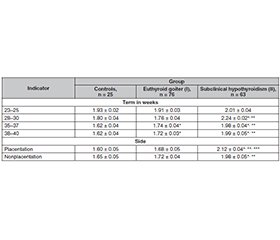
Проведено обстеження 164 вагітних жінок, які були розділені на три групи. До І групи увійшли 76 вагітних (46,4 %) з еутиреоїдним зобом I–IІ ступеня. Другу групу становили 63 жінки (38,4 %) із субклінічним гіпотиреозом та дифузним зобом I–IІ ступеня. Третя група була контрольною та складалася з 25 (15,2 %) вагітних без патології щитоподібної залози. Вивчали стан плаценти із характеристикою ультразвукової плацентографії, визначали порушення дозрівання плаценти, площу, локалізацію, виявляли патологічні зміни плацентарної тканини. Оцінювали зміни систолічно-діастолічного співвідношення в маткових артеріях, артеріях пуповини, визначали індекс резистентності в маткових артеріях та пульсаційний індекс в аорті та середній мозковій артерії плода за допомогою методу кольорового доплерівського картування кровотоку в системі «мати — плацента — плід». При вивченні ехографічної картини структурних змін плаценти виявлено вірогідне порушення її дозрівання, особливо в групі з еутиреоїдним зобом. Ультразвуковий скринінг встановив, що в кожної другої вагітної з тиреопатією стан плаценти не відповідав терміну вагітності, відзначалися набряклість, кісти та інфаркти плаценти, висока частота дифузних змін плацентарної тканини, гіперехогенні включення в навколоплідних водах. Звертає на себе увагу підвищення індексу резистентності в маткових артеріях, особливо у вагітних із субклінічним гіпотиреозом. Зі збільшенням терміну гестації периферичний опір мікросудинного русла плаценти підвищується у зв’язку з інволюційно-дистрофічними змінами та циркуляторними розладами, що дозволяє розробити критерії прогнозування та діагностики плацентарної дисфункції, попередити перинатальні порушення у вагітних із тиреопатіями.
We examined 164 pregnant women who were divided into three groups. Group I included 76 pregnant women (46.4 %) with euthyroid goiter of I–II degree. Group II consisted of 63 pregnant women (38.4 %) with subclinical hypothyroidism and diffuse thyroid goiter of I–II degree. Group III was the controls and consisted of 25 (15.2 %) pregnant women without thyroid pathology. The placenta was studied with the characteristics of ultrasound placentography, placental maturation disorders, the area and localization were determined, and pathological changes in the placental tissue were detected. Changes in the systolic-diastolic ratio in the uterine arteries and umbilical cord arteries were assessed, the resistance index in the uterine arteries, the pulsatile index in the fetal aorta and middle cerebral artery were determined using the method of color Doppler mapping of blood flow in the mother-placenta-fetus system. Study of the echographic picture of structural changes in the placenta revealed a significant impairment of its maturation, especially in the group with euthyroidism. Ultrasound screening revealed that in every second pregnant woman with thyroid disease, the condition of the placenta did not correspond to the gestational age, there were swelling, cysts and placental infarctions, a high frequency of diffuse changes in placental tissue, and hyperechogenic inclusions in the amniotic fluid. An increase in the resistance index in the uterine arteries of pregnant women, especially those with subclinical hypothyroidism, is noteworthy. With increasing gestational age, the peripheral resistance of the placental microvasculature increases due to involutional-dystrophic changes and circulatory disorders, which allows us to develop criteria for the prognosis and diagnosis of placental dysfunction, and to prevent perinatal disorders in pregnant women with thyroid disease.
гіпотиреоз; щитоподібна залоза; вагітність; плацентарна дисфункція; доплерометрія; плацентографія
hypothyroidism; thyroid gland; pregnancy; placental dysfunction; dopplerometry; placentography
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Meng Y, Lin J, Fan J. A Novel Nomogram for Predicting the Risk of Premature Delivery Based on the Thyroid Function in Pregnant Women. Front Endocrinol (Lausanne). 2022 Jan 10;12:793650. doi: 10.3389/fendo.2021.793650.
- Shrestha A, Tripathi P, Dongol A. Pregnancy Outcomes in Patients with Hypothyroidism. Kathmandu Univ Med J (KUMJ). 2019 Jan-Mar;17(65):57-60.
- Prajapati S, Prajapati G, Shrestha V, Shrestha S. Assessment of Thyroid Dysfunction During Different Trimester of Pregnancy. J Nepal Health Res Counc. 2023 Jul 20;20(4):830-833. doi: 10.33314/jnhrc.v20i4.3712.
- Moog NK, Entringer S, Heim C, Wadhwa PD, Kathmann N, Buss C. Influence of maternal thyroid hormones during gestation on fetal brain development. Neuroscience. 2017 Feb 7;342:68-100. doi: 10.1016/j.neuroscience.2015.09.070.
- Kotani T, Imai K, Ushida T, Moriyama Y, Nakano-Kobaya–shi T, et al. Pregnancy Outcomes in Women with Thyroid Diseases. JMA J. 2022 Apr 15;5(2):216-223. doi: 10.31662/jmaj.2021-0191.
- Kravchenko V, Zakharchenko T. Thyroid hormones and mine–rals in immunocorrection of disorders in autoimmune thyroid diseases. Front Endocrinol (Lausanne). 2023 Aug 30;14:1225494. doi: 10.3389/fendo.2023.1225494.
- Buldyhina Y, Strafun L, Terekhova H, Shliakhtych S, Pankiv V. Diagnosis and treatment of thyrotoxicosis during pregnancy and in the postpartum period. A fragment of 2017 Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and the postpartum. Internatio–nal Journal of Endocrinology (Ukraine). 2019;15(2):165-177. doi: 10.22141/2224-0721.15.2.2019.166111.
- Lintula A, Keski-Nisula L, Sahlman H. Hypothyroi–dism and the increased risk of preeclampsia — interpretative factors? Hypertens Pregnancy. 2020 Nov;39(4):411-417. doi: 10.1080/10641955.2020.1800030.
- Lopez-Tello J, Sferruzzi-Perri AN. Characterization of placental endocrine function and fetal brain development in a mouse model of small for gestational age. Front Endocrinol (Lausanne). 2023 Feb 10;14:1116770. doi: 10.3389/fendo.2023.1116770.
- Yanachkova V, Staynova R, Naseva E, Kamenov Z. The Role of Placental Growth Factor in the Prediction of Carbohydrate and Thyroid Disorders during Pregnancy. Medicina (Kaunas). 2022 Feb 3;58(2):232. doi: 10.3390/medicina58020232.
- Gardella B, Dominoni M, Scatigno AL, Cesari S, Fiandrino G, еt al. What is known about neuroplacentology in fetal growth restriction and in preterm infants: A narrative review of literature. Front Endocrinol (Lausanne). 2022 Aug 19;13:936171. doi: 10.3389/fendo.2022.936171.
- Brandt JS, Ananth CV. Placental abruption at near-term and term gestations: pathophysiology, epidemiology, diagnosis, and ma–nagement. Am J Obstet Gynecol. 2023 May;228(5S):S1313-S1329. doi: 10.1016/j.ajog.2022.06.059.
- Ornaghi S, Mueller M, Barnea ER, Paidas MJ. Thrombosis during pregnancy: risks, prevention, and treatment for mother and fetus — harvesting the power of omic technology, biomarkers and in vitro or in vivo models to facilitate the treatment of thrombosis. Birth Defects Res C Embryo Today. 2015 Sep;105(3):209-25. doi: 10.1002/bdrc.21103.
- Gumina DL, Su EJ. Mechanistic insights into the deve–lopment of severe fetal growth restriction. Clin Sci (Lond). 2023 Apr 26;137(8):679-695. doi: 10.1042/CS20220284.
- Dumolt JH, Powell TL, Jansson T. Placental Function and the Development of Fetal Overgrowth and Fetal Growth Restriction. Obstet Gynecol Clin North Am. 2021 Jun;48(2):247-266. doi: 10.1016/j.ogc.2021.02.001.
- Tikkanen M. Placental abruption: epidemiology, risk factors and consequences. Acta Obstet Gynecol Scand. 2011 Feb;90(2):140-9. doi: 10.1111/j.1600-0412.2010.01030.x.
- Cindrova-Davies T, Sferruzzi-Perri AN. Human placental development and function. Semin Cell Dev Biol. 2022 Nov;131:66-77. doi: 10.1016/j.semcdb.2022.03.039.
- Siassakos D, Bourne I, Sebire N, Kindinger L, Whitten SM, Battaglino C. Abnormal placental villous maturity and dysregulated glucose metabolism: implications for stillbirth prevention. J Perinat Med. 2022 Apr 1;50(6):763-768. doi: 10.1515/jpm-2021-0579.
- Meakin C, Barrett ES, Aleksunes LM. Extravillous trophoblast migration and invasion: Impact of environmental chemicals and pharmaceuticals. Reprod Toxicol. 2022 Jan;107:60-68. doi: 10.1016/j.reprotox.2021.11.008.
- Wang C, Niu Q, Lv H, Li Q, Ma Y, et al. Elevated TPOAb is a Strong Predictor of Autoimmune Development in Patients of Type 2 Diabetes Mellitus and Non-Alcoholic Fatty Liver Disease: A Case-Control Study. Diabetes Metab Syndr Obes. 2020 Nov 16;13:4369-4378. doi: 10.2147/DMSO.S280231.