Международный эндокринологический журнал Том 20, №4, 2024
Вернуться к номеру
Індикатор остеогенезу — потенційний маркер ризику серцево-судинних захворювань у хворих на цукровий діабет 2-го типу
Авторы: Ковальчук А.В. (1), Зінич О.В. (1), Кушнарьова Н.М. (1), Ковальчук В.М. (2), Прибила О.В. (1), Шишкань-Шишова К.О. (1)
(1) - ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
(2) - Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
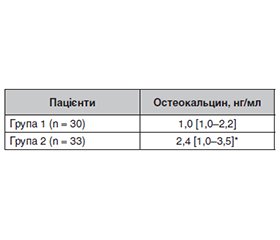
Актуальність. Зростання летальності внаслідок серцево-судинних захворювань у пацієнтів із цукровим діабетом (ЦД) обумовлює необхідність пошуку ефективних стратегій профілактики й лікування. Як одну з потенційних терапевтичних мішеней впливу розглядають остеокальцин, який є доведеним маркером кісткового обміну, що відіграє ключову роль у патогенезі хвороб серцево-судинної системи. Мета дослідження: встановити можливі взаємозв’язки між вмістом остеокальцину і тяжкими серцево-судинними захворюваннями (ССЗ) у хворих на цукровий діабет 2-го типу. Матеріали та методи. Обстежено 63 пацієнти із ЦД 2-го типу: 40 (63,49 %) чоловіків і 23 (36,51 %) жінки, середній вік — 58,11 ± 1,25 року. Усім визначали показники остеокальцину крові, глікованого гемоглобіну, розраховували індекс маси тіла. Серед обстежених сформовано дві групи: група 1 (n = 30) — з документованими в анамнезі ССЗ, група 2 (n = 33) — без зазначених станів у минулому. У подальшому залежно від величини остеокальцину пацієнтів групи 2 додатково розподілили на підгрупи 2.1 і 2.2 з метою визначення вірогідності різниці між ними в параметрах ехокардіографічного дослідження, яке було виконано всім пацієнтам групи 2. Статистичну обробку результатів проводили за допомогою програми IBM SPSS Statistics 20 (IBM Corp., США). Відмінність інтерпретували як вірогідну при р < 0,05. Результати. У пацієнтів групи 1 з документованими в анамнезі ССЗ (гострий інфаркт міокарда, гостре порушення мозкового кровообігу, стентування коронарних або периферичних артерій на тлі ЦД 2-го типу) спостерігали нижчі значення остеокальцину сироватки крові порівняно з показниками хворих групи 2 без зазначених ускладнень (1,0 [1,0–2,2] проти 2,4 [1,0–3,5], р = 0,016). За параметрами ехокардіографії встановлено, що серед пацієнтів без клінічних ознак ССЗ низькі значення остеокальцину сироватки крові асоційовані з виникненням діастолічної дисфункції за типом сповільненої релаксації, гіпертрофією лівого шлуночка та атеросклеротичним ураженням стінок аорти, що не спостерігали у хворих на ЦД 2-го типу з вищими значеннями маркера (1,0 [1,0–2,3] нг/мл проти 3,6 [3,2–4,4] нг/мл, р < 0,001). Висновки. Взаємозв’язок між вмістом остеокальцину і ССЗ у пацієнтів із ЦД 2-го типу свідчить про високий потенціал використання остеокальцину сироватки крові, а саме низьких його значень, як маркера тяжких кардіоваскулярних станів у майбутньому.
Background. An increase in mortality due to cardiovascular diseases in patients with diabetes mellitus necessitates the search for effective prevention and treatment strategies. Osteocalcin, a proven marker of bone metabolism playing a key role in the pathogenesis of cardiovascular diseases, is considered one of the potential therapeutic targets. The purpose of the study was to reveal possible relationships between the osteocalcin level and severe cardiovascular diseases in patients with type 2 diabetes (T2DM). Materials and methods. Sixty-three patients with T2DM were examined, 40 (63.49 %) men and 23 (36.51 %) women, average age 58.11 ± 1.25 years. Blood osteocalcin, glycated hemoglobin were evaluated, and body mass index was calculated. Two groups were formed: group 1 (n = 30) with a history of cardiovascular diseases, group 2 (n = 33) without the specified conditions in the past. Later, depending on the amount of osteocalcin, the patients of group 2 were further divided into subgroups 2.1 and 2.2, in order to determine the probability of a difference between them in the parameters of the echocardiographic study, which was performed for all patients of group 2. Statistical processing of the results was carried out using the IBM SPSS Statistics 20 program (IBM Corp., USA). The difference was considered significant at p < 0.05. Results. Group 1 patients with a history of cardiovascular diseases (acute myocardial infarction, acute cerebrovascular accident, stenting of coronary or peripheral arteries on the background of T2DM) had lower values of serum osteocalcin compared to the group 2 without specified complications (1.0 [1.0–2.2] vs. 2.4 [1.0–3.5], p = 0.016). Echocardiography revealed that among patients without clinical signs of cardiovascular diseases, low serum osteocalcin values were associated with the occurrence of diastolic dysfunction in the form of delayed relaxation, left ventricular hypertrophy and atherosclerotic lesions of the aortic walls, which were not observed among participants with type 2 diabetes with higher values of the marker (1.0 ng/ml [1.0–2.3] vs. 3.6 ng/ml [3.2–4.4], p < 0.001). Conclusions. The relationship between the osteocalcin level and cardiovascular diseases in patients with T2DM indicates a high potential for the use of serum osteocalcin, namely its low values, as a marker of severe cardiovascular conditions in the future.
цукровий діабет; остеокальцин; остеогенез; серцево-судинні захворювання
diabetes; osteocalcin; osteogenesis; cardiovascular diseases
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Ma CX, Ma XN, Guan CH, Li YD, Mauricio D, Fu SB. Cardiovascular disease in type 2 diabetes mellitus: progress toward personalized management. Cardiovasc Diabetol. 2022 May 14;21(1):74. doi: 10.1186/s12933-022-01516-6. PMID: 35568946; PMCID: PMC9107726.
- Jain V, Minhas AMK, Ariss RW, Nazir S, Khan SU, Khan MS, Rifai MA, et al. Demographic and Regional Trends of Cardiovascular Diseases and Diabetes Mellitus-Related Mortality in the United States From 1999 to 2019. Am J Med. 2023 Jul;136(7):659-668.e7. doi: 10.1016/j.amjmed.2023.03.002. Epub 2023 May 12. PMID: 37183138.
- Mak KH, Vidal-Petiot E, Young R, Sorbets E, Greenlaw N, Ford I, Tendera M, et al; CLARIFY Investigators. Prevalence of diabetes and impact on cardiovascular events and mortality in patients with chronic coronary syndromes, across multiple geographical regions and ethnicities. Eur J Prev Cardiol. 2022 Jan 11;28(16):1795-1806. doi: 10.1093/eurjpc/zwab011. PMID: 35022686.
- Assante R, Mainolfi CG, Zampella E, Gaudieri V, Nappi C, Mannarino T, D’Antonio A, et al. Relation between myocardial blood flow and cardiac events in diabetic patients with suspected coronary artery disease and normal myocardial perfusion imaging. J Nucl Cardiol. 2021 Aug;28(4):1222-1233. doi: 10.1007/s12350-021-02533-w. Epub 2021 Feb 18. Erratum in: J Nucl Cardiol. 2021 Nov 9. PMID: 33599942; PMCID: PMC8421293.
- Serhiyenko V, Serhiyenko A. Diabetes mellitus and congestive heart failure. International Journal of Endocrinology (Ukraine). 2022;18(1):57-69. https://doi.org/10.22141/2224-0721.18.1.2022.1146.
- Sørensen IM, Bisgaard LS, Bjergfelt SS, Ballegaard EL, Bie–ring-Sørensen T, Landler NE, Pedersen TX, et al. The metabolic signature of cardiovascular disease and arterial calcification in patients with chronic kidney disease. Atherosclerosis. 2022 Jun;350:109-118. doi: 10.1016/j.atherosclerosis.2022.03.019. Epub 2022 Mar 21. PMID: 35339279.
- Li W, Liu X, Liu L, Zhang L, Li M, Liu R, Li T, Chen E, Liu S. Relationships of Serum Bone Turnover Markers With Metabolic Syndrome Components and Carotid Atherosclerosis in Patients With Type 2 Diabetes Mellitus. Front Cardiovasc Med. 2022 Apr 25;9:824561. doi: 10.3389/fcvm.2022.824561. PMID: 35548441; PMCID: PMC9081760.
- Rashdan NA, Sim AM, Cui L, Phadwal K, Roberts FL, Carter R, Ozdemir DD, et al. Osteocalcin Regulates Arterial Calcification Via Altered Wnt Signaling and Glucose Metabolism. J Bone Miner Res. 2020 Feb;35(2):357-367. doi: 10.1002/jbmr.3888. Epub 2019 Oct 29. PMID: 31596966.
- Wen L, Chen J, Duan L, Li S. Vitamin K‑dependent proteins involved in bone and cardiovascular health (Review). Mol Med Rep. 2018 Jul;18(1):3-15. doi: 10.3892/mmr.2018.8940. Epub 2018 Apr 27. PMID: 29749440; PMCID: PMC6059683.
- Roumeliotis S, Roumeliotis A, Dounousi E, Eleftheriadis T, Liakopoulos V. Biomarkers of vascular calcification in serum. Adv Clin Chem. 2020;98:91-147. doi: 10.1016/bs.acc.2020.02.004. Epub 2020 Apr 27. PMID: 32564789.
- Chi PJ, Lin YL, Tasi JP, Wang CH, Hou JS, Lee CJ, Hsu BG. Osteocalcin and carotid-femoral pulse wave velocity in patients on peritoneal dialysis. Ci Ji Yi Xue Za Zhi. 2019 Jan-Mar;31(1):23-28. doi: 10.4103/tcmj.tcmj_12_18. PMID: 30692828; PMCID: PMC6334564.
- Si SC, Yang W, Luo HY, Ma YX, Zhao H, Liu J. Association of bone turnover biomarkers with severe intracranial and extracranial artery stenosis in type 2 diabetes mellitus patients. World J Diabetes. 2023;14(5):594-605. doi:10.4239/wjd.v14.i5.594.
- Mykhailovska NS, Stetsiuk IO, Kulynych TO, Gorbachova SV, Zhulkevych IV. The interrelationship of bone and cardiovascular remodeling biomarkers and clinical peculiarities of coronary artery disease in postmenopausal women. Reumatologia. 2020;58(3):142-149. doi: 10.5114/reum.2020.96687.
- Seidu S, Kunutsor SK, Khunti K. Association of circulating osteocalcin with cardiovascular disease and intermediate cardiovascular phenotypes: systematic review and meta-analysis. Scand Cardiovasc J. 2019;53(6):286-295. doi:10.1080/14017431.2019.1655166.
- Zhang XL, Shen Y, Ma XJ, Lu ZG, Xu YT, Xiong Q, Bao YQ. Low serum osteocalcin levels are correlated with left ventricular systolic dysfunction and cardiac death in Chinese men. Acta Pharmacol Sin. 2019 Apr;40(4):486-491. doi: 10.1038/s41401-018-0080-0. Epub 2018 Jul 10. PMID: 29991714; PMCID: PMC6461952.
- Qaradakhi T, Gadanec LK, Tacey AB, Hare DL, Buxton BF, Apostolopoulos V, Levinger I, Zulli A. The Effect of Recombinant Undercarboxylated Osteocalcin on Endothelial Dysfunction. Calcif Tissue Int. 2019 Nov;105(5):546-556. doi: 10.1007/s00223-019-00600-6. Epub 2019 Sep 4. PMID: 31485687.
- Luo Y, Ma X, Hao Y, Xiong Q, Xu Y, Pan X, Bao Y, Jia W. Relationship between serum osteocalcin level and carotid intima-media thickness in a metabolically healthy Chinese population. Cardiovasc Diabetol. 2015 Jun 16;14:82. doi: 10.1186/s12933-015-0245-9. PMID: 26077201; PMCID: PMC4472164.
- Tacey A, Sim M, Smith C, Woessner MN, Byrnes E, Le–wis JR, Brennan-Speranza T, et al. Association between Circulating Osteocalcin and Cardiometabolic Risk Factors following a 4-Week Leafy Green Vitamin K-Rich Diet. Ann Nutr Metab. 2020;76(5):361-367. doi: 10.1159/000511660. Epub 2020 Nov 24. PMID: 33232964.
- Tacey A, Hayes A, Zulli A, Levinger I. Osteocalcin and vascular function: is there a cross-talk? Mol Metab. 2021;49:101205. doi: 10.1016/j.molmet.2021.101205.
- Liu D, Chen L, Dong S, Peng Z, Yang H, Chen Y, Li L, et al. Bone mass density and bone metabolism marker are associated with progression of carotid and cardiac calcified plaque in Chinese elderly population. Osteoporos Int. 2019 Sep;30(9):1807-1815. doi: 10.1007/s00198-019-05031-5. Epub 2019 Jun 10. PMID: 31190121.
- Toya T, Ozcan I, Corban MT, Sara JD, Marietta EV, Ahmad A, Horwath IE, et al. Compositional change of gut microbiome and osteocalcin expressing endothelial progenitor cells in patients with coronary artery disease. PLoS One. 2021 Mar 25;16(3):e0249187. doi: 10.1371/journal.pone.0249187. PMID: 33765061; PMCID: PMC7993831.
- Kim KJ, Kim KM, Park KH, Choi HS, Rhee Y, Lee YH, Cha BS et al. Aortic calcification and bone metabolism: the relationship between aortic calcification, BMD, vertebral fracture, 25-hydroxyvitamin D, and osteocalcin. Calcif Tissue Int. 2012;91(6):370-8. doi: 10.1007/s00223-012-9642-1.
- Ling Y, Wang Z, Wu B, Gao X. Association of bone metabolism markers with coronary atherosclerosis and coronary artery disease in postmenopausal women. J Bone Miner Metab. 2018;36(3):352-363. doi: 10.1007/s00774-017-0841-8.
- Go JL, Prem K, Al-Hijji MA, Qin Q, Noble C, Young MD, Lerman LO, Lerman A. Experimental Metabolic Syndrome Model Associated with Mechanical and Structural Degenerative Changes of the Aortic Valve. Sci Rep. 2018 Dec 13;8(1):17835. doi: 10.1038/s41598-018-36388-y. PMID: 30546028; PMCID: PMC6292876.