Международный эндокринологический журнал Том 20, №1, 2024
Вернуться к номеру
Нові можливості корекції гормональних порушень і оксидативного стресу в жінок з генітальним ендометріозом
Авторы: Семенина Г.Б., Грицько М.І., Дорошенко-Кравчик М.В., Коритко О.О., Фартушок Т.В.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
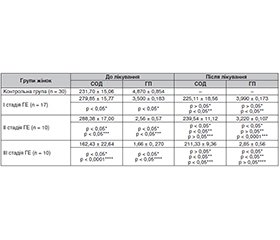
Актуальність. Генітальний ендометріоз є однією з найактуальніших проблем сучасної гінекології. Розглядаючи оксидативний стрес як патогенетичну ланку ендометріозу, ми вважаємо обґрунтованим застосування в лікуванні комбінованого препарату, який містить супероксиддисмутазу, ресвератрол і цинк. Мета роботи: оцінити ефективність лікування генітального ендометріозу, доповненого застосуванням супероксиддисмутази, ресвератролу і цинку з урахуванням провідних патофізіологічних ланок патології. Матеріали та методи. Під спостереженням перебували 37 жінок репродуктивного віку з генітальним ендометріозом. Лікування жінок першої групи проводилося відповідно до настанови Guideline Development Group, GDG. 39 жінок другої групи додатково отримували препарат із вмістом супероксиддисмутази, ресвератролу і цинку. До групи контролю увійшли 30 здорових жінок. Проводили визначення показників стану процесів перекисного окиснення ліпідів за вмістом у сироватці крові пацієнток дієнових кон’югатів і малонового діальдегіду та антиоксидантної системи захисту за вмістом супероксиддисмутази і глутатіонпероксидази. Для моніторингу якості життя пацієнток проводили оцінку больового синдрому за візуальною аналоговою шкалою. Статистична обробка одержаних даних проводилася за допомогою стандартного пакета програм StatSoft Statistіca for Windows 13.0. Результати. Оцінка больового синдрому в пацієнток другої групи показала, що больовий синдром у жінок з першою стадією захворювання повністю зник, серед хворих з другою стадією у 8 жінок відзначалося зникнення болю, у 3 — зменшення із сильного до слабкого болю, при третій стадії у 5 жінок біль зник зовсім, у 4 — зменшився із сильного до слабкого, в однієї жінки зменшився з нестерпного болю до слабкого. Усі пацієнтки другої групи відзначали зменшення болю при статевому житті, а при першій стадії — його відсутність, підвищення працездатності (r = 0,64; p < 0,01), зниження дратівливості й нервозності в перименструальний період (r = –0,59; p < 0,05) і в цілому задоволення результатом лікування. Побічних ефектів не відзначалося в жодної пацієнтки. Висновки. Удосконалення лікувальної тактики генітального ендометріозу шляхом доповнення терапії супероксиддисмутазою, ресвератролом і цинком є патогенетично обґрунтованим, оскільки чинить значний позитивний вплив на систему «перекисне окиснення ліпідів — антиоксидантна система захисту» порівняно з традиційною схемою лікування.
Background. Genital endometriosis is one of the most urgent problems of modern gynecology. Considering oxidative stress as a pathogenetic link of endometriosis, we believe it reasonable to use a combined drug containing superoxide dismutase, resveratrol, and zinc. The purpose of the work was to evaluate the effectiveness of the treatment for genital endometriosis supplemented with the use of superoxide dismutase, resveratrol, and zinc, taking into account the leading pathophysiological links of the pathology. Materials and methods. Thirty-seven women of reproductive age with genital endometriosis were under observation. Treatment in the first group was carried out in accordance with the Guideline Development Group recommendations. Thirty-nine women of the second group additionally received a drug containing superoxide dismutase, resveratrol, and zinc. The control group included 30 healthy women. The state of lipid peroxidation processes was assessed by the level of diene conjugates and malondialdehyde in the blood serum and the antioxidant defense system by the content of superoxide dismutase and glutathione peroxidase. To monitor the patients’ quality of life, pain syndrome was studied using the Visual Analogue Scale. Statistical processing of the obtained data was carried out by means of the standard StatSoft Statistica for Windows 13.0 program package. Results. The assessment of the pain syndrome in the second group showed that it completely disappeared in women with the first stage of the disease. Among patients with the second stage, pain disappeared in 8 cases, 3 patients had a decrease from severe to mild pain. At the third stage, pain disappeared completely in 5 women, in 4 cases, it decreased from severe to mild, and in one woman, the pain decreased from unbearable to mild. All patients of the second group noted a decrease in pain during intercourse, and in the first stage — its absence, an increase in work capacity (r = 0.64, p < 0.01), a decrease in irritability and anxiety in the perimenstrual period (r = –0.59, p < 0.05) and overall satisfaction with the treatment result. Side effects were not noted in any of the patients. Conclusions. Improving treatment for genital endometriosis by supplementing therapy with superoxide dismutase, resveratrol, and zinc is pathogenetically justified, as it has a significant positive effect on the lipid peroxidation and antioxidant defense system, compared to the traditional treatment regimen.
ендометріоз; гормональні порушення; перекисне окиснення ліпідів; оксидативний стрес; супероксиддисмутаза; лікування
endometriosis; hormonal disorders; lipid peroxidation; oxidative stress; superoxide dismutase; treatment
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Horne A.W., Missmer S.A. Pathophysiology, diagnosis, and management of endometriosis. BMJ. 2022 Nov 14. 379. e070750. doi: 10.1136/bmj-2022-070750. PMID: 36375827.
- de Dominique Z., Bruno B., Charles C. Endometriosis and infertility: pathophysiology and management. Lancet. 2020. 376. 730-8. doi: 10.1016/S0140-6736(10)60490-4.
- Arafah M., Rashid S., Akhtar M. Endometriosis: A Comprehensive Review. Adv. Anat. Pathol. 2021 Jan. 28(1). 30-43. doi: 10.1097/PAP.0000000000000288. PMID: 33044230.
- Parasar P., Ozcan P., Terry K.L. Endometriosis: Epidemiology, Diagnosis and Clinical Management. Curr. Obstet. Gynecol. Rep. 2017 Mar. 6(1). 34-41. doi: 10.1007/s13669-017-0187-1. Epub 2017 Jan 27. PMID: 29276652; PMCID: PMC5737931.
- Lee C.E., Yong P.J., Williams C., Allaire C. Factors Associa–ted with Severity of Irritable Bowel Syndrome Symptoms in Patients with Endometriosis. J. Obstet. Gynaecol. Can. 2018 Feb. 40(2). 158-164. doi: 10.1016/j.jogc.2017.06.025. Epub 2017 Sep 1. PMID: 28870721.
- Maddern J., Grundy L., Castro J., Brierley S.M. Pain in Endometriosis. Front. Cell. Neurosci. 2020 Oct 6. 14. 590823. doi: 10.3389/fncel.2020.590823. PMID: 33132854; PMCID: PMC7573391.
- Semenyna H.B., Korytko O.O. Effectiveness of vitex agnus castus extract in the treatment of primary dysmenorrhea. International Journal of Endocrinology (Ukraine). 2022. 18(1). 17-21. https://doi.org/10.22141/2224-0721.18.1.2022.1141 (in Ukrainian)
- Ruder E.H., Hartman T.J., Goldman M.B. Impact of oxidative stress on female fertility. Curr. Opin. Obstet. Gynecol. 2019. 21(3). 219-22. doi: 10.1097/gco.0b013e32832924ba.
- Bazot M., Thomassin I., Hourani R., Cortez A., Darai E. Diagnostic accuracy transvaginal sonography for deep pelvic endometriosis. Ultrasound Obstet. Gynecol. 2014. 24. 180-5. doi: 10.1002/uog.1108.
- Green R., Stratton P., Cleary S.D., Ballweg M.L., Sinalii N. Diagnostic experience among 4,334 women reporting surgically diag–nosed endometriosis. Fertil. Steril. 2019. 91. 32-9. doi: 10.1016/j.fertnstert.2007.11.020.
- Jacobson T.Z., Duffy J.M., Barlow D., Farquhar C., Ko–ninckx P.R., Olive D. Laparoscopic surgery for subfertility associated whith endometriosis. Cochrane Database Sys. Rev. 2010. CD001398. doi: 10.1002/14651858.CD001398.pub2.
- Santulli P., Marcellin L., Tosti C., Chouzenoux S., Cerles O., Borghese B., Batteux F., Chapron C. MAP kinases and the inflammatory signaling cascade as targets for the treatment of endometriosis? Expert Opin. The Targets. 2015. 19(11). 1465-83. doi: 10.1517/14728222.2015.1090974.
- Zakhari A., Darl Edwards, Ryu M., Matelski J., Bougie O., Murji A. Dienogest and the risk of Endometriosis recurrence following surgery: A systematic review and meta-analysis. J. Minimally Invasive Gynecol. 2020. 27(7). 1503-10. doi: 10.1016/j.jmig.2020.05.007.
- Laufer M.R. Current approaches to optimizing the treatment of endometriosis in adolescents. Gynecol. Obstet. Investig. 2018. 66 (Suppl 1). 19-27. doi: 10.1159/000148027.
- Liu M., Sun X., Chen B., Dai R., Xi Z., Xu H. Insights into manganese superoxide dismutase and human diseases. Int. J. Mol. Sci. 2022. 23(24). 15893. doi: 10.3390/ijms232415893.
- Rosa A.C., Corsi D., Cavi N., Dosio F. Superoxide dismutase administration: A review of proposed human uses. Molecules. 2021. 26(7). 184420. doi: 10.3390/molecules26071844.
- Mohammadi R.K., Arablou Т. Resveratrol and endometriosis: In vitro and animal studies and underlying mechanisms (Review). Biomedicine and Pharmacotherapy. 2017. 91. 220-8. doi: 10.1016/j.biopha.2017.04.078.
- Becker C.M., D’Amato R.J. Angiogenesis and antiangiogenetic therapy in endometriosis. Microvasc. Res. 2017. 74. 212-30. doi: 10.1016/j.mvr.2017.04.008.
- Onuma T., Mizutani T., Fujita Y., Ohgami N., Ohnuma S., Kato M., Yoshida Y. Zinc deficiency is associated with the development of ovarian endometrial cysts. Am. J. Cancer. Res. 2023 Mar 15. 13(3). 1049-1066. PMID: 37034203; PMCID: PMC10077050.
- Becker C.M., Bokor A., Heikinheimo O., Horne A., Jansen F., Kiesel L., King K. et al.; ESHRE Endometriosis Guideline Group. ESHRE guideline: endometriosis. Hum. Reprod. Open. 2022 Feb 26. 2022(2). hoac009. doi: 10.1093/hropen/hoac009. PMID: 35350465; PMCID: PMC8951218.
- Droz J., Howard F. Use of the Short-Form McGill Pain Questionnaire as a diagnostic tool in women with chronic pelvic pain. J. Minimally Invasive Gynecol. 2011. 18(2). 211-7. doi: 10.1016/j.jmig.2010.12.009.
- Bahrami A., Ayen E., Razi M., Behfar M. Effects of atorva–statine and resveratrol against the experimental endometriosis; evidens for glucose and monocarboxylate transporters, neoangiogenesis. Life Scienses. 2021. 72(1). 119-230. doi: 10.1016/j.lfs.2021.119230.
- Huijs E., Nap A. The effects of nutrients on symptoms in wo–men with endometriosis: a systematic review. Reprod. BioMed.Online. 2020. 41(2). 317-28. doi: 10.1016/j.rbmo.2020.04.014.
- Messalli E.M., Schettino M.T., Mainini G., Ercolano S., Fuschillo G., Falcone F., Esposito E., et al. The possible role of zinc in the etiopathogenesis of endometriosis. Clin. Exp. Obstet. Gynecol. 2014. 41(5). 541-6. PMID: 25864256.
- Markowska A., Antoszczak M., Markowska J., Huczynski A. The role of selected dietaryfactors in the development and course of endometriosis. Nutrients. 2023. 15(12). 2773. doi: 10.3390/nu15122773.
- Umezawa M., Saito Y., Tanaka-Hattori N., Takeda K., Ihara T. Expression profile of extracellular matrix and adhesion molecules in development of endometriosis in a mouse model. Reprod. Sci. 2022. 19(12). 1365-72. doi: 10.1177/1933719112450340.
- Wang Y., Branicky R., Noe A., Hekimi S. Superoxide dismutases: Dual role in controlling ROS damage and regulating Ros signaling. J. Cell. Biol. 2018. 217(6). 1915-28. doi: 10.1083/jcb.201708007.
- Witz C.A. Cell adhesion molecules and endometriosis. Semin. Reprod. Endocrinol. 2023. 21(2). 173-82. doi: 10.1055/s-2023-41324.