Журнал «Здоровье ребенка» Том 18, №1, 2023
Вернуться к номеру
Вплив поєднаної терапії солями кальцію та вітаміном D на концентрацію макро- та мікроелементів у слині дітей раннього віку
Авторы: Абатуров О.Є. (1), Крючко Т.О. (2), Кривуша О.Л. (1), Бабич В.Л. (1), Токарєва Н.М. (1), Ткаченко О.Я.
(2)
(1) — Дніпровський державний медичний університет, м. Дніпро, Україна
(2) — Полтавський державний медичний університет, м. Полтава, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
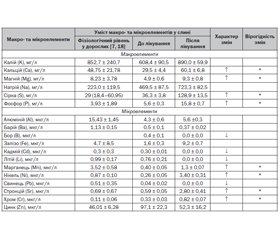
Актуальність. Збалансоване забезпечення макро- та мікроелементами різних органів і систем є необхідною умовою для підтримки стану здоров’я людини. Дефіцит або надлишок макро- та мікроелементів у слині може бути пов’язаний як з розвитком запалення, так і з окиснювальним ушкодженням тканин ротової порожнини. Забезпечення кальцієм організму людини істотно впливає на стан іоному слини. Проте сьогодні існують поодинокі дослідження, присвячені дослідженню впливу препаратів Ca та вітаміну D на стан іоному слини у здорових дітей. Мета роботи: вивчення впливу поєднаного застосування профілактичних доз Ca та вітаміну D на концентрацію макро- та мікроелементів у слині дітей раннього віку. Матеріали та методи. Під нашим спостереженням знаходилось 36 клінічно здорових дітей раннього віку, які протягом 2 місяців отримували препарат Кальцикер 2,5 мл 3 рази на добу. Дослідження вмісту макро- та мікроелементів у сечі проведено методом оптико-емісійної спектрометрії з індуктивно-зв’язаною плазмою. Статистичний аналіз отриманих результатів проводили з використанням пакета прикладних програм Statistica 6.1 за допомогою персонального комп’ютера на базі процесора Intel Pentium. Результати. Проведене дослідження продемонструвало, що поєднане застосування карбонату Ca та вітаміну D вірогідно змінює концентрацію деяких макро- та мікроелементів у слині дітей раннього віку. Рівень деяких мікроелементів у слині до початку проведення терапії препаратом Кальцикер корелював із частотою гострих респіраторних інфекцій (ГРІ). Так, більш висока частота ГРІ спостерігалася у дітей зі зниженою екскрецією Ca та S із слиною. У дітей раннього віку до проведення курсу терапії препаратом Кальцикер відзначалася низька концентрація Ca і Mg у слині. Під впливом курсу лікування препаратом Кальцикер відбувалася активація метаболізму цих макроелементів у слині дітей раннього віку, що характеризувалося підвищенням рівня Ca з 29,5 ± 4,4 мг/л до 60,1 ± 6,8 мг/л (p < 0,01), Mg з 4,9 ± 0,6 мг/л до 9,3 ± 0,8 мг/л (p < 0,01), S з 336,3 ± 3,8 мг/л до 2501,6 ± 275,4 мг/л (p < 0,01) і P з 5,6 ± 0,3 мг/л до 15,8 ± 0,7 мг/л (p < 0,01). Підвищення рівня Са та P у слині після проведеного курсу прийому препарату Кальцикер, ймовірно, має протикарієсну дію. Підвищення концентрації Mg у слині після курсу препарату Кальцикер може справляти протизапальний та протипухлинний вплив на слизові оболонки ротової порожнини. Спільний прийом карбонату Ca та вітаміну D призводив до зникнення екскреції слинними залозами деяких мікроелементів, таких як B, Cd, Li, Pb, що може позбавляти слизові оболонки ротової порожнини та тканини зубів від токсичної дії цих мікроелементів. Висновки. Поєднане застосування карбонату Ca та вітаміну D (препарат Кальцикер) протягом 2 місяців супроводжується змінами іоному слини у дітей раннього віку, які мають протизапальний та протикарієсний характер. Після курсу прийому карбонату Ca та вітаміну D відзначається припинення екскреції деяких мікроелементів зі слиною, що мають токсичний вплив на тканини ротової порожнини. Використання препарату Кальцикер у рекомендованій дозі 2,5 мл 3 рази на добу протягом 2 місяців характеризується високим профілем безпеки і може бути рекомендовано дітям раннього віку, особливо з груп ризику розвитку недостатності кальцію.
Background. A balanced supply of macro- and microelements to various organs and systems is a prerequisite for maintaining human health. Deficiency or excess of macro- and microelements in saliva can be associated with both inflammation and oxidative damage to the oral tissues. Provision of calcium in the human body significantly affects the state of salivary ionome. However, currently there are few studies on the effect of Ca and vitamin D on the state of salivary ionome in healthy children. Purpose: to study the effect of combined use of prophylactic doses of Ca and vitamin D on the concentration of macro- and microelements in saliva of young children. Materials and methods. Under our supervision, there were 36 clinically healthy young children who received Calcicare 2.5 ml 3 times a day for 2 months. The study of the content of macro- and microelements in urine was carried out by optical emission spectrometry with an inductively coupled plasma. Statistical analysis of the results was performed using the application package Statistica 6.1 on a personal computer based on Intel Pentium processor. Results. The study showed that the combined use of calcium carbonate and vitamin D significantly changes the concentration of some macro- and microelements in saliva of young children. The level of some trace elements in saliva before the start of therapy with Calcicare correlated with the frequency of acute respiratory infections. Thus, a higher incidence of acute respiratory infections was observed in children with reduced salivary excretion of Ca and S. Young children had a low concentration of Ca and Mg in saliva before the course of Calcicare therapy. Treatment with Calcicare led to an activation of the metabolism of these macronutrients in saliva of young children, which was characterized by an increase in the level of Ca from 29.5 ± 4.4 mg/l to 60.1 ± 6.8 mg/l (p < 0.01), Mg from 4.9 ± 0.6 mg/l to 9.3 ± 0.8 mg/l (p < 0.01), S from 336.3 ± 3.8 mg/l to 2501.6 ± 275.4 mg/l (p < 0.01), and P from 5.6 ± 0.3 mg/l to 15.8 ± 0.7 mg/l (p < 0.01). An increase in the concentration of Ca and P in saliva after the treatment with Calcicare probably has an anti-caries effect. An increase in the level of Mg in saliva after the course of Calcicare may have anti-inflammatory and antitumor effect on the oral mucosa. Co-administration of calcium carbonate and vitamin D led to the disappearance of salivary excretion of some trace elements such as B, Cd, Li, Pb, which may relieve the oral mucosa and dental tissues from the toxic effects of these trace elements. Conclusions. The combined use of calcium carbonate and vitamin D (Calcicare) for 2 months in young children is accompanied by changes in salivary ionome, which are of anti-inflammatory and anti-caries nature. After taking calcium carbonate and vitamin D, there was a cessation of salivary excretion of some trace elements, which have a toxic effect on the oral tissues. The use of Calcicare in the recommended dose of 2.5 ml 3 times a day for 2 months is characterized by a high safety profile and can be recommended for young children, especially those at risk of developing calcium deficiency.
діти раннього віку; вітамін D; кальцій; мікроелементи; мікроелементи в слині
young children; vitamin D; calcium; macronutrients; trace elements in saliva
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Абатуров О.Є., Кривуша О.Л., Бабич В.Л. Вплив вітаміну D та кальцію на якість життя дітей раннього віку. Здоров’я дитини. 2021. № 7 (16). С. 18-24. DOI: 10.22141/2224-0551.16.7.2021.244576.
- Arora M., Weuve J., Schwartz J., Wright R.O. Association of environmental cadmium exposure with pediatric dental caries. Environ Health Perspect. 2008 Jun. 116(6). 821-5. doi: 10.1289/ehp.10947. PMID: 18560540; PMCID: PMC2430240.
- Aruna S., Meenakshi B., Rama K.V., Valarmathi S. Salivary le–vels of calcium and phosphorus in children with and without early childhood caries: A pilot study. SRM J. Res. Dent. Sci. 2020. 11. 72-5. https://www.srmjrds.in/text.asp?2020/11/2/72/289169.
- Ashley F.P. Calcium and phosphorus concentrations of dental plaque related to dental caries in 11- to 14-year-old male subjects. Caries Res. 1975. 9(5). 351-62. doi: 10.1159/000260168. PMID: 1055638.
- Astasov-Frauenhoffer M., Varenganayil M.M., Decho A.W., Waltimo T., Braissant O. Exopolysaccharides regulate calcium flow in cariogenic biofilms. PLoS One. 2017 Oct 12. 12(10). e0186256. doi: 10.1371/journal.pone.0186256. PMID: 29023506; PMCID: PMC5638444.
- Aziz N.Z., Arathi K., Prasad B.G., Desai D., Shetty S.J., Shahid M. Evaluation of magnesium levels in blood and saliva of oral squamous cell carcinoma and potentially malignant disorders by xylidyl blue method. J. Oral Maxillofac Pathol. 2018 Jan-Apr. 22(1). 147. doi: 10.4103/jomfp.JOMFP_34_17. PMID: 29731579; PMCID: PMC5917530.
- Baima G., Iaderosa G., Corana M., Romano F., Citterio F., Giacomino A., Berta G.N., Aimetti M. Macro and trace elements signature of periodontitis in saliva: A systematic review with quality assessment of ionomics studies. J. Periodontal Res. 2022 Jan. 57(1). 30-40. doi: 10.1111/jre.12956. Epub 2021 Nov 27. PMID: 34837226; PMCID: PMC9298699.
- Das T., Sehar S., Koop L., Wong Y.K., Ahmed S., Siddiqui K.S., Manefield M. Influence of calcium in extracellular DNA mediated bacterial aggregation and biofilm formation. PLoS One. 2014 Mar 20. 9(3). e91935. doi: 10.1371/journal.pone.0091935. PMID: 24651318; PMCID: PMC3961253.
- Dhanalakshmi Ravikumar, Pratibha Ramani, R. Gayathri. Estimation of Salivary Calcium and Phosphorus in Children with different caries status — A Cross-Sectional observational study. European Journal of Molecular & Clinical Medicine. 2021. 6(1). 50-58.
- Gracia-Marco L. Calcium, Vitamin D, and Health. Nutrients. 2020 Feb 6. 12(2). 416. doi: 10.3390/nu12020416. PMID: 32041090; PMCID: PMC7071205.
- Inonu E., Hakki S.S., Kayis S.A., Nielsen F.H. The Association Between Some Macro and Trace Elements in Saliva and Periodontal Status. Biol. Trace Elem. Res. 2020 Sep. 197(1). 35-42. doi: 10.1007/s12011-019-01977-z. Epub 2019 Dec 17. PMID: 31848920.
- Jakubovics N.S., Goodman S.D., Mashburn-Warren L., Stafford G.P., Cieplik F. The dental plaque biofilm matrix. Periodontol 2000. 2021 Jun. 86(1). 32-56. doi: 10.1111/prd.12361. Epub 2021 Mar 10. PMID: 33690911; PMCID: PMC9413593.
- Keren-Paz A., Kolodkin-Gal I. A brick in the wall: Discovering a novel mineral component of the biofilm extracellular matrix. N. Biotechnol. 2020 May 25. 56. 9-15. doi: 10.1016/j.nbt.2019.11.002. Epub 2019 Nov 6. PMID: 31706043.
- Lin H.S., Lin J.R., Hu S.W., Kuo H.C., Yang Y.H. Association of dietary calcium, phosphorus, and magnesium intake with caries status among schoolchildren. Kaohsiung J. Med. Sci. 2014 Apr. 30(4). 206-12. doi: 10.1016/j.kjms.2013.12.002. Epub 2014 Jan 6. PMID: 24656162.
- Ma Y., Ran D., Shi X., Zhao H., Liu Z. Cadmium toxicity: A role in bone cell function and teeth development. Sci. Total Environ. 2021 May 15. 769. 144646. doi: 10.1016/j.scitotenv.2020.144646. Epub 2021 Jan 18. PMID: 33485206.
- Marín Martínez L., Molino Pagán D., López Jornet P. Trace Elements in Saliva as Markers of Type 2 Diabetes Mellitus. Biol. Trace Elem. Res. 2018 Dec. 186(2). 354-360. doi: 10.1007/s12011-018-1326-x. Epub 2018 Apr 9. PMID: 29629481.
- Ninkov M., Popov Aleksandrov A., Demenesku J., Mirkov I., Mileusnic D., Petrovic A., Grigorov I., Zolotarevski L., Tolinacki M., Kataranovski D., Brceski I., Kataranovski M. Toxicity of oral cadmium intake: Impact on gut immunity. Toxicol. Lett. 2015 Sep 2. 237(2). 89-99. doi: 10.1016/j.toxlet.2015.06.002. Epub 2015 Jun 5. PMID: 26051590.
- Padoin S., de Freitas V.H., Cleto D.A.M., Zeffa A.C., Nakamura F.Y., Andrello A.C., de Paula Ramos S. Effects of Futsal Demands on Serum and Salivary Levels of Trace Elements and Minerals Detected by Total Reflection X-Ray Fluorescence. Biol. Trace Elem. Res. 2020 Jan. 193(1). 73-80. doi: 10.1007/s12011-019-01697-4. Epub 2019 Mar 28. PMID: 30924068.
- Poletto A.C., Singi P., Barri R.M., Casanova A.A., Garbelini C.C.D., Silva C.C.D., Venancio E.J. Relationship of levels of trace elements in saliva and dental caries in preschool children using total reflection X-ray fluorescence technique (TXRF). J. Trace Elem. Med. Biol. 2021 Jan. 63. 126663. doi: 10.1016/j.jtemb.2020.126663. Epub 2020 Oct 3. PMID: 33069944.
- Ravishankar T.L., Yadav V., Tangade P.S., Tirth A., Chaitra T.R. Effect of consuming different dairy products on calcium, phosphorus and pH levels of human dental plaque: a comparative study. Eur. Arch. Paediatr. Dent. 2012 Jun. 13(3). 144-8. doi: 10.1007/BF03262861. PMID: 22652212.
- Romano F., Iaderosa G., Corana M., Perotto S., Baima G., Di Scipio F., Abbadessa G., Mariani G.M., Aimetti M., Berta G.N. Comparing Ionic Profile of Gingival Crevicular Fluid and Saliva as Distinctive Signature of Severe Periodontitis. Biomedicines. 2022 Mar 17. 10(3). 687. doi: 10.3390/biomedicines10030687. PMID: 35327490; PMCID: PMC8945093.
- Rosa L.K., Costa F.S., Hauagge C.M., Mobile R.Z., de Lima A.A.S., Amaral C.D.B., Machado R.C., Nogueira A.R.A., Bran–cher J.A., de Araujo M.R. Oral health, organic and inorganic saliva composition of men with Schizophrenia: Case-control study. J. Trace Elem. Med. Biol. 2021 Jul. 66. 126743. doi: 10.1016/j.jtemb.2021.126743. Epub 2021 Mar 10. PMID: 33740480.
- Ruiz Roca J., Maria L., Mi R., Asta T., Pons-Fuster E., Lopez Jornet P. Oral health status and trace elements in saliva of children and teenagers with intellectual disabilities: a preliminary study. Oral Health and Care. 2019. 4. DOI: 10.15761/OHC.1000186.
- Satir S. The relationship between oral cancer and cadmium: a review. Mol. Biol. Rep. 2022 Mar. 49(3). 2413-2419. doi: 10.1007/s11033-021-07000-w. Epub 2021 Nov 25. PMID: 34822067.
- Schroth R.J., Rabbani R., Loewen G., Moffatt M.E. Vitamin D and Dental Caries in Children. J. Dent. Res. 2016 Feb. 95(2). 173-9. doi: 10.1177/0022034515616335. Epub 2015 Nov 9. PMID: 26553883.
- Sejdini M., Meqa K., Berisha N., Çitaku E., Aliu N., Krasniqi S., Salihu S. The Effect of Ca and Mg Concentrations and Quantity and Their Correlation with Caries Intensity in School-Age Children. Int. J. Dent. 2018 May 8. 2018. 2759040. doi: 10.1155/2018/2759040. PMID: 29853893; PMCID: PMC5964478.
- Sekhri P., Sandhu M., Sachdev V., Chopra R. Estimation of Trace Elements in Mixed Saliva of Caries Free and Caries Active Children. J. Clin. Pediatr. Dent. 2018. 42(2). 135-139. doi: 10.17796/1053-4628-42.2.9. Epub 2017 Oct 31. PMID: 29087791.
- Tihtonen K., Korhonen P., Isojärvi J., Ojala R., Ashorn U., Ashorn P., Tammela O. Calcium supplementation during pregnancy and maternal and offspring bone health: a systematic review and meta-analysis. Ann. NY Acad Sci. 2022 Mar. 1509(1). 23-36. doi: 10.1111/nyas.14705. Epub 2021 Nov 15. PMID: 34780069; PMCID: PMC9298950.
- Vandal V.B., Noorani H., Shivaprakash P.K., Walikar B.N. Sa–livary lead concentration in dental caries among normal and children with cerebral palsy. J. Indian Soc. Pedod. Prev. Dent. 2018 Oct-Dec. 36(4). 381-385. doi: 10.4103/JISPPD.JISPPD_200_16. PMID: 30324929.
- Williams T.L., Boyle J., Mittermuller B.A., Carrico C., Schroth R.J. Association between Vitamin D and Dental Caries in a Sample of Canadian and American Preschool-Aged Children. Nutrients. 2021 Dec 14. 13(12). 4465. doi: 10.3390/nu13124465. PMID: 34960016; –PMCID: PMC8706858.
- Zhang Y., Xu Y., Zheng L. Disease Ionomics: Understan–ding the Role of Ions in Complex Disease. Int. J. Mol. Sci. 2020 Nov 17. 21(22). 8646. doi: 10.3390/ijms21228646. PMID: 33212764; PMCID: PMC7697569.

/14.jpg)