Международный эндокринологический журнал Том 19, №1, 2023
Вернуться к номеру
Інгібітори пропротеїнової конвертази субтилізин/кексин типу 9: перспективи холестеринзнижувальної терапії при цукровому діабеті 2-го типу
Авторы: Сергієнко В.О., Сергієнко О.О.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
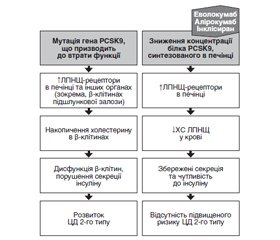
Діабетична дисліпопротеїнемія (ДЛП), що характеризується кількісними, якісними та кінетичними змінами всіх основних циркулюючих ліпідів, сприяє підвищенню ризику атеросклеротичних серцево-судинних захворювань (АССЗ) у пацієнтів із цукровим діабетом (ЦД) 2-го типу. Багатообіцяючим напрямком лікування діабетичних ДЛП є пригнічення пропротеїнової конвертази субтилізин/кексин типу 9 (PCSK9) людськими моноклональними антитілами. Існує низка препаратів, які відрізняються за механізмами пригнічення активності PCSK9. Умовно виділяють такі групи: моноклональні антитіла проти PCSK9 (анти-PCSK9 моноклональні антитіла): еволокумаб, алірокумаб, бокоцизумаб (ін’єкційні лікарські форми); інші ін’єкційні лікарські засоби з різними механізмами дії (інклісиран, SPC4061, SPC5001, adnectin BMS-962476, LIB003, анти-PCSK9 вакцина; анти-PCSK9 вакцина (на основі наночастинок)); пероральні лікарські засоби (PF-06446846, DS-9001a, SRT3025); інгібітори білка — переносника ефіру холестерину/PCSK9 (анацетрапіб, евацетрапіб, торцетрапіб, K-312). Цей огляд має на меті обговорити місце алірокумабу і еволокумабу, повністю гуманізованих моноклональних антитіл, в терапії хворих на ЦД 2-го типу з ДЛП і розглянути їх ефективність і безпеку. Стратегія пошуку. Пошук проводився в Scopus, Science Direct (від Elsevier) і PubMed, включно з базами даних Medline. Використані такі ключові слова: вегетативна нервова система, варіабельність ритму серця, чутливість барорефлексу, діабетична серцева автономна нейропатія та терміни MESH. Для виявлення результатів дослідження, які не вдалося знайти під час онлайн-пошуку, використовувався ручний пошук бібліографії публікацій. Першою лінією вибору лікування ДЛП у хворих на ЦД 2-го типу, з метою зниження ризику АССЗ, є статини. Езетиміб — наступний лікарський засіб, який слід додати, якщо рівень холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) у пацієнтів вищий за прийнятний. У випадках неефективності комбінації статинів з езетимібом інгібітор PCSK9 є доцільним і раціональним вибором. Загалом клінічні дані свідчать про те, що інгібітори PCSK9 добре переносяться та забезпечують, на додаток до високоінтенсивної терапії статинами, значне зниження рівня ХС ЛПНЩ у хворих на ЦД 2-го типу з ДЛП. Використання інгібіторів PCSK9 не супроводжується порушенням глікемічного контролю або підвищенням ризику розвитку ЦД в осіб без попередньо діагностованого ЦД, а також може запобігти подальшим серцево-судинним подіям або зменшити їх.
Diabetic dyslipoproteinemia (DLP), characterized by quantitative, qualitative, and kinetic changes in all major circulating lipids, contributes to an increased risk of atherosclerotic cardiovascular disease in patients with type 2 diabetes mellitus (DM). Inhibition of proprotein convertase subtilisin/kexin type 9 (PCSK9) by human monoclonal antibodies is a promising treatment for diabetic DLP. Several drugs differ in their mechanisms of inhibition of PCSK9 activity. The following groups are conditionally distinguished: PCSK9 monoclonal antibodies (anti-PCSK9 monoclonal antibodies): evolocumab, alirocumab, bococizumab (injectable); other injectable medications with different mechanism of actions (inclisiran, SPC4061, SPC5001, adnectin BMS-962476, LIB003, anti-PCSK9 vaccine; anti-PCSK9 vaccine (nanoparticle-based); orally administered drugs (PF-06446846, DS-9001a, SRT3025); cholesteryl ester transfer protein/PCSK9 inhibitors (anacetrapib, evacetrapib, torcetrapib, K-312). This review aims to discuss the role of alirocumab and evolocumab, fully humanized monoclonal antibodies, in the treatment of type 2 DM patients with DLP and to consider their effectiveness and safety. Strategy of search. Scopus, Science Direct (from Elsevier), and PubMed, including the Medline databases, were searched. The following keywords were used: autonomic nervous system, heart rate variability, baroreflex sensitivity, diabetic cardiac autonomic neuropathy, and MeSH terms. A manual search of the bibliography of publications was used to identify research results that could not be found with the online search. Statins are the first line of choice for treating DLP in patients with type 2 DM to reduce the risk of atherosclerotic cardiovascular disease. Ezetimibe is the next drug to be added if patients’ low-density lipoprotein cholesterol levels are higher than acceptable. In cases of failure of the combination of statins with ezetimibe, PCSK9 inhibitor is a reasonable and rational choice. Overall, clinical data suggest that PCSK9 inhibitors are well tolerated and provide a significant reduction in low-density lipoprotein cholesterol levels in type 2 DM patients with DLP in addition to high-intensity statin therapy. The use of PCSK9 inhibitors is not associated with impaired glycemic control or increased risk of diabetes development in individuals without previously diagnosed DM and may prevent or reduce subsequent cardiovascular events.
цукровий діабет; інгібітори пропротеїнової конвертази субтилізин/кексин типу 9; огляд
diabetes mellitus; proprotein convertase subtilisin/kexin type 9 inhibitors; review
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Bardolia C., Amin N.S., Turgeon J. Emerging Non-statin Treatment Options for Lowering Low-Density Lipoprotein Choleste–rol. Front. Cardiovasc. Med. 2021 Nov 17. 8. 789931. doi: 10.3389/fcvm.2021.
- Ziegler D., Porta M., Papanas N., Mota M., Jermendy G., Beltramo E., Mazzeo A. et al. The role of biofactors in diabetic microvascular complications. Curr. Diabetes Rev. 2022. 18(4). e250821195830. doi: 10.2174/1871527320666210825112240.
- Navarese E.P., Buffon A., Andreotti F., Kozinski M., Welton N., Fabiszak T., Caputo S. et al. Meta-analysis of impact of different types and doses of statins on new-onset diabetes mellitus. Am. J. Cardiol. 2013 Apr 15. 111(8). 1123-30. doi: 10.1016/j.amjcard.2012.12.037.
- Yu Q., Chen Y., Xu C.B. Statins and New-Onset Diabetes Mellitus: LDL Receptor May Provide a Key Link. Front. Pharmacol. 2017 Jun 13. 8. 372. doi: 10.3389/fphar.2017.00372.
- Serhiyenko V.A., Serhiyenko L.M., Sehin V.B., Serhiyen–ko A.A. Effect of alpha-lipoic acid on arterial stiffness parameters in type 2 diabetes mellitus patients with cardiac autonomic neuropathy. Endocr. Regul. 2021. 55(4). 224-233. doi: 1010.2478/enr-2021-0024.
- Paneni F., Costantino S. PCSK9 in diabetes: sweet, bitter or sour? Eur. Heart J. 2019 Jan 21. 40(4). 369-371. doi: 10.1093/eurheartj/ehy432.
- Handelsman Y., Lepor N.E. PCSK9 Inhibitors in Lipid Mana–gement of Patients With Diabetes Mellitus and High Cardiovascular Risk: A Review. J. Am. Heart Assoc. 2018 Jun 22. 7(13). e008953. doi: 10.1161/JAHA.118.008953.
- Serhiyenko V., Serhiyenko A. Ezetimibe and diabetes mellitus: a new strategy for lowering cholesterol. International Journal of Endocrinology (Ukraine). 2022. 18(5). 302-314. https://doi.org/10.22141/2224-0721.18.5.2022.1190.
- Stein E.A., Kasichayanula S., Turner T., Kranz T., Arumugam U., Biernat L., Lee J. et al. Antisense-mediated reduction of proprotein convertase subtilisin/kexin type 9 (PCSK9): a first-in-human randomi–zed, placebo-controlled trial. Br. J. Clin. Pharmacol. 2015 Dec. 80(6). 1350-1361. doi: 10.1111/bcp.12738.
- Tripaldi R., Lanuti P., Simeone P.G., Liani R., Bologna G., Ciotti S., Simeone P. et al. Endogenous PCSK9 may influence circula–ting CD45neg/CD34bright and CD45neg/CD34bright/CD146neg cells in patients with type 2 diabetes mellitus. Sci. Rep. 2021 May 6. 11(1). 9659. doi: 10.1038/s41598-021-88941-x.
- Dijk W., Cariou B. Efficacy and safety of proprotein convertase subtilisin/kexin 9 inhibitors in people with diabetes and dysli–pidaemia. Diabetes Obes. Metab. 2019 Apr. 21(Suppl 1). 39-51. doi: 10.1111/dom.13636.
- Vohnout B., Lisičanová J., Havranová A. PCSK9 inhibitors and diabetes mellitus. Vnitr Lek. 2019 Winter. 64(12). 1186-1189. PMID: 30704255.
- Arsenault B.J., Pelletier-Beaumont E., Almeras N., Tremblay A., Poirier P., Bergeron J., Despres J.P. PCSK9 levels in abdomi–nally obese men: Association with cardiometabolic risk profile and effects of a one-year lifestyle modification program. Atherosclerosis. 2014 Oct. 236(2). 321-326. doi: 10.1016/j.atherosclerosis.2014.07.010.
- Chernyshov V.A., Rudyk I.S. Correction of hypercholeste–rolemia in clinical practice: PCSK9 inhibitors as a new direction in hypolipidemic therapy. Journal Ratsionalnaya Farmakoterapiya. 2018. 4(49). 5-14. Available from: http://rpht.com.ua.
- Chaulin A.M. New groups of hypolipidemic medications based on inhibition of proprotein convertase subtilisin/kexin type 9 (PCSK9). Part I. Clin. Med. 2020. 98(11-12). 739-744. doi: 10.30629/0023-2149-2020-98-11-12-739-744.
- Marouf B.H., Iqbal Z., Mohamad J.B., Bashir B., Scho–field J., Syed A., Kilpatrick E.S. et al. Efficacy and Safety of PCSK9 Monoclonal Antibodies in Patients With Diabetes. Clin. Ther. 2022 Feb. 44(2). 331-348. doi: 10.1016/j.clinthera.2021.12.005.
- Sabatine M.S., Giugliano R.P., Keech A.C., Honarpour N., Wiviott S.D., Murphy S.A., Kuder J.F. et al.; FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N. Engl. J. Med. 2017 May 4. 376(18). 1713-1722. doi: 10.1056/NEJMoa1615664.
- Schwartz G.G., Steg P.G., Szarek M., Bhatt D.L., Bittner V.A., Diaz R., Edelberg J.M. et al.; ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N. Engl. J. Med. 2018 Nov 29. 379(22). 2097-2107. doi: 10.1056/NEJMoa1801174.
- Ray K.K., Wright R.S., Kallend D., Koenig W., Leiter L.A., Raal F.J., Bisch J.A. et al.; ORION-10 and ORION-11 Investigators. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N. Engl. J. Med. 2020 Apr 16. 382(16). 1507-1519. doi: 10.1056/NEJMoa1912387.
- Lindholm M.W., Elmén J., Fisker N., Hansen H.F., Persson R., Møller M.R., Rosenbohm C. et al. PCSK9 LNA antisense oligonucleotides induce sustained reduction of LDL cholesterol in nonhuman primates. Mol. Ther. 2012 Feb. 20(2). 376-381. doi: 10.1038/mt.2011.260.
- van Poelgeest E.P., Hodges M.R., Moerland M., Tessier Y., Levin A.A., Persson R., Lindholm M.W. et al. Antisense-mediated reduction of proprotein convertase subtilisin/kexin type 9 (PCSK9): a first-in-human randomized, placebo-controlled trial. Br. J. Clin. Pharmacol. 2015 Dec. 80(6). 1350-1361. doi: 10.1111/bcp.12738.
- Stein E.A., Kasichayanula S., Turner T., Kranz T., Aru–mugam U., Biernat L., Lee J. LDL cholesterol reduction with BMS-962476, an adnectin inhibitor of PCSK9: results of a single ascending dose study. J. Am. Coll. Cardiol. 2014 Apr. 63(Suppl 12). A1372. doi: 10.1016/S0735-1097(14)61372-3.
- Stein E., Toth P., Butcher M., Kereiakes D., Magnu P., Bays H., Zhou R. et al. Safety, tolerability and LDL-C reduction with a novel anti-PCSK9 recombinant fusion protein (LIB003): results of a randomized, double-blind, placebo-controlled, phase 2 study. Atherosclerosis. 2019. 287. e7. doi: 10.1016/j.atherosclerosis.2019.06.019.
- Kawakami R., Nozato Y., Nakagami H., Ikeda Y., Shimamura M., Yoshida S., Sun J. et al. Development of vaccine for dyslipidemia targeted to a proprotein convertase subtilisin/kexin type 9 (PCSK9) epitope in mice. PLoS One. 2018 Feb 13. 13(2). e0191895. doi: 10.1371/journal.pone.0191895.
- Momtazi-Borojeni A.A., Jaafari M.R., Badiee A., Banach M., Sahebkar A. Therapeutic effect of nanoliposomal PCSK9 vaccine in a mouse model of atherosclerosis. BMC Med. 2019 Dec 10. 17(1). 223. doi: 10.1186/s12916-019-1457-8.
- Lintner N.G., McClure K.F., Petersen D., Londregan A.T., Piotrowski D.W., Wei L., Xiao J. et al. Selective stalling of human translation through small-molecule engagement of the ribosome nascent chain. PLoS Biol. 2017 Mar 21. 15(3). e2001882. doi: 10.1371/journal.pbio.2001882.
- Masuda Y., Yamaguchi S., Suzuki C., Aburatani T., Nagano Y., Miyauchi R., Suzuki E. et al. Generation and Characterization of a Novel Small Biologic Alternative to Proprotein Convertase Subti–lisin/Kexin Type 9 (PCSK9) Antibodies, DS-9001a, Albumin Binding Domain-Fused Anticalin Protein. J. Pharmacol. Exp. Ther. 2018 May. 365(2). 368-378. doi: 10.1124/jpet.117.246652.
- Miranda M.X., van Tits L.J., Lohmann C., Arsiwala T., Winnik S., Tailleux A., Stein S. et al. The Sirt1 activator SRT3025 provides atheroprotection in Apoe-/- mice by reducing hepatic Pcsk9 secretion and enhancing Ldlr expression. Eur. Heart J. 2015 Jan 1. 36(1). 51-59. doi: 10.1093/eurheartj/ehu095.
- HPS3/TIMI55-REVEAL Collaborative Group; Writing Committee, Sammons E., Hopewell J.C., Chen F., Stevens W., Wallendszus K., Valdes-Marquez E., Dayanandan R. et al.; REVEAL Collaborative Group. Long-term safety and efficacy of anacetrapib in patients with atherosclerotic vascular disease. Eur. Heart J. 2022 Apr 6. 43(14). 1416-1424. doi: 10.1093/eurheartj/ehab863.
- Dong B., Singh A.B., Fung C., Kan K., Liu J. CETP inhibitors downregulate hepatic LDL receptor and PCSK9 expression in vitro and in vivo through a SREBP2 dependent mechanism. Atherosclerosis. 2014 Aug. 235(2). 449-462. doi: 10.1016/j.atherosclerosis.2014.05.931.
- Miyosawa K., Watanabe Y., Murakami K., Murakami T., Shibata H., Iwashita M., Yamazaki H. et al. New CETP inhibitor K-312 reduces PCSK9 expression: a potential effect on LDL cholesterol metabolism. Am. J. Physiol. Endocrinol. Metab. 2015 Jul 15. 309(2). E177-190. doi: 10.1152/ajpendo.00528.2014.
- Rosenson R.S., Hegele R.A., Fazio S., Cannon C.P. The Evolving Future of PCSK9 Inhibitors. J. Am. Coll. Cardiol. 2018 Jul 17. 72(3). 314-329. doi: 10.1016/j.jacc.2018.04.054.
- Momtazi A.A., Banach M., Pirro M., Stein E.A., Sahebkar A. PCSK9 and diabetes: is there a link? Drug Discov. Today. 2017 Jun. 22(6). 883-895. doi: 10.1016/j.drudis.2017.01.006.
- Seidah N.G., Prat A. The biology and therapeutic targeting of the proprotein convertases. Nat. Rev. Drug Discov. 2012 May. 11(5). 367-383. doi: 10.1038/nrd3699.
- Lotta L.A., Sharp S.J., Burgess S., Perry J.R.B., Stewart I.D., Willems S.M., Luan J. et al. Association Between Low-Density Lipoprotein Cholesterol-Lowering Genetic Variants and Risk of Type 2 Diabetes: A Meta-analysis. JAMA. 2016 Oct 4. 316(13). 1383-1391. doi: 10.1001/jama.2016.14568.
- Schmidt A.F., Swerdlow D.I., Holmes M.V., Patel R.S., Fairhurst-Hunter Z., Lyall D.M., Hartwig F.P. et al.; UCLEB consortium, Sattar N. PCSK9 genetic variants and risk of type 2 diabetes: a mendelian randomisation study. Lancet Diabetes Endocrinol. 2017 Feb. 5(2). 97-105. doi: 10.1016/S2213-8587(16)30396-5.
- Da Dalt L., Ruscica M., Bonacina F., Balzarotti G., Dhyani A., Di Cairano E., Baragetti A. et al. PCSK9 deficiency reduces insulin secretion and promotes glucose intolerance: the role of the low-density lipoprotein receptor. Eur. Heart J. 2019 Jan 21. 40(4). 357-368. doi: 10.1093/eurheartj/ehy357.
- Higuchi S., Izquierdo M.C., Haeusler R.A. Unexplained reciprocal regulation of diabetes and lipoproteins. Curr. Opin. Lipidol. 2018 Jun. 29(3). 186-193. doi: 10.1097/MOL.0000000000000521.
- Bonnefond A., Yengo L., Le May C., Fumeron F., Marre M., Balkau B., Charpentier G. et al.; DESIR study group. The loss-of-function PCSK9 p.R46L genetic variant does not alter glucose homeostasis. Diabetologia. 2015 Sep. 58(9). 2051-2055. doi: 10.1007/s00125-015-3659-8.
- Sattar N., Preiss D., Robinson J.G., Djedjos C.S., Elliott M., Somaratne R., Wasserman S.M. et al. Lipid-lowering efficacy of the PCSK9 inhibitor evolocumab (AMG 145) in patients with type 2 diabetes: a meta-analysis of individual patient data. Lancet Diabetes Endocrinol. 2016 May. 4(5). 403-410. doi: 10.1016/S2213-8587(16)00003-6.
- Karatasakis A., Danek B.A., Karacsonyi J., Rangan B.V., Roesle M.K., Knickelbine T., Miedema M.D. Effect of PCSK9 Inhibitors on Clinical Outcomes in Patients With Hypercholesterolemia: A Meta-Analysis of 35 Randomized Controlled Trials. J. Am. Heart Assoc. 2017 Dec 9. 6(12). e006910. doi: 10.1161/JAHA.117.006910.
- Colhoun H.M., Ginsberg H.N., Robinson J.G., Leiter L.A., Müller-Wieland D., Henry R.R., Cariou B. et al. No effect of PCSK9 inhibitor alirocumab on the incidence of diabetes in a pooled analysis from 10 ODYSSEY Phase 3 studies. Eur. Heart J. 2016 Oct 14. 37(39). 2981-2989. doi: 10.1093/eurheartj/ehw292.
- de Carvalho L.S.F., Campos A.M., Sposito A.C. Proprotein Convertase Subtilisin/Kexin Type 9 (PCSK9) Inhibitors and Incident Type 2 Diabetes: A Systematic Review and Meta-analysis With Over 96,000 Patient-Years. Diabetes Care. 2018 Feb. 41(2). 364-367. doi: 10.2337/dc17-1464.
- Sattar N., Toth P.P., Blom D.J., Koren M.J., Soran H., Uhart M., Elliott M. et al. Effect of the Proprotein Convertase Subti–lisin/Kexin Type 9 Inhibitor Evolocumab on Glycemia, Body Weight, and New-Onset Diabetes Mellitus. Am. J. Cardiol. 2017 Nov 1. 120(9). 1521-1527. doi: 10.1016/j.amjcard.2017.07.047.
- Cao Y.X., Liu H.H., Dong Q.T., Li S., Li J.J. Effect of proprotein convertase subtilisin/kexin type 9 (PCSK9) monoclonal antibodies on new-onset diabetes mellitus and glucose metabolism: A systematic review and meta-analysis. Diabetes Obes. Metab. 2018 Jun. 20(6). 1391-1398. doi: 10.1111/dom.13235.
- Guedeney P., Giustino G., Sorrentino S., Claessen B.E., Ca–maj A., Kalkman D.N., Vogel B. et al. Efficacy and safety of alirocumab and evolocumab: a systematic review and meta-analysis of randomized controlled trials. Eur. Heart J. 2019 Jul. 3. ehz430. doi: 10.1093/eurheartj/ehz430.
- Khan S.U., Rahman H., Okunrintemi V., Riaz H., Khan M.S., Sattur S., Kaluski E. et al. Association of Lowering Low-Density Lipoprotein Cholesterol with Contemporary Lipid-Lowe–ring Therapies and Risk of Diabetes Mellitus: A Systematic Review and Meta-Analysis. J. Am. Heart Assoc. 2019 Apr 2. 8(7). e011581. doi: 10.1161/JAHA.118.011581.
- Monami M., Sesti G., Mannucci E. PCSK9 inhibitor therapy: A systematic review and meta-analysis of metabolic and cardiovascular outcomes in patients with diabetes. Diabetes Obes. Metab. 2019 Apr. 21(4). 903-908. doi: 10.1111/dom.13599.
- Chen Q., Wu G., Li C., Qin X., Liu R., Zhang M. Safety of Proprotein Convertase Subtilisin/Kexin Type 9 Monoclonal Antibodies in Regard to Diabetes Mellitus: A Systematic Review and Meta-ana–lysis of Randomized Controlled Trials. Am. J. Cardiovasc. Drugs. 2020 Aug. 20(4). 343-353. doi: 10.1007/s40256-019-00386-w.
- Chiu S.W., Pratt C.M., Feinn R., Chatterjee S. Proprotein Convertase Subtilisin/Kexin Type 9 Inhibitors and Ezetimibe on Risk of New-Onset Diabetes: A Systematic Review and Meta-Analysis of Large, Double-Blinded Randomized Controlled Trials. J. Cardiovasc. Pharmacol. Ther. 2020 Sep. 25(5). 409-417. doi: 10.1177/1074248420924983.
- Ridker P.M., Revkin J., Amarenco P., Brunell R., Curto M., Civeira F., Flather M. et al.; SPIRE Cardiovascular Outcome Investigators. Cardiovascular Efficacy and Safety of Bococizumab in High-Risk Patients. N. Engl. J. Med. 2017 Apr 20. 376(16). 1527-1539. doi: 10.1056/NEJMoa1701488.
- Ray K.K., Del Prato S., Müller-Wieland D., Cariou B., Colhoun H.M., Tinahones F.J., Domenger C. et al. Alirocumab therapy in individuals with type 2 diabetes mellitus and atherosclerotic cardiovascular disease: analysis of the ODYSSEY DM-DYSLIPIDEMIA and DM-INSULIN studies. Cardiovasc. Diabetol. 2019 Nov 9. 18(1). 149. doi: 10.1186/s12933-019-0951-9.
- Blom D.J., Koren M.J., Roth E., Monsalvo M.L., Djedjos C.S., Nelson P., Elliott M. et al. Evaluation of the efficacy, safety and glycaemic effects of evolocumab (AMG 145) in hypercholesterolaemic patients stratified by glycaemic status and metabolic syndrome. Diabetes Obes. Metab. 2017 Jan. 19(1). 98-107. doi: 10.1111/dom.12788.
- Iqbal Z., Dhage S., Mohamad J.B., Abdel-Razik A., Donn R., Malik R., Ho J.H. et al. Efficacy and safety of PCSK9 monoclonal antibodies. Expert Opin. Drug Saf. 2019 Dec. 18(12). 1191-1201. doi: 10.1080/14740338.2019.1681395.
- Ference B.A., Robinson J.G., Brook R.D., Catapano A.L., Chapman M.J., Neff D.R., Voros S. et al. Variation in PCSK9 and HMGCR and Risk of Cardiovascular Disease and Diabetes. N. Engl. J. Med. 2016 Dec 1. 375(22). 2144-2153. doi: 10.1056/NEJMoa1604304.
- Besseling J., Kastelein J.J., Defesche J.C., Hutten B.A., Hovingh G.K. Association between familial hypercholesterolemia and prevalence of type 2 diabetes mellitus. JAMA. 2015 Mar 10. 313(10). 1029-1036. doi: 10.1001/jama.2015.1206.
- Andreadou I., Tsoumani M., Vilahur G., Ikonomidis I., Badimon L., Varga Z.V., Ferdinandy P. et al. PCSK9 in Myocardial Infarction and Cardioprotection: Importance of Lipid Metabolism and Inflammation. Front Physiol. 2020 Nov 12. 11. 602497. doi: 10.3389/fphys.2020.602497.
- Pearson G.J., Thanassoulis G., Anderson T.J., Barry A.R., Couture P., Dayan N., Francis G.A. et al. 2021 Canadian Cardiovascular Society Guidelines for the Management of Dyslipidemia for the Prevention of Cardiovascular Disease in Adults. Can. J. Cardiol. 2021 Aug. 37(8). 1129-1150. doi: 10.1016/j.cjca.2021.03.016.
- American Diabetes Association Professional Practice Committee. 10. Cardiovascular Disease and Risk Management: Standards of Medical Care in Diabetes-2022. Diabetes Care. 2022 Jan 1. 45(Suppl 1). S144-S174. doi: 10.2337/dc22-S010.
- Cicero A.F., Tartagni E., Ertek S. Safety and tolerability of injectable lipid-lowering drugs: a review of available clinical data. Expert Opin. Drug Saf. 2014 Aug. 13(8). 1023-1030. doi: 10.1517/14740338.2014.932348.