Вступ
Остеомаляція (ОМ) — це системний патологічний процес, що характеризується зниженням міцності кісткової тканини (КТ) в результаті надмірного накопичення немінералізованого остеоїду і невідповідністю між утворенням кісткового матриксу та його мінералізацією. Найбільш часто остеомаляція у дорослих розвивається внаслідок вираженого дефіциту вітаміну D будь-якої етіології. У клінічній практиці втрату кісткової маси пов’язують з розвитком остеопорозу (ОП). Однак ОМ також є причиною зниження мінеральної щільності кісткової тканини (МЩКТ), що супроводжується зростанням ризику переломів із розвитком процесу [1–3]. У дорослих людей цей процес часто перебігає безсимптомно [3, 4], як і ОП, і представляє собою до виникнення перелому «безмовну» хворобу. При цьому, незважаючи на подібний клінічний результат (переломи), морфоструктурні, етіологічні та патогенетичні характеристики ОП і ОМ якісно відрізняються [4–6], і схеми лікування при даних станах будуть різними.
Метод рентгенівської денситометрії (ДЕРА) не дозволяє диференціювати причини зниження МЩКТ (ОП і ОМ) [7, 8]. ДЕРА забезпечує тільки діагностику зниження кісткової маси до заданих у програмному забезпеченні приладу значень, що відповідають ОП або остеопенії, незалежно від патологічного процесу, який викликав це зниження [9], тобто ОП діагностують і в пацієнтів зі зниженням кісткової маси, викликаним ОМ [10]. ДЕРА, по суті, є не діагностичним, а прогностичним методом дослідження, що дозволяє оцінити тільки ступінь ризику перелому [11]. Для виключення діагностичної помилки перед призначенням лікування пацієнту необхідно провести диференціально-діагностичні заходи, що визначають причину зниження МЩКТ. Біопсія, необхідна для діагностики ОМ, є інвазивною маніпуляцією, тому актуальна розробка чітких критеріїв, що визначають необхідність її виконання, або прогнозування значення морфологічного показника через інші — найбільш прості та доступні — лабораторні показники або показники за даними рентгенографії чи іншого обстеження.
Мета роботи: неінвазивна діагностика остеомаляції — можливість спрогнозувати значення морфологічного показника при остеомаляції через доступні лабораторні показники, за даними рентгенівської денситометрії та обстеження на апараті «Insight».
Матеріали та методи
Під нашим спостереженням знаходились 65 жінок у постменопаузі (ПМ), середній вік яких становив 62,30 ± 2,74 року, яким провели морфологічне дослідження КТ під час ендопротезування з приводу перелому шийки стегнової кістки. Із них 55 пацієнток, які працювали в несприятливих виробничих умовах, мали зниження МЩКТ (ОП — у 31 жінки, ОМ — у 24), 10 жінок не мали метаболічних розладів КТ.
Фрагмент КТ забирали під час оперативного втручання. Готували недекальциновані зрізи КТ. Досліджували гістоморфометричні параметри утворення кістки. Функціональну активність ядер клітин КТ визначали за допомогою методу диференціального забарвлення ядер з різною функціональною активністю [12]. У кожному випадку досліджували по 100 клітин КТ. Постійні гістологічні препарати досліджували за допомогою методу світлової мікроскопії із застосуванням світлового мікроскопу «CarlZeiss», морфометричні дослідження проводили із застосуванням ліцензійного програмного забезпечення «ВидеоТесТ-Мастер (Морфология)» (ООО «ВидеоТест»).
Проведена рентгенівська денситометрія (остеоденситометр Hologic Discovery (США)). Функціональну оцінку стану кістково-м’язової системи проводили за допомогою апарата «InsightTM». Оцінювали показники електроміографії (електроміографічна активність м’язів), альгометрії (больова чутливість), термографії (температура м’язів), інклінометрії (гнучкість хребта) і варіабельності серцевого ритму (адаптація до фізичних навантажень (WPW)).
Рівень вітаміну D (25(ОН)D) у сироватці крові вивчали за допомогою імуноферментного методу на аналізаторі EUROIMMUN (Німеччина), маркер резорбції КТ С-термінальний телопептид колагену 1-го типу (СТх) — імунохемілюмінесцентним методом на аналізаторі Cobas 6000 (Roche Diagnostics, Швейцарія), рівень остеопротегерину (ОПГ) визначали методом імуноферментного аналізу на апараті «Axsym System» (Abbot, Німеччина).
Статистичну обробку отриманих результатів проводили за допомогою прикладних програм Microsoft Office Excel і Statistica 10.0. Для математичної обробки використовували методи первинної описової статистики: середнє значення показника, стандартне відхилення, стандартну помилку, t-критерій Стьюдента.
Особливий інтерес у нашому дослідженні викликає можливість спрогнозувати значення морфологічного показника «висока функціональна активність клітин КТ» (ВФА) через інші — найбільш прості та доступні — лабораторні показники (25(ОН)D, СТх, ОПГ), за даними рентгенографії (BMD), обстеження на апараті «InsightTM» (альгометрія й інклінометрія).
Попередньо було побудовано низку моделей множинної регресії виду (1) для моделювання значення показника ВФА та встановлено, що найкращими є ті моделі, в яких α0 = 0, тобто залежність значення ВФА розподіляється виключно на відібрані показники 25(ОН)D, СТх, ОПГ, BMD, альгометрії та інклінометрії. Математична модель для такого розрахунку має вид лінійної множинної регресії, за допомогою таких моделей можна враховувати вплив декількох факторів на показник, що моделюється. Рівняння лінійної множинної регресії будується за формулою:
у = α0 + α1х1 + α2х2 + α3х3 + … + αnхn, (1)
де у — показник, що моделюється, α0, α1, α2, α3, … αn — коефіцієнти рівняння лінійної множинної регресії, х1, х2, х3, … хn — фактори, які впливають на значення показника, що моделюється.
Як показник адекватності регресійної моделі використовується коефіцієнт детермінації R2 (R-квадрат) Коефіцієнт детермінації приймає значення від 0 до 1. Чим ближче значення R2 по модулю до 1, тим краще регресійна модель апроксимує емпіричні дані. Модель вважається вірогідною, коли значення R2 більше або дорівнює 0,5. Моделі, в яких значення R2 менше 0,5, не використовуються, оскільки вони слабо відображають модельований процес.
Результати та обговорення
Показник BMD neck був знижений (р < 0,05) у групах дослідження порівняно з контрольною групою. Причому BMD neck, Т-критерій neck і Z-критерій neck були зниженими (р < 0,05) у групі пацієнток з ОМ порівняно з групою ОП (рис. 1).
Рівень 25(ОН)D був знижений (р < 0,05) і у групі жінок з ОП і ОМ порівняно з контрольною групою. Звертає на себе увагу більше зниження (р < 0,05) 25(ОН)D, фосфора, ОПГ і більше підвищення (р < 0,05) показника СТх у групі пацієнток з ОМ порівняно з групою ОП (рис. 2, 3).
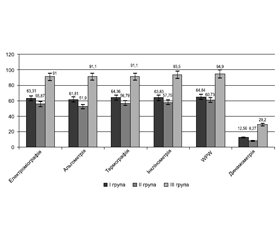
Функціональні показники стану кістково-м’язової системи — електроміографія, альгометрія, термографія, інклінометрія та варіабельність серцевого ритму (адаптація до фізичних навантажень) у групах пацієнток з ОП і ОМ — були значуще зниженими (р < 0,05) порівняно з показниками жінок контрольної групи, а також у порівнянні між групами нижчими (р < 0,05) в пацієнток з ОМ (рис. 4).
Морфологічні зміни при ОП і ОМ мають спільні ознаки і відмінності. Спільним є витончення кісткових балок, розширення каналів остеонів, наявність безклітинних ділянок і безклітинних лакун. На відміну від ОП при ОМ збільшується товщина і площа остеоїду, зменшення оксифілії матриксу є менш вираженим, спостерігається більш висока (р < 0,05) функціональна активність клітин КТ (ВФА) (рис. 5).
Таким чином, у ПМ жінок з ОМ порівняно з ПМ жінками з ОП виявлені значуще вищі (р < 0,05) зміни структурно-функціонального стану КТ, біохімічних маркерів резорбції, а також більш низький (р < 0,05) рівень вмісту 25(ОН)D і ОПГ. Функціональні показники стану кістково-м’язової системи у порівнянні між групами нижчі (р < 0,05) у пацієнток з ОМ. На відміну від ОП при ОМ збільшується товщина і площа остеоїду, зменшення оксифілії матриксу є менш вираженим, спостерігається більш висока (р < 0,05) функціональна активність ядер клітин КТ.
У табл. 1 подані коефіцієнти моделей множинної регресії, побудованих на чинниках, що впливають на значення показника ВФА. Усі моделі є адекватними та якісними за значенням коефіцієнта детермінації R². Значення коефіцієнтів моделі α1, α2, …, α6 вказують на впливовість чинника в моделі.
Модель 1 (R2 = 0,9926) можна записати формулою:
ВФА = –0,4 × 25(ОН)D + 12,38 × СТх + 6,25 × ОПГ + + 11,02 × BMD + 0,149 × альго- + 0,16 × інкліно-.
Модель 1 можна спростити, виключаючи з неї чинник з найменшим коефіцієнтом. Значення α5 та α6 є найменшими та близькими між собою, тому виключимо з моделі чинники альго- та інкліно- та отримаємо модель 2:
(R2 = 0,9892): ВФА = 0,057 × 25(ОН)D + 18,46 × СТх + 10,2 × ОПГ + 15,05 × BMD.
Тепер ми бачимо, що в моделі 2 найменш впливовим є чинник 25(ОН)D, тобто його можна виключити з неї. Отримаємо модель 3 (R2 = 0,9891), яка за значенням R2 майже не відрізняється від моделі 2:
ВФА = 17,9 × СТх + 10,5 × ОПГ + 16,5 × BMD.
Далі можна було б чинити аналогічно, виключаючи з моделі 3 послідовно ОПГ та з моделі 4 СТх, але різниця між коефіцієнтами в моделі 3 є незначною, тому робити таке виключення недоцільно. Отже, для моделювання значення показника ВФА клітин КТ залишимо моделі 1–3.
Таким чином, як видно з наведеного графіку (рис. 6), побудовані моделі 1, 2 та 3 максимально відтворюють первинні показники високої функціональної активності клітин КТ та можуть бути рекомендовані для практичного застосування.
Висновки
Створена математична модель, що дозволяє прогнозувати значення морфологічного показника «висока функціональна активність ядер клітин КТ» при остеомаляції та остеопорозі через інші — найбільш прості та доступні — лабораторні показники (25(ОН)D, СТх, ОПГ), за даними рентгенівської денситометрії та обстеження на апараті «InsightТМ» (альгометрія та інклінометрія).
Отримано/Received 10.01.2022
Рецензовано/Revised 19.01.2022
Прийнято до друку/Accepted 25.01.2022
Список литературы
1. Anumula S., Magland J., Wehrlib S.L., Ong H., Song H.K., Wehrli F.W. Multi-modality study of the compositional and mechanical implications of hypominerali-zation in a rabbit model of osteomalacia. Bone. 2008. (2). 405-413.
2. Ascenzi M.-G., Hetzer N., Lomovtsev A., Rude R., Nattiv A., Favia A. Variation of trabecular architecture in proximal femur of postmenopausal women. J. Biomechanics. 2011. 44(2). 248-256.
3. Arya V., Jain V. Osteomalacia – what the rheumatologist needs to know. Indian J. Rheumatology. 2007. 2(1). 17-22.
4. Аврунин А.С. Оcтеопороз и остеомаляция — клинико-диагностические проблемы. Травматология России. 2014. № 4. С. 67-76.
5. Boivin G., Bala Y., Doublier A., Farlay D., Ste-Marie L.G., Meunier P.J., Delmas P.D. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 2008. (3). 532-538.
6. Demay M.B., Krane S.M. Disorders of calcification: osteomalacia and rickets. Endocrinology: adult and pediatric. Saunders. 2010. 70. 1311-1329.
7. Bhan A., Rao A.D., Rao D.S. Osteomalacia as a Result of Vitamin D Deficiency. Endocrinol. Metab. Clin. N. Am. 2010. 39. 321-331.
8. Russell L.A. Osteoporosis and Osteomalacia. Rheum. Dis. Clin. North Am. 2010. 36(4). 665-680.
9. Lewiecki E.M., Bilezikian J.P., Cooper C., Hochberg M.C., Luckey M.M., Maricic M., Miller P.D. Proceedings of the Eighth Annual Santa Fe Bone Symposium. August 3–4, 2007. J. Clinical Densitometry: Assessment of Skeletal Health. 2008. (2). 313-324.
10. Kanis J.A., McCloskey E.V., Johansson H., Oden A., Melton III L.J., Khaltaev N. A reference standard for the description of osteoporosis. Bone. 2008. (3). 467-475.
11. Siminoski K., Leslie W.D., Frame H., Hodsman A., Josse R.G., Khan A., Lentle B.C., Lévesque J., Lyons D.J., Tarulli G., Brown J.P. Recommendations for Bone Mineral Density Reporting in Canada. JACR. 2005. 56(3). 178-188.
12. Пикалюк В.С., Кутя С.А., Шадуро Д.В. Модификация методики гистологического исследования костной ткани. Морфологія. 2010. № 3. С. 72-76. Режим доступу до журналу: http://www.morphology.dp.ua/_pub/MORPHO-2010-04-03/10pvsikt.pdf
/32.jpg)

/31.jpg)
/32_3.jpg)
/33.jpg)
/33_2.jpg)
/34.jpg)
/34_2.jpg)