Вступ
Рак молочної залози (РМЗ) — найпоширеніше онкологічне захворювання і основна причина смерті від злоякісних пухлин серед жіночого населення у всьому світі. У 2020 році рак молочної залози став провідною причиною глобальної онкологічної захворюваності серед жіночого населення. Усього у світі в 2020 році зареєстровано 2 246 419 нових випадків РМЗ, що становить 11,7 % всіх зареєстрованих випадків злоякісних пухлин. Смертність від РМЗ становила 684 996 (6,9 %) випадків у 2020 році та займає п’яте місце серед причин смертності від рака у всьому світі [1]. Незважаючи на сучасний міждисциплінарний та індивідуалізований підхід до лікування даної патології, успіхи у хірургічному та терапевтичному лікуванні, проблема смертності від РМЗ залишається актуальною і сьогодні. Особливо гостро постає питання щодо ефективності лікування тричі негативного раку молочної залози (ТНРМЗ), загальна виживаність за якого є значно нижчою порівняно із іншими молекулярними підтипами навіть після врахування різних факторів, таких як: вік, раса, індекс маси тіла, стадія, застосування хіміотерапії, розмір пухлини, її гістологічна градація та статус лімфатичних вузлів [2].
ТНРМЗ — це молекулярний підтип пухлин, що характеризується відсутністю експресії рецепторів до естрогенів, рецепторів до прогестерону та рецептора 2 епідермального фактора росту людини (HER2). Частота виявлення даного підтипу раку молочної залози становить від 10 до 20 %, зустрічається переважно серед жінок молодого віку та представників афроамериканської раси [3–6]. Відсутність терапевтичних мішеней ТНРМЗ значно обмежує можливості лікувального впливу та супроводжується вищою частотою виникнення місцевого рецидиву та віддалених метастазів, а отже, і гіршим прогнозом перебігу порівняно із іншими молекулярними підтипами РМЗ [7, 8]. Варто зазначити, що ТНРМЗ — це гетерогенне захворювання, оскільки численні дослідження показують генетичну варіабельність у межах даного підвиду. Згідно з дослідженням Lehmann та співавт. (2011), ТНРМЗ має 7 можливих варіантів: базальноподібний 1, 2 (BL1, BL2), мезенхімальний (М), мезенхімальний стовбуровоподібний (MSL), імуномодулюючий (ІМ), люмінальний з експресією андрогенових рецепторів (LAR) та нестабільний варіант (UNS), кожен з яких супроводжується особливими біологічними та клініко-патологічними характеристиками [9].
Оскільки терапевтичні можливості системного впливу ТНРМЗ обмежуються лише хіміотерапією, необхідно оптимізувати місцеве лікування з метою запобігання виникненню локорегіонарного рецидиву (ЛРР) та зниження ризику появи віддалених метастазів [10, 11]. Хірургічне втручання є основним методом, який забезпечує локорегіонарний контроль РМЗ. Проте в низці випадків тільки хірургічне лікування не забезпечує необхідного локорегіонарного контролю захворювання, що потребує призначення ад’ювантної променевої терапії з метою зменшення частоти розвитку ЛРР, а отже, і показників загальної і безрецидивної виживаності хворих [12–14]. Однак питання її застосування у випадку двох хірургічних альтернатив РМЗ (органозберігаюча операція (ОЗО) чи мастектомія) є не до кінця з’ясованим. Згідно з рекомендаціями The National Comprehensive Cancer Network (NCCN), усім пацієнтам, яким виконано органозберігаючу операцію з приводу РМЗ, незалежно від статусу лімфатичних вузлів, рекомендовано проведення післяопераційного курсу променевої терапії (ПТ) з різницею щодо поля опромінення та сумарної вогнищевої дози [15]. Що стосується пацієнтів, яким була виконана радикальна мастектомія (РМЕ), однозначності щодо доцільності застосування ПТ серед наявних наукових робіт немає. Питання, чи повинні пацієнти після РМЕ з наявністю метастазів в 1–3 лімфатичних вузлах отримувати ад’ювантну ПТ, все ще залишається спірним через наявність доказів ефективності останньої у забезпеченні локорегіонарного контролю у хворих з ранніми стадіями ТНРМЗ, які перенесли РМЕ [16]. Цей літературний огляд присвячений дискусії щодо вибору тактики хірургічного лікування хворих з ранніми стадіями ТНРМЗ та впливу ад’ювантної ПТ на забезпечення локорегіонарного контролю захворювання у пацієнтів, які перенесли радикальну мастектомію.
Вибір об’єму хірургічного втручання при ТНРМЗ
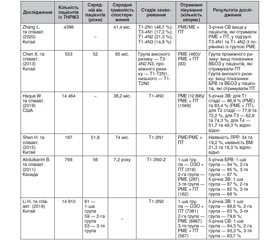
Значення молекулярного підтипу РМЗ у виборі тактики хірургічного лікування хворих є предметом наукових дискусій останніх років. Оскільки відсутні чітко окреслені положення щодо вибору об’єму хірургічного втручання у хворих на різні молекулярні підтипи РМЗ, а тактика підпорядковується загальним рекомендаціям щодо інвазивного РМЗ, питання оптимальної тактики локорегіонарної терапії ТНРМЗ залишається відкритим. Враховуючи більш агресивний перебіг даного молекулярного підтипу, частина лікарів робить вибір на користь РМЕ, однак чи виправдовує себе даний підхід і чи забезпечує він кращий локорегіонарний контроль, на сьогодні остаточно не з’ясовано [10, 17, 18]. Результати сучасних досліджень вказують на кращі показники виживаності у пацієнтів із T1-2N0 стадією РМЗ, яким була виконана ОЗО, порівняно із РМЕ. Це дозволяє стверджувати, що даний об’єм хірургічного втручання є стандартом для хворих з ранніми стадіями РМЗ, оскільки супроводжується меншою інвалідизацією, має оптимальні косметичні результати та може бути пріоритетним вибором для пацієнтів [19]. Однак існує низка досліджень, які підтверджують, що зв’язку між об’ємом хірургічного втручання та прогнозом перебігу захворювання не існує. У ретроспективному одноцентровому когортному дослідженні G. De la Cruz Ku та співавт. (2019) порівнювали загальну виживаність (ЗВ) та виживаність без ознак захворювання (ВБОЗ) у хворих на І–ІІА стадію ТНРМЗ, яким виконано ОЗО або РМЕ. У дослідження було включено 288 жінок із ТНРМЗ, які проходили лікування в Національному інституті неопластичних захворювань (Instituto Nacional de Enfermedades Neoplásicas (INEN)) в Перу в період 2000–2014 рр. Із загальної когорти кількість пацієнток, які перенесли РМЕ, становила 177 випадків і 111 — ОЗО. Пацієнтки в групі ОЗО були молодші, частіше пременопаузального періоду, мали менші розміри пухлини та стадію РМЗ. Статистично значущої різниці у статусі регіонарних лімфатичних вузлів та гістологічному типі пухлини між обома групами не було виявлено. Після аналізу отриманих результатів, при медіані спостереження 102 міс., показники ЗВ становили 85 % для групи ОЗО та 81 % для групи РМЕ (р = 0,56). Виживаність без ознак прогресування становила 83 % у хворих після ОЗО та 80 % у групі РМЕ (р = 0,42). При проведенні багатофакторного аналізу Кокса встановлено, що виконання ОЗО у хворих на ТНРМЗ знижує ризик смерті (HR: 0,79; 95% CI: 0,37–1,67; p = 0,538), а також ризик локального рецидиву та віддалених метастазів (HR: 0,67; 95% CI: 0,32–1,41; p = 0,294), хоча без статистичної значущості. За результатами дослідження авторами було зроблено висновки, що ОЗО є оптимальним об’ємом хірургічного втручання та безпечною альтернативою РМЕ у хворих з ранньою стадією ТНРМЗ [20].
Група дослідників із Кореї (Korean Radiation Oncology Group (KROG)) на чолі з K. Kim (2018) порівнювала результати лікування хворих з pT1-2N1 ТНРМЗ, яким проведено ОЗО в поєднанні з ПТ або РМЕ без ПТ. У дослідження включено 320 хворих на ТНРМЗ віком 24–70 років (середній вік 48 років) з двох багатоцентрових ретроспективних досліджень: KROG 14–18 та KROG 14–23. Усіх хворих розподілили на 2 групи: 1-ша група (n = 212) — хворі, яким проведено ОЗО в поєднанні з ад’ювантною ПТ, та 2-га група (n = 108) — хворі, які перенесли РМЕ без ад’ювантної ПТ. Усім пацієнтам досліджуваних груп проводили таксанвмісні режими ад’ювантної хіміотерапії. У дослідженні оцінювали показники 5-річної безрецидивної виживаності (БРВ), виживаності без ознак захворювання та загальної виживаності при медіані спостереження 65 міс. для 1-ї групи та 74 міс. для групи РМЕ. У групі РМЕ було більше хворих з мультицентричними пухлинами (р < 0,001), без лімфоваскулярної інвазії (р = 0,001), з наявністю метастазів у регіонарних лімфовузлах (р = 0,028). Статистично значущої різниці між іншими клініко-патологічними показниками у хворих досліджуваних груп не виявлено. Показники 5-річної БРВ становили для 1-ї групи 94,6 % проти 87,7 % у 2-й групі (р = 0,01), ВБОЗ — 89,5 та 80,4 % для групи ОЗО + ПТ та групи РМЕ відповідно (р = 0,006), а ЗВ — 95 та 87,7 % для 1-ї та 2-ї груп відповідно (р = 0,005). Аналіз отриманих результатів свідчить, що всі досліджувані показники виживаності були на користь пацієнтів із групи ОЗО + ПТ порівняно із пацієнтами, що отримали лише РМЕ [21].
Подібним за результатами є і дослідження F. Adkins та співавт. (2011), яке показало, що більш агресивна тактика хірургічного лікування хворих на ТНРМЗ не виправдовує себе. В аналіз було включено 1325 пацієнтів, дані яких були отримані із The Breast Cancer Management System database at the University of Texas M.D. Anderson Cancer Center у період з грудня 1980 по грудень 2007 р. Особливість даного дослідження порівняно з вищенаведеними в тому, що когорта включала пацієнтів із стадіями Т1-4N0-3 ТНРМЗ. Пацієнтів, залежно від об’єму хірургічного втручання (ОЗО/МЕ), було розділено на дві майже рівні групи. До першої групи ввійшла 651 пацієнтка (49 %) після ОЗО, а до другої групи — 671 хвора (51 %) після перенесеної РМЕ з приводу ТНРМЗ. У групі ОЗО більшість пацієнток (97 %) отримали ад’ювантну ПТ, на противагу в другій групі — усього 33 %. Крім цього, пацієнтки другої групи мали переважно ІІІ стадію РМЗ, лімфоваскулярну інвазію, більші розміри пухлини, вищу стадію рN (усі р < 0,001). Для оцінки ефективності локорегіонарної терапії в дослідженні було оцінено такі показники: БРВ, виживаність без віддалених метастазів (ВБВМ) та ЗВ при медіані спостереження 62 міс. (1–285 міс.). Загалом ЛРР виявлено у 28 % хворих з обох груп: у 26 % пацієнтів, які перенесли ОЗО, та у 30 % хворих після РМЕ (р = 0,1). Віддалені метастази виявлено у 43 % хворих обох груп — у 35 % після ОЗО та у 51 % після РМЕ (р < 0,0001). 5-річна БРВ в першій групі становила 76 % та 71 % — у другій групі (р = 0,032), 5-річна ВБВМ — 68 та 54 % для першої та другої групи відповідно (р < 0,0001), а 5-річна ЗВ — 74 % у групі ОЗО проти 63 % у групі РМЕ (р < 0,0001). Після проведення мультиваріативного статистичного аналізу отриманих результатів встановлено, що на ризик розвитку ЛРР впливає: розмір пухлини (HR: 1,37; p = 0,006), ступінь диференціювання пухлини (HR: 1,92; p = 0,002), лімфоваскулярна інвазія (HR: 1,93; р < 0,0001), статус країв резекції (HR: 1,89; р < 0,0001) та проведення ад’ювантної неантрациклінвмісної або таксанвмісної хіміотерапії (HR: 2,01; р < 0,0001), а об’єм хірургічного втручання (РМЕ проти ОЗО; HR: 1,07; 95% CI 0,86–1,34; р = 0,55) не впливає на ризик виникнення ЛРР [17].
У ретроспективному дослідженні американських вчених C. Parker та співавт. (2010) вивчали доцільність виконання ОЗО у хворих на ТНРМЗ. Для дослідження було відібрано 202 пацієнти із T1-4N0-3 ТНРМЗ, що проходили лікування в 2 медичних закладах штату Луїзіана (Feist-Weiller Cancer Center та E.A. Conway Hospital), з яких 30 % становила група ОЗО, а 70 % — РМЕ. Для порівняльної оцінки впливу об’єму хірургічного втручання оцінювали частоту ЛРР, 5-річну ВБОЗ та ЗВ хворих. У результаті аналізу були отримані такі показники: поява ізольованого місцевого рецидиву становила 0 % для групи ОЗО та 10,6 % для групи РМЕ, 5-річна ВБОЗ — 68 та 57 %, 5-річна ЗВ — 89 та 69 % у групах ОЗО та РМЕ відповідно. При подальшому аналізі було встановлено, що об’єм хірургічного втручання не є незалежним фактором, що впливає на ВБОЗ та ЗВ. У групі РМЕ хворі мали: пухлини більших розмірів (T3/T4: 4 % у групі ОЗО проти 27 % у групі РМЕ; р = 0,0002), вищу стадію рN (N2/3: 8 % у групі ОЗО проти 25 % у групі РМЕ; р = 0,0003) і, відповідно, більше випадків з ІІІ стадією захворювання (8 % у групі ОЗО проти 35 % у групі РМЕ; р < 0,0001). Автори дійшли висновку, що відмінності в показниках ВБОЗ та ЗВ пов’язані з гіршими вихідними клініко-патологічними факторами прогнозу перебігу РМЗ [22].
Робота Z. Zumsteg та співавт. (2013) показала результати лікування хворих на ТНРМЗ для визначення оптимальної тактики локорегіонарної терапії. У дослідження включено 646 жінок віком від 20 до 88 років (середній вік 54 роки), яким проводилося лікування з приводу T1-2N0 ТНРМЗ в Memorial Sloan-Kettering Cancer Center, Нью-Йорк, США. Усіх хворих розподілили на 2 групи: група ОЗО (n = 448) та група РМЕ (n = 198). Усі хворі з групи ОЗО отримали ад’ювантну ПТ, а хворим з групи РМЕ променеву терапію не проводили. Відмінною ознакою даного дослідження було те, що 177 пацієнтам проводився скринінг на наявність BRCA-мутації, яка була виявлена в 29 випадках із 198 для групи РМЕ та 16 із 448 для групи ОЗО. Виявлено, що хворі з групи РМЕ були молодші (р < 0,001), у них частіше виявлялась лімфоваскулярна інвазія (р = 0,042) та вони мали пухлини більших розмірів (р = 0,023). Було з’ясовано, що при медіані спостереження 78,3 міс. (1–156 міс.) частота ЛРР становила 4,5 % для пацієнтів групи ОЗО та 6,6 % — для групи РМЕ, однак 5-річна кумулятивна частота ЛРР не мала статистично значущих відмінностей: 4,2 та 5,4 % відповідно (HR: 1,5; 95% CI 0,75–3,01; р = 0,25). Частота виникнення віддалених метастазів в обох групах була однаковою і становила 8 %, а статистично значущої різниці у ЗВ між групами ОЗО або РМЕ для хворих з T1-2N0 ТНРМЗ немає. Дослідники дійшли висновку, що розвиток місцевого рецидиву та віддалених метастазів не залежить від об’єму хірургічного втручання, тобто за ефективністю місцевого контролю T1-2N0 ТНРМЗ ОЗО + ПТ еквівалентна РМЕ [23].
Деякою неоднорідністю характеризується дослідження R. Raghavan та співавт. (2019), проведене серед 170 жінок віком від 26 до 71 року (середній вік 48 років) з діагнозом pT1-T2N0 ТНРМЗ, що проходили лікування на базі Regional Cancer Centre, Trivandrum, Індія, у період із січня 2010 по грудень 2011 року. Залежно від об’єму хірургічного втручання хворих розподілили на 2 групи. До групи ОЗО ввійшли 49 пацієнток та 121 хвора — до групи РМЕ. Усі хворі з групи ОЗО отримали ад’ювантну ПТ. Протягом періоду спостереження 50 місяців (1–83 міс.) у жодної пацієнтки з обох груп не було виявлено ЛРР. Було встановлено, що пацієнтки, які отримали ОЗО + ПТ, мали кращі показники 5-річної ВБОЗ порівняно із пацієнтками, яким була виконана РМЕ (95,8 та 91,1 % відповідно), однак у випадку 5-річної ЗВ різниці між двома групами не виявлено (98 та 97,5 % відповідно) [24].
Результати вищенаведених досліджень систематизовані в табл. 1.
Роль післяопераційної променевої терапії у пацієнтів із ТНРМЗ, які перенесли РМЕ
Значення променевої терапії у лікуванні пацієнтів із ТНРМЗ є актуальним питанням, що досі не має остаточного вирішення та залишається контраверсійним. Доцільність її застосування у пацієнтів після мастектомії пояснюється можливим зниженням ризику розвитку ЛРР, однак частина наукових робіт вказує на відсутність такого зв’язку через імовірну радіорезистентність даного молекулярного підтипу або порівняно гірші клініко-патологічні характеристики. На особливу увагу заслуговують пацієнтки після РМЕ із стадією T1-2N0-1, для яких ПТ не є стандартом лікування, але гіпотетично може покращити результати місцевого контролю [25, 26]. Беручи до уваги вищенаведені розбіжності, даний підрозділ присвячений питанню впливу променевої терапії на прогноз перебігу ТНРМЗ та доцільності її застосування у хворих, яким була виконана РМЕ.
У популяційному ретроспективному дослідженні L. Zhang та співавт. (2020) вивчали вплив ПТ на виживаність хворих на ТНРМЗ, які перенесли РМЕ. У рамках дослідження проаналізовано дані із 18 канцер-реєстрів США з 2010 по 2014 рік та включено 4398 пацієнтів із T1-4N1-3M0 ТНРМЗ, що отримали або тільки РМЕ (n = 1749), або РМЕ + ПТ (n = 2649). За локорегіонарною поширеністю пухлини пацієнти були розподілені на 4 підгрупи: T1-2N1 (46,7 % від загальної когорти), T3-4N1 (17,2 %), T1-4N2 (21,3 %), T1-4N3 (14,8 %). У процесі аналізу було виявлено, що 3-річна специфічна виживаність вища у пацієнтів, які отримали РМЕ + ПТ, у підгрупі T3-4N1 (р = 0,042), T1-4N2 (р < 0,001) та T1-4N3 (р < 0,001) порівняно із хворими, що перенесли РМЕ. У підгрупі T1-2N1 статистично вірогідних відмінностей між проведенням ПТ та специфічною виживаністю хворих не було виявлено (р = 0,191). Дослідниками було встановлено, що наявність ПТ — це незалежний предиктор кращих показників 3-річної специфічної виживаності хворих з T3-4N1 та T1-4N2-3 ТНРМЗ [27].
X. Chen та співавт. (2013) провели оцінку необхідності та доцільності застосування ПТ після РМЕ у хворих на ТНРМЗ. У ретроспективний аналіз включено 553 жінки віком від 28 до 80 років (середній вік 52 роки), хворих на ТНРМЗ, яким була виконана РМЕ в період з 1 січня 2000 р. по 31 липня 2007 р. Згідно зі стадією пацієнти були розподілені на 3 підгрупи: група низького ризику — T1-T2N0 (n = 315), проміжного ризику — T1-T2N1 (n = 101) та високого ризику — Т3-4 та/або N2-N3 (n = 96). У результаті було встановлено, що пацієнти, які отримували РМЕ + ПТ, мали кращі показники безрецидивної виживаності та виживаності без ознак захворювання. Оскільки більшість пацієнтів групи низького ризику не отримували ПТ (n = 315), автори не включали тих, хто отримував ПТ (n = 8), в аналіз. У групі проміжного ризику було виявлено, що пацієнти після ПТ мали триваліший період без ознак захворювання (HR: 16,41; 95% СІ 1,61–167,11; p = 0,018). У випадку групи високого ризику ПТ була визнана фактором, що впливає на тривалість як безрецидивної виживаності (HR: 6,22; 95% СІ 1,12–34,45; p = 0,037), так і ВБОЗ (HR: 4,42; 95% СІ 1,42–13,71; p = 0,01). Також було встановлено статистично значущий зв’язок між наявністю 4 і більше метастатичних лімфатичних вузлів і лімфоваскулярною інвазією та підвищеним ризиком ЛРР. Таким чином, автори вважають, що призначення ПТ після РМЕ доцільне у хворих на ТНРМЗ проміжного та високого ризику, а її використання у пацієнтів низького ризику (T1-T2N0) потребує подальших досліджень, зважаючи на існуючі у даного дослідження обмеження [25].
У своїй роботі W. Haque та співавт. (2019) вивчали вплив ад’ювантної ПТ на показники виживаності хворих на ТНРМЗ, які перенесли РМЕ. У ретроспективне дослідження було включено дані з National Cancer Data Base про 14 464 жінки із діагнозом ТНРМЗ Т1-4 стадії та відсутністю метастазів у регіонарних лімфатичних вузлах (рN0), які перенесли РМЕ в період з 2004 по 2014 рік. З усієї когорти ад’ювантну променеву терапію отримали 1569 пацієнток (10,8 %), а 12 895 (89,2 %) хворим проведено тільки хірургічне втручання. Частота призначення ПТ залежала від розміру пухлини, і переважна більшість хворих (51,6 %), які отримали ПТ, мали Т3 стадію пухлини. У дослідженні виявлено, що старший вік був пов’язаний зі зменшенням імовірності застосування ПТ, а збільшення критерію Т та позитивні краї резекції були пов’язані з призначенням ПТ. Мультифакторний аналіз отриманих результатів вказує, що збільшення віку хворих, розміру пухлини (рТ) та позитивні краї резекції були пов’язані з гіршими показниками ЗВ пацієнтів. У результаті аналізу було з’ясовано, що суттєвих статистично значущих відмінностей у 5-річній загальній виживаності між групами РМЕ та РМЕ + ПТ у пацієнтів із Т1 (86,9 та 83,4 %), Т2 (77,8 та 72,2 %) та Т4 (51,7 та 49,3 %) стадіями не існує. Лише у випадку Т3 стадії простежувалась істотна відмінність між двома підгрупами — 62,6 та 74,3 % відповідно. Проте на вірогідність отриманих результатів могла вплинути низька частота призначення ПТ після РМЕ у хворих з Т1-2N0М0 стадією ТНРМЗ [26].
Дослідження H. Shen та співавт. (2015) мало на меті вивчення зв’язку між молекулярним підтипом РМЗ та прогнозом, а також вивчення впливу ПТ після РМЕ на пухлини Т1-3 та з 1–3 позитивними лімфатичними вузлами (N1). Ретроспективно у дослідження включено дані 1369 хворих на різні молекулярні типи РМЗ, які проходили лікування у Cancer Hospital of Tianjin Medical University в період з 2003 по 2009 рік. Із загальної когорти тричі негативний молекулярний підтип РМЗ був у 167 пацієнток (12,2 %). ПТ отримали 24,8 % пацієнтів від загальної когорти, і вона найчастіше застосовувалась у випадку наявності у хворих 3 метастатичних лімфатичних вузлів або лімфоваскулярної інвазії. Під час роботи було проаналізовано ризик розвитку ЛРР, віддалених метастазів та загальну виживаність. Було отримано показники, що вказували на суттєвий вплив ПТ лише на ризик розвитку ЛРР — 34 % для пацієнтів, які перенесли лише РМЕ, та 19,2 % у випадку РМЕ + ПТ. Подальший аналіз отриманих результатів показав, що проведення ПТ після РМЕ зменшує ризик ЛРР (р = 0,017) та ризик виникнення віддалених метастазів (p < 0,0001). Однак наведені показники необхідно інтерпретувати з деякою обережністю, оскільки 95 % пацієнтів із групи ТНРМЗ отримали хіміотерапію в ад’ювантному режимі [28].
B. Abdulkarim та співавт. (2011) у своєму ретроспективному дослідженні оцінювали ризик виникнення ЛРР у хворих на ТНРМЗ. У дослідження включено 768 пацієнтів із T1-3N0-2 ТНРМЗ, дані про яких були отримані із Alberta Cancer Registry. Середня тривалість спостереження становила 7,2 року. Усіх хворих, залежно від проведеного лікування, було розділено на 3 групи. Перша група включала найбільшу кількість пацієнтів (n = 319), які перенесли ОЗО з ад’ювантною променевою терапією. До другої групи було віднесено 287 пацієнтів, які отримали РМЕ без ПТ, а третя група була найменш численною і включала 162 пацієнти, що отримали РМЕ та ад’ювантну ПТ. У дослідженні встановлено, що показники 5-річної БРВ у пацієнток з ТНРМЗ становили 94, 85 та 87 % для груп ОЗО, РМЕ та РМЕ + ПТ відповідно (р < 0,001). Для 5-річної загальної виживаності значення були еквівалентні: 87, 82 та 68 % для груп ОЗО, РМЕ та РМЕ + ПТ відповідно (р = 0,002). Особливістю цього дослідження є те, що в ньому при проведенні мультифакторного аналізу було визначено роль РМЕ без ПТ як єдиного предиктора ризику розвитку ЛРР. Це дозволило зробити припущення, що оптимальним лікуванням ТНРМЗ може бути ОЗО або РМЕ з ад’ювантною ПТ, яка, можливо, відіграє одну з ключових ролей у забезпеченні локорегіонарного контролю даного молекулярного підтипу РМЗ [12].
У ретроспективному дослідженні H. Li та співавт. (2019) вивчали вплив ОЗО порівняно з РМЕ на ЗВ та специфічну для рака молочної залози виживаність (СРМЗВ) у хворих на Т1-2N0М0 ТНРМЗ. У дослідження було включено 14 910 жінок із діагнозом Т1-2N0М0 ТНРМЗ, відомості про яких було отримано з бази Surveillance, Epidemiology, and End Results (SEER) в період з 2010 по 2014 рік. Пацієнтів залежно від виду отриманого лікування було розділено на 3 групи: група ОЗО (n = 7381), група РМЕ (n = 6967) та група РМЕ + ПТ (n = 562). В результаті аналізу було з’ясовано, що показники 5-річної загальної виживаності у групі ОЗО є вищими порівняно із РМЕ та РМЕ + ПТ і становлять 88,6, 83 та 79,6 % відповідно (р < 0,05). У випадку 5-річної СРМЗВ показники в групі ОЗО та РМЕ були майже ідентичними (94,3 та 93,3 % відповідно), для групи РМЕ + ПТ цей показник становив 83,7 % (р < 0,05). Дослідження дає змогу припустити, що оптимальним місцевим лікуванням ранньої стадії ТНРМЗ є ОЗО, оскільки даний вид хірургічного втручання демонструє кращі показники виживаності хворих [29].
Результати наведених досліджень систематизовані в табл. 2.
Обговорення
Лікування ТНРМЗ — це підґрунтя постійних наукових пошуків та дискусій. Агресивність перебігу, що супроводжується вищими показниками розвитку як локорегіонарного рецидиву, так і віддалених метастазів, з найвищою частотою у перші 4 роки від встановлення діагнозу, порівняно із іншими молекулярними підтипами РМЗ вимагає пошуків оптимального місцевого контролю захворювання [30]. Незважаючи на клініко-патогенетичну відмінність тричі негативних пухлин, чітко окреслених рекомендацій з приводу хірургічної тактики та доцільності застосування ад’ювантної променевої терапії на сьогодні не існує. Однак з деякою впевненістю можна сказати, що існує кореляція між молекулярними підтипами РМЗ та ефективністю локорегіонарної терапії.
Систематизувавши дані 6 досліджень щодо вибору оптимального об’єму хірургічного втручання при ТНРМЗ, можна майже однозначно стверджувати, що даний молекулярний підтип не є протипоказанням до органозберігаючих операцій. Вирізняється серед наведених досліджень робота F. Adkins та співавт. (2011), результати якої показують, що якомога радикальніший підхід не виправдовує себе, а РМЕ збільшує ризик смерті хворих приблизно на 22 %. Однак такі дані необхідно інтерпретувати з урахуванням того, що дослідження включало пацієнтів зі всіма патологічними стадіями ТНРМЗ, які мають різний прогноз перебігу та суттєво впливають на показники виживаності серед групи хворих, які перенесли РМЕ [17].
Застосування променевої терапії після проведеної мастектомії особливо актуальне у випадку ранніх стадій, оскільки за таких умов можлива ліквідація резидуальних елементів пухлини і, отже, покращення показників безрецидивної виживаності хворих. Однак питання, чи необхідна ПТ кожному пацієнту, зважаючи на можливі ускладнення, залишається нез’ясованим. Наведені в даному огляді роботи майже одностайно демонструють кращі показники виживаності та нижчу частоту ризику розвитку як ЛРР, так і віддалених метастазів у пацієнтів із стадією Т1-2N0-1 після РМЕ з подальшою ПТ. На противагу їм дослідження W. Haque та співавт. (2019) вказує, що ПТ має вирішальне значення лише для пацієнтів із Т3 стадією ТНРМЗ [26]. Неоднозначні результати були отримані і групою дослідників H. Li та співавт. (2019), які не встановили значної різниці показників специфічної для рака молочної залози та загальної виживаності між групами РМЕ та РМЕ + ПТ серед пацієнтів із ранньою стадією ТНРМЗ. Однак у цьому дослідженні були відсутні дані оцінки параметрів ефективності локорегіонарного контролю [29].
З огляду на неоднорідність систематизованих результатів ця дискусія створює субстрат для проведення подальших досліджень з метою з’ясування, яка група пацієнтів може отримати найбільшу терапевтичну ефективність від ПТ. Беручи до уваги, що більшість досліджень були одноцентровими, відрізнялись за клінічними та соціоекономічними показниками та були виконані у ретроспективному дизайні, така гетерогенність може бути очікуваним результатом. Для більшої вірогідності даних необхідно провести проспективне рандомізоване контрольоване дослідження, а відібрані когорти повинні бути однорідними за такими характеристиками, як вік, расово-етнічний склад, менструальний статус, стадія захворювання, розмір пухлини, відсутність уражених лімфатичних вузлів, відсутність лімфоваскулярної інвазії, статус BRCA-мутації, отримане неоад’ювантне та ад’ювантне лікування.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 25.01.2022
Рецензовано/Revised 10.02.2022
Прийнято до друку/Accepted 16.02.2022

/26.jpg)
/27.jpg)
/29.jpg)