Газета «Новости медицины и фармации» №14 (774), 2021
Вернуться к номеру
Субклинический синдром Кушинга: много вопросов — мало ответов
Авторы: Рыбаков С.И.
г. Вашингтон, США
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
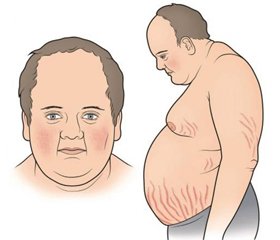
В 1990-е годы появились данные о существовании достаточно многочисленных адренокортикальных аденом (инсиденталом), обнаруживаемых новыми методами топической диагностики (ультразвукового исследования — УЗИ, компьютерной томографии — КТ, магнитно-резонансной томографии — МРТ), с умеренно повышенной глюкокортикоидной функцией и без клинических признаков гиперкортицизма. У части больных эти нарушения носили временный, интермиттирующий характер. Была установлена также зависимость их от размеров обнаруженной опухоли [3–5]. Такая ситуация начала привлекать пристальное внимание клиницистов к этому явлению, что в конечном итоге привело к формированию концепции субклинического синдрома Кушинга. К этой категории сочли возможным относить не только случаи с отсутствием симптоматики гиперкортицизма, но и больных с наличием отдельных признаков синдрома Кушинга (считали неспецифическими) или их сочетаний, выраженных в различной степени (артериальная гипертензия, ожирение, сахарный диабет, нарушение толерантности к глюкозе, дислипидемия, остеопороз).
Данное состояние классифицировали как пре-Кушинг, т.е. его рассматривали как раннюю стадию болезни Иценко — Кушинга. Подтверждением являлся тот факт, что у некоторых больных эти признаки ликвидировались или течение их смягчалось после адреналэктомии. Однако у большинства больных наблюдаемые расстройства не прогрессировали и статус их в плане развития симптомного гиперкортицизма оставался неизменным. Поначалу таких больных было достаточно много, до 15–20 % среди носителей обнаруживаемых инсиденталом [6–9]. На смену определению «пре-Кушинг» пришло понятие «субклинический синдром Кушинга», без четкого указания на возможность его превращения в болезнь Иценко — Кушинга. Решением конференции Национального института здоровья (США) было рекомендовано обозначать это состояние как синдром субклинической автономной глюкокoртикоидной секреции [10]; как вариант используется более краткая формулировка: «субклинический гиперкортизолизм» или «субклинический синдром Кушинга».
К настоящему моменту можно попытаться дать определение сущности субклинического синдрома Кушинга в следующей форме. Субклинический синдром Кушинга (субклинический гиперкортизолизм) — это патологическое состояние организма, которое характеризуется автономной избыточной секрецией глюкокортикоидов, чаще всего аденомой коры надпочечника, подавлением адренокортикотропной функции гипофиза и функционального состояния противоположного надпочечника. Подобное состояние может быть клинически бессимптомным или сопровождаться некоторыми неспецифическими признаками гиперкортицизма (артериальная гипертензия, сахарный диабет, ожирение, остеопороз).
Субклинический синдром Кушинга наблюдается среди 0,2–2,0 % взрослого населения и в основном встречается среди лиц с инсиденталомой надпочечника [3, 11, 12]. По суммарным данным 22 исследователей [13], среди 2622 больных с инсиденталомой надпочечника в 236 (9,0 %) случаях был выявлен субклинический синдром Кушинга при колебаниях этого показателя в пределах 1,1–47,3 % в отдельных сериях. Обращает на себя внимание большая вариабельность частоты его обнаружения, что, возможно, связано с использованием различных критериев для отнесения отдельных случаев к этой категории. Однако при более дифференцированной оценке в 10 сериях наблюдений встречаемость субклинического синдрома Кушинга среди носителей инсиденталом составила менее 10 % и в 10 сериях — от 10,5 до 20,0 %. Лишь в двух группах эта величина достигала 29,1 и 47,3 %. Приведенные данные позволяют ориентировочно считать, что примерно каждая десятая случайно обнаруженная аденома надпочечника обладает субклинической кортизолпродуцирующей активностью. Заслуживает внимания еще один серьезный факт: в однородных группах больных с артериальной гипертензией, сахарным диабетом, ожирением и с инсиденталомой надпочечника частота субклинического синдрома Кушинга была гораздо выше, чем среди больных без этих форм патологии.
Таким образом, при наличии представления о таком патологическом состоянии, как субклинический синдром Кушинга, возникает вопрос: среди каких категорий лиц его следует подозревать и искать?
В первую очередь его следует искать среди больных с диагностированной аденомой надпочечника — инсиденталомой или обнаруженной планово, независимо от клинических проявлений [8, 10, 13–15]. Как указано выше, частота субклинического синдрома Кушинга в этих контингентах гораздо выше, чем в общей популяции. Подлежат обследованию больные с аденомой гипофиза при наличии у них возможных признаков гиперкортизолизма. Тотальный cкрининг на предмет поиска субклинического синдрома Кушинга среди больных с артериальной гипертензией, сахарным диабетом, ожирением вряд ли может быть оправдан из-за распространенности этих форм патологии, организационных сложностей массового проведения и экономических соображений. Некоторые исключения для этих групп больных могут иметь место. Наличие этих заболеваний у пациентов молодого возраста (до 50 лет), особенно в случаях их прогрессирующего течения, появления осложнений и отсутствия эффекта от проводимой целенаправленной квалифицированной терапии, должно являться стимулом для поиска субклинического синдрома Кушинга. Комбинации указанных заболеваний, опять же в случаях прогрессирующего течения и наличия осложнений, могут послужить основанием для поиска субклинического синдрома Кушинга [16–19].
Определившись с контингентами лиц, среди которых целесообразно проводить поиск субклинического синдрома Кушинга, следует решить, какие тесты могут быть наиболее объективными для его диагностики. Существует достаточно большое количество различных лабораторных тестов, применяемых для диагностики гиперкортизолизма, в том числе субклинического. Каждый из них обладает определенной специфичностью и чувствительностью и может быть рекомендован при различных клинических ситуациях. Учитывая, что при субклиническом синдроме Кушинга возрастание абсолютных показателей секреции глюкокортикоидов чаще всего не достигает значительных величин, что затрудняет дифференцирование их от нормальных, предпочтение следует отдать некоторым функциональным пробам и методикам, учитывающим суммарную продукцию гормонов в течение определенного промежутка времени. Конкретно для диагностики субклинического синдрома Кушинга рекомендуются: ночной подавляющий тест с 1 мг дексаметазона, определение кортизола в слюне в ночное время, свободного кортизола в суточной моче, кортизола в крови в вечернее время, в качестве дополнительных — исследование АКТГ и дегидроэпиандростерона-С (ДГЭА-С), суточных ритмов секреции кортизола и АКТГ [5–10, 14, 15, 20, 21].
В качестве базового скринингового теста для выявления субклинического гиперкортизолизма большинство исследователей считают наиболее приемлемой и эффективной ночную супрессивную пробу с 1,0 мг дексаметазона, принимаемого в 23 часа, и определение содержания кортизола в плазме в 8 часов утра. Чувствительность теста достигает 98,1 % и специфичность — 80,5–98,9 %. Снижение определяемого в 8 часов утра содержания кортизола в плазме менее референтной величины свидетельствует о сохранении нормального функционирования гипоталамо-гипофизарно-надпочечниковой системы. Более высокие показатели могут указывать на наличие субклинического синдрома Кушинга. Нормальным результатом у здоровых лиц считается снижение уровня кортизола в крови менее 50 нмоль/л. Показатель выше 138 нмоль/л считается подтверждающим для субклинического синдрома Кушинга. Интервал от 50,0 до 138,0 нмоль/л (зона серой шкалы) предполагает возможность наличия автономного субклинического гиперкортизолизма, и для его подтверждения или исключения требуются дополнительные исследования. К сожалению, существуют расхождения между рекомендуемыми оптимальными дозами принимаемого дексаметазона (1, 3, 5, 8 мг) и соответствующими показателями пограничного результата пробы (50, 69, 83, 138 нмоль/л). Показатели выше пограничных результатов пробы в каждом из приведенных вариантов свидетельствуют в пользу субклинического синдрома Кушинга. J. Shen et al. [22] подвергли анализу пять национальных руководств, в которых содержатся рекомендации по проведению дексаметазоновой пробы и других тестов для диагностики субклинического синдрома Кушинга. Они установили наличие ряда расхождений, указанных выше, при оценке результатов, что свидетельствует об отсутствии теста (-ов) золотого стандарта для диагностики субклинического кортизолизма. Тем не менее большинство клиницистов предпочитают проводить пробу с 1 мг дексаметазона и критической величиной, выше которой верифицируется субклинический синдром Кушинга, считают уровень кортизола выше 138 нмоль/л. Наиболее полные на сегодняшний день рекомендации по лабораторной диагностике субклинического гиперкортизолизма содержатся в обзоре M. Scherlock et al. [21].
В упоминаемой выше сборной статистике работ 22 авторов [13] в 13 сериях больных проба с 1 мг дексаметазона использовалась как исходная для диагностики субклинического синдрома Кушинга, а в остальных применялась проба с 2 и 8 мг. В семи сериях проводили дополнительные исследования АКТГ, в пяти — содержания свободного кортизола в суточной моче, в четырех — суточного ритма секреции кортизола. Согласительная комиссия по инсиденталомам надпочечников при Национальном институте здоровья (США) [10] рекомендует проведение теста с 1 мг дексаметазона всем больным с инсиденталомой надпочечника в качестве первого этапа обследования. Аналогичное предложение содержится в рекомендациях Американского общества клинических эндокринологов [23].
К дополнительным лабораторным методам диагностики приходится прибегать, когда имеются неубедительные данные дексаметазонового теста, например величины кортизола в пределах серой шкалы. Наличие неспецифической симптоматики — артериальной гипертензии, сахарного диабета ожирения — является дополнительным стимулом для выяснения природы возможного гиперкортицизма. Уровень свободного кортизола в суточной моче отражает величину суммарной продукции глюкокортикоидов, которая при субклиническом синдроме Кушинга возрастает, хотя в большинстве случаев незначительно. Проведение теста предусматривает соблюдение строгих правил сбора мочи, отказ от приема некоторых препаратов, ограничение потребления жидкости (не более 4–5 л/сут). Почечная недостаточность может стать причиной искажения результатов теста. Чувствительность теста сравнительно невысокая.
Определение кортизола в слюне, собранной в вечернее время, — методически более простая процедура, не требующая соблюдения строгих режимов сбора образцов, госпитализации. Повышенные показатели имеют ценность при гиперкортицизме любой этиологии, но считается, что при болезни Иценко — Кушинга — более высокую, чем при субклиническом гиперкортицизме. Чувствительность теста колеблется в пределах 22–77 %, что также ограничивает его достоверность. Диагностическую значимость имеет определение содержания кортизола в плазме в вечерние часы. При гиперкортицизме нарушается суточный ритм секреции глюкокортикоидов, и на вечерние часы приходятся более высокие показатели по сравнению с утренними, когда они бывают в норме максимальными. Этот же факт отмечается при исследовании суточного ритма секреции кортизола или АКТГ. Последний тест более громоздкий, проводится в госпитальных условиях, требует больших затрат времени. Поэтому, очевидно, достаточно информативным будет исследование кортизола в вечерние часы. Данные исследования АКТГ не предоставляют дополнительной информации для диагностики субклинического синдрома Кушинга, так как фиксируемые изменения отражают факт нарушения гипоталамо-гипофизарно-надпочечниковой регуляции, имеющий место при гиперкортицизме вообще. Имеются сообщения о том, что низкий уровень ДГЭА-С может служить показателем автономной секреции кортизола. Еще одним диагностическим приемом является сканирование надпочечников с I131-19-йодохолестеролом. Обнаружение повышенного накопления радиоизотопа в одной железе (чаще всего это аденома) и снижение или отсутствие его в контралатеральной может свидетельствовать о наличии гиперкортицизма.
Определяемые изменения показателей функционального состояния гипоталамо-гипофизарно-надпочечниковой системы в различной степени и сочетаниях являются в принципе характерными для гиперкортизолизма, т.е. как для болезни Иценко — Кушинга, глюкостеромы, так и для субклинического гиперкортизолизма. Различия могут касаться абсолютных величин отдельных показателей и их сочетаний, но они не могут считаться объективными, так как зависят от ряда факторов (состояние больного, наличие сопутствующей патологии, длительность заболевания, методики исследований и пр.). Они свидетельствуют о том, присутствует ли гиперкортицизм вообще или его нет. Показатели теста с 1 мг дексаметазона позволяют исключить субклинический гиперкортицизм, когда они составляют < 50,0 нмоль/л, или подтвердить его при уровнях > 138,0 нмоль/л при отсутствии клинических признаков болезни Иценко — Кушинга. Все остальные промежуточные величины попадают в зону серой шкалы, когда для подтверждения или исключения диагноза требуются дополнительные исследования.
Ряд исследователей [15–17, 21, 24, 25] рекомендуют проведение дополнительных повторных исследований из числа названных выше, на основании суммарной оценки которых может быть верифицирован субклинический синдром Кушинга. При показателях в пределах серой шкалы диагноз может быть подтвержден при не менее чем двукратном супрессивном тесте с показателем кортизола, равным или выше 82,8 нмоль/л, АКТГ < 10 пг/мл и повышенном содержании кортизола в суточной моче. Диагноз субклинического синдрома Кушинга может быть отвергнут при результатах двукратного теста с 1 мг дексаметазона выше 82,8 нмоль/л кортизола, уровне АКТГ < 10 пг/мл и повышенном содержании кортизола в суточной моче.
На сегодняшний день субклинический синдром Кушинга известен в двух формах — бессимптомной и сопровождающейся неспецифическими для гиперкортизолизма признаками, которые перечислялись выше.
Здесь, пожалуй, стоило бы кратко вспомнить о специфических и неспецифических симптомах и синдромах гиперкортицизма. В большинстве литературных источников специфическими для синдрома Кушинга считают характерное диспластическое ожирение, матронизм, кожно-трофические изменения. Такие симптомокомплексы, как синдромы арте–риальной гипертензии, нарушений углеводного обмена, остеопоротический, расстройств репродуктивной функции, которые присутствуют практически во всех случаях заболевания, считаются неспецифическими. Можно согласиться, что подобные нарушения бывают характерны для многих других форм патологии. Однако при их отсутствии диагноз глюкокортикоидного гиперкортицизма был бы неправомочен. Очевидно, речь должна была идти о специфичности сочетаний этих расстройств, без которых не бывает болезни Иценко — Кушинга и определенной части субклинического синдрома Кушинга. Параллельно следует отметить, что такие специфические признаки, как ожирение, матронизм, кожные стрии, встречаются при других заболеваниях и состояниях, например при питуитарном базофилизме, экзогенном синдроме Кушинга. Поэтому следует быть осторожными с трактовкой специфических и неспецифических признаков гиперкортицизма применительно к субклиническому синдрому Кушинга.
Другим аспектом проблемы, заслуживающим внимания, является вопрос о материальном субстрате субклинического синдрома Кушинга. Снова обращаясь к литературе, можно убедиться, что он «привязывается» практически всегда только к случайно обнаруженным аденомам надпочечников, инсиденталомам. Однако определенная часть подобных больных может быть обнаружена при целенаправленных поисках адреналовой патологии, когда грамотный врач, зная о возможной причинной связи артериальной гипертензии с патологией надпочечников, назначает больному КТ или УЗИ надпочечников и обнаруживает аденому. Подобную аденому уже нельзя назвать инсиденталомой, и количество таких больных может быть значимым, если они будут попадать в руки грамотных специалистов.
Здесь возникает еще один вопрос: встречается ли субклинический синдром Кушинга среди лиц с нормальными или гиперплазированными надпочечниками и если да, то как часто?
К сожалению, подобные данные в литературе обнаружить не удалось, хотя такая ситуация возможна и наблюдается при патологии других эндокринных желез, например, субклинический гипертиреоз при диффузно увеличенной или нормальной щитовидной железе, субклинический гиперпаратиреоз при диффузной гиперплазии паращитовидных желез.
Вопрос о частоте и выраженности расстройств, сопровождающих субклинический синдром Кушинга, является одним из ключевых, так как он в конечном итоге определяет отношение к этой форме патологии: выбор методов лечения или режимов наблюдения. Наиболее частыми спутниками субклинического гиперкортизолизма являются артериальная гипертензия и связанные с нею сердечно-сосудистые расстройства, сахарный диабет 2-го типа или нарушения толерантности к глюкозе, остеопороз с признаками уменьшения плотности костной ткани и склонностью к переломам, ожирение, гиперлипидемия. Оценка частоты и выраженности этих расстройств возможна при рассмотрении достаточно больших статистических результатов, обобщающих данные с характеристиками указанных осложнений. Следует отметить, что объективно и достоверно связать эти нарушения с субклиническим гиперкортизолизмом не всегда представляется возможным и в литературе очень часто их называют «сопутствующими». В качестве возможных причин подобной неопределенности указывают отсутствие достаточно репрезентативных групп обследованных, ретроспективный характер исследований, интермиттирующее течение гиперкортизолизма у части больных. Существенным моментом является то, что описываемые клинические расстройства наблюдаются чаще у больных преклонного возраста, когда они достаточно часты и без гиперкортизолизма.
По сводным данным [26] обследования 18 групп больных с субклиническим синдромом Кушинга, частота артериальной гипертензии колебалась в пределах 45–100 % в отдельных сериях наблюдений. В среднем этот показатель равнялся 73,2 %. Отражением возможной неупорядоченности полученных результатов является большой диапазон частоты артериальной гипертензии. Более конкретные величины возможно получить в группах с меньшим разбросом показателей. Частота синдрома в пределах 40–60 % отмечена в четырех сериях наблюдений, > 60–80 % — в восьми и > 80 — в шести. В ряде исследований подчеркивается наличие риска кардиоваскулярных заболеваний у этих категорий больных. Субклинический гиперкортизолизм может быть независимым фактором риска патологии коронарных сосудов и связанной с ней повышенной летальности [14, 21, 27]. При субклиническом синдроме Кушинга отмечена более высокая частота кардиомиопатии, инфаркта миокарда, заболеваний коронарных, мозговых сосудов по сравнению с лицами с нефункционирующими аденомами, а также зависимость их от степени выраженности гиперкортизолизма и длительности наблюдения [21, 28–30].
Известно, что избыток кортизола подавляет секрецию инсулина, усвоение глюкозы, синтез гликогена, снижает чувствительность тканей к инсулину и стимулирует глюконеогенез. В определенных условиях (достаточная длительность и интенсивность воздействия) это может приводить к расстройствам углеводного обмена — от нарушенной толерантности к глюкозе до сахарного диабета. Этот механизм в полной мере реализуется при субклиническом гиперкортизолизме. В указанной серии исследований [26] сахарный диабет 2-го типа/нарушенная толерантность к глюкозе наблюдались у 15,9–68,8 % больных в отдельных сериях; в среднем у 39,1 %. Частота этих расстройств до 30 % наблюдалась в пяти сериях, > 30–50 % — в 10 и > 50 % — в 3.
Ожирение при субклиническом синдроме Кушинга не достигает таких степеней, как при болезни Иценко — Кушинга, и не носит столь диспластический характер, но все же развивается нередко, преимущественно за счет висцерального перераспределения жировой ткани, повышения индекса массы тела [16, 31–33]. Частота ожирения в 11 группах больных [26] достигала 19–77,5 %, в среднем 46,2 %. В семи группах она колебалась в пределах 20–50 %, в трех — 67–77 % и в одной равнялась 19 %.
Синдром костных нарушений в виде различной степени остеопороза, вплоть до переломов, является неотъемлемой составной частью клиники болезни Иценко — Кушинга. Процесс распространяется в основном в трабекулярных костях и чаще всего демонстрируется компрессионными переломами позвонков и ребер. Исследования последних лет свидетельствуют, что аналогичные процессы наблюдаются при субклиническом гиперкортизолизме [34–37]. По данным восьми исследований, симптомы остеопороза регистрировались в 24–87,5 %, в среднем — 44 % случаев субклинического синдрома Кушинга. Сюда включались в основном случаи остеопороза различной степени и компрессии позвонков, чаще нижних грудных и поясничных.
Заслуживает внимания еще одна сборная статистика G. Dalmazi et al. [27]. В ней представлены сведения о 4324 инсиденталомах надпочечников, собранные 27 авторами. В этой когорте был выявлен 1191 (27,5 %) больной с субклиническим синдромом Кушинга. Частота артериальной гипертензии в отдельных сериях наблюдений колебалась в пределах 35–92 % и в среднем равнялась 66,5 %. В 16 группах больных с нефункционирующими аденомами частота артериальной гипертензии находилась в пределах 53–73 % и в среднем составляла 58,8 %, т.е. разница оказывалась несущественной. Частота сахарного диабета 2-го типа и нарушений толерантности к глюкозе в отдельных группах больных с субклиническим синдромом Кушинга колебалась в пределах 8–69 % и в среднем равнялась 30,4 %. Для нефункционирующих аденом эти показатели равнялись 9–32 % и 19,6 % соответственно (16 групп).
При обнаружении у больного субклинического синдрома Кушинга врач должен оценить степень тяжести его проявлений и по возможности прогнозировать дальнейшее течение. Первый вопрос, возникающий при подобных обстоятельствах: следует ли ожидать прогрессирования процесса и развития более тяжелого, клинически манифестного глюкокортикоидного гиперкортицизма? Так как большинство случаев субклинического синдрома Кушинга обнаруживаются у больных с аденомой надпочечника, выявленной случайно или планово, необходимо решить еще одну существенную задачу: определить вероятность ее злокачественности. Последнее бывает возможным при оценке размеров образования и некоторых его характеристик, обнаруживаемых при топической диагностике.
Достаточно большое количество публикаций свидетельствуют, что субклинический гиперкортизолизм очень редко приводит к развитию манифестного синдрома Кушинга. В качестве примера можно привести сборные материалы 13 статистических обзоров [13], обобщающих данные долгосрочного наблюдения 1394 больных с субклиническим гиперкортизолизмом в течение 24–72 месяцев (в среднем 37,5). В этой когорте было отмечено 11 (0,78 %) случаев превращения субклинического в клинически явный синдром Кушинга. В отдельных сериях этот показатель колебался в пределах 0–5,8 %. Из 637 больных (6 групп), наблюдавшихся до 24 месяцев, синдром Кушинга возник в 2 (0,3 %) случаях. Из 757 (7 групп) больных, которые находились под наблюдением свыше 24 и до 72 месяцев, синдром Кушинга наблюдался у 9 (1,2 %). Таким образом, реальность подобного события крайне незначительна. Некоторое увеличение частоты трансформации субклинического гиперкортизолизма с течением времени является основанием для проведения тщательного долгосрочного наблюдения за подобными больными.
Приведенные данные свидетельствуют, что в настоящее время сформировались представления о такой форме патологии, как субклинический синдром Кушинга, но одновременно сохраняется ряд противоречий. Считают, что его происхождение связано с развитием автономной нерегулируемой гиперпродукции глюкокортикоидов, чаще всего обнаруживаемой в функционирующих аденомах надпочечников. Незначительно повышенная секреция кортизола и других стероидов в течение определенного промежутка времени может приводить к развитию ряда симптомов и признаков, характерных для клинически явных проявлений гиперкортизолизма, наблюдаемых при болезни Иценко — Кушинга и гормонально-активных опухолях коры надпочечников (глюкостерома). Обычно они проявляются не в полном объеме и не имеют столь ярких и выраженных характеристик, как при названных заболеваниях. К их числу относятся артериальная гипертензия с сопутствующими ей расстройствами, нарушения углеводного обмена вплоть до развития сахарного диабета, преимущественно 2-го типа, ожирение, остеопороз. Определенная часть случаев субклинического синдрома Кушинга протекает клинически бессимптомно и обнаруживается лишь при обследовании лиц со случайно выявленными аденомами надпочечников, инсиденталомами. Они характеризуются определяемыми лабораторно нарушениями функционального состояния гипоталамо-гипофизарно-надпочечниковой системы в виде автономной гиперсекреции глюкокортикоидов обнаруженной аденомой, подавления АКТГ-функции гипофиза, нарушений суточных ритмов секреции гормонов, снижения гормонпродуцирующей функции контралатерального надпочечника.
Если для бессимптомного варианта субклинического синдрома Кушинга не возникает сомнений в плане целесообразности проведения наблюдения с периодическими контрольными обследованиями больных, то относительно субклинического гиперкортизолизма, который сопровождается указанными кардиоваскулярными и метаболическими нарушениями в течение ряда лет, не ослабевают споры сторонников активного хирургического лечения и выжидательной наблюдательной тактики с симптоматическим лечением сопутствующей патологии. Предлагаемый вариант хирургического лечения предусматривает выполнение адреналэктомии с опухолью (аденомой). В значительном числе публикаций доказывается, что адреналэктомия имеет ряд преимуществ по сравнению с медикаментозным лечением. Они особенно наглядны при оценке динамики артериального давления и в меньшей степени — при учете сдвигов метаболических нарушений [38–41]. Так, Y. Erbit et al. [42] показали, что в плане коррекции артериального давления адреналэктомия оказывается более эффективной, чем при манифестном гиперкортизолизме. M. Tsuki et al. [43] отмечали улучшение показателей артериального давления и гликемии после операции по сравнению с неоперированными больными, у которых они частично ухудшались. I. Chiodioni et al. [44] отмечали, что после операции улучшались показатели артериального давления и уровня глюкозы в крови не только у больных с субклиническим синдромом Кушинга, но и у пациентов с нефункционирующими аденомами. Данные этих и многих других подобных исследований все же не являются полностью убедительными по причинам некоторых методических отклонений, недостаточного количества больных, ретроспективного характера исследований. Возможно, более демонстративные и четкие показатели могут быть получены при анализе достаточно большого количества наблюдений. При рассмотрении результатов адреналэктомии, выполненной в 13 группах больных с субклиническим синдромом Кушинга [26], было установлено снижение артериального давления в среднем во всех группах на 68,7 %, при колебаниях в отдельных сериях в пределах 50–100 %. Улучшение показателей углеводного обмена суммарно имело место у 41,7 % (22,2–100 %) больных. Почти с одинаковой частотой отмечено снижение массы тела в 11 группах больных; в среднем у 48,3 % (0–100 %). По данным обследования двух групп пациентов изменения показателей остеопороза не отмечалось.
Современные тактико-технические подходы к лечению субклинического синдрома Кушинга довольно разнообразны и чаще строятся на прагматических принципах, чем на достоверно обоснованных.
В руководстве, опубликованном Национальным институтом здоровья (США) [10], указывается, что адреналэктомия или тщательное наблюдение с симптоматической терапией по показаниям в равной степени правомерны при субклиническом синдроме Кушинга. В руководстве Американской ассоциации эндокринологов и эндокринных хирургов [45] хирургическое лечение рекомендуется при безуспешности консервативной терапии и ухудшении показателей артериального давления и метаболизма. В рекомендациях Итальянского общества эндокринологов [14] предлагается хирургическое лечение резервировать для больных с коротким анамнезом и/или ухудшающимся состоянием. Синтезируя приведенные данные, можно рекомендовать адреналэктомию для лиц более молодого возраста, в основном моложе 50 лет, если прослеживается связь выявляемых расстройств с субклиническим гиперкортизолизмом или при неуспехе консервативного лечения. Для пожилых больных при исключении злокачественного характера аденомы рекомендуется консервативное лечение. Оно также показано для больных любого возраста при наличии у них серьезных нарушений гомеостаза (осложненное течение артериальной гипертензии, нестабильное течение сахарного диабета, почечно-печеночная недостаточность, выраженный атеросклероз и пр.).
Хирургическое лечение — адреналэктомия с опухолью — проводится по общепринятым принципам открытым или лапароскопическим методом. При операции у подобных больных следует иметь в виду опасность развития послеоперационной адренокортикальной недостаточности в связи с частым подавлением функции контралатерального надпочечника в процессе заболевания. Подобным больным рекомендуется в послеоперационном периоде проведение заместительной терапии глюкокортикоидами с последующей коррекцией в процессе наблюдения.
Важными являются вопросы наблюдения и ведения больных с субклиническим синдромом Кушинга. В указанных выше клинических руководствах, а также в большом количестве частных публикаций содержатся основные рекомендации по режимам сопровождения лиц с субклиническим гиперкортизолизмом. Они предусматривают проведение клинико-гормонального обследования больных, выполнение пробы с 1 мг дексаметазона, использование визуализирующих методик (КТ, МРТ) через определенные временные интервалы. Все эти процедуры рекомендуется повторять в течение 2–5 лет, после чего при отсутствии отрицательной динамики больной может быть снят с учета. По истечении этих сроков вероятность прогрессирования гиперкортизолизма считают маловероятной [10, 14, 21, 45–47].
Даже поверхностное знакомство с такой сравнительно новой формой патологии, как субклинический синдром Кушинга, порождает много вопросов, задать которые, а тем более ответить на них в рамках журнальной публикации не представляется возможным. В литературе, почти повсеместно, синдром субклинического гиперкортизолизма рассматривается лишь при инсиденталомах надпочечников и не сообщается, как часто он обнаруживается при планово диагностированных аденомах и других формах адреналовой и висцеральной патологии. Известно много работ об исследовании функции надпочечников при гипертонической болезни, сахарном диабете, ожирении, в которых описывается повышение их функциональной активности и улучшение ее показателей при успешном лечении этих заболеваний. Но параллелизма с субклиническим гиперкортизолизмом в них не усматривается. Повсеместно указывается, что названные формы патологии являются сопровождающими, но нигде не сказано, что они являются следствием нарушений функций гипоталамо-гипофизарно-надпочечниковой системы. При клинически манифестном синдроме Кушинга эти синдромы и ряд других встречаются практически всегда, совместно, с различной степенью выраженности. Не встречается болезнь Иценко — Кушинга, которая проявляется только артериальной гипертензией или сахарным диабетом. Странным и непонятным является нередко многолетнее существование субклинического гиперкортизолизма без признаков прогрессирования, тогда как болезнь Иценко — Кушинга или глюкостерома, возникнув, –нередко бурно прогрессируют и приводят к неблагоприятному исходу за сравнительно короткий промежуток времени.
Кора надпочечников продуцирует около 40 стероидов. Достаточно широко известен и изучается субклинический гиперкортизолизм, но почему-то мало, вернее, почти ничего не известно о субклиническом гиперальдостеронизме, субклинической продукции надпочечниковых андрогенов, хотя секреция альдостерона тоже частично регулируется АКТГ. В связи с этим возникает вопрос, не может ли субклинический синдром Кушинга быть плодом гиперфункции нормальных или диффузно увеличенных (гиперплазированных) надпочечников в результате каких-то нарушений в гипоталамо-гипофизарно-надпочечниковой иерархии. И наконец, являются ли сопутствующие субклиническому синдрому Кушинга нарушения следствием гиперпродукции кортизола, хотя нередко и незначительной, или они могут быть причиной возникновения субклинического гиперкортизолизма, т.е. что было первичным — курица или яйцо? Ведь и артериальная гипертензия, и сахарный диабет, и ожирение являются стрессорными факторами длительного действия, предъявляющими повышенные требования к системам организма для обеспечения их нормального функционирования. В подобной ситуации можно ожидать повышения кортизолпродуцирующей функции надпочечников. Этот процесс, протекающий длительно, может вызвать подавление АКТГ-функции гипофиза и возникновение признаков автономии секреторной деятельности коры надпочечников.
Для лечения субклинического гиперкортизолизма в настоящее время предлагается адреналэктомия, имеющая целью снизить поступление в организм больного избыточных количеств глюкокортикоидов, приводящих к развитию названных нарушений. Известны медикаментозные способы подавления функции коры надпочечников — используя препараты хлодитан, митотан, кетоконазол, но они почему-то не нашли применения. Следует учесть, что клинический гиперкортизолизм чаще наблюдается у лиц пожилого возраста, с расстройствами и осложнениями, связанными с артериальной гипертензией, сахарным диабетом, и адреналэктомия, наркоз сами по себе несут для них высокие риски осложнений и неблагоприятного исхода. Отсутствует ясность в отношении бессимптомных форм субклинического синдрома Кушинга, диагностируемых только лабораторными методами: следует ли их лечить или ограничиться наблюдением?
Возможно, на эти и еще ряд других невысказанных вопросов ответы будут получены по мере углубления и совершенствования знаний о такой форме патологии, как субклинический гиперкортизолизм. Автор пытался описать их в меру своих представлений, которые могут не совпадать с общепринятыми, но это уже, как говорили братья Стругацкие, совсем другая история.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
Список литературы находится в редакции