Журнал «Медицина неотложных состояний» Том 17, №6, 2021
Вернуться к номеру
Оцінка впливу індивідуалізованої протективної вентиляції на механічні властивості легень
Авторы: Кузьменко Т.С., Воротинцев С.І.
Запорізький державний медичний університет, м. Запоріжжя, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
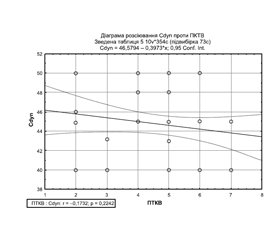
Робота присвячена вивченню впливу індивідуалізованої протективної вентиляційної підтримки на легеневу механіку. У дослідження увійшли 47 пацієнтів, яким під загальним знеболюванням було проведене відкрите оперативне втручання на органах черевної порожнини. Усі пацієнти мали помірний або високий ризик розвитку післяопераційних легеневих ускладнень за шкалою ARISCAT. Інтраопераційно проводилася оцінка впливу індивідуалізованої протективної вентиляції на показники механіки дихання, а саме Ppeak, Pplat, Pdrive, динамічний легеневий комплаєнс. Індивідуалізована протективна респіраторна підтримка становила собою вентиляцію дихальним об’ємом 7 мл/кг ідеальної маси тіла з підбором оптимального рівня позитивного тиску в кінці видиху (ПТКВ) з урахуванням показника динамічного легеневого комплаєнсу (Cdyn) та проведенням рекрутуючого маневру (РМ) після інтубації, а далі — у разі зниження Cdyn більше ніж на 20 % із подальшим повторним підбором ПТКВ. Досліджувані параметри фіксувалися до та після проведення РМ, а також на 30, 60, 90, 120, 150, 180-й хвилинах після проведення РМ, залежно від тривалості операції. Застосування техніки розправлення альвеол призводило до покращення показників легеневої механіки, а саме підвищення динамічного легеневого комплаєнсу на 16 % та зниження Pdrive на 17 %. Інтраопераційний рівень ПТКВ у середньому становив 4 [4; 5] см вод.ст. Не було зафіксовано жодного випадку гіпоксемії чи необхідності в повторному проведенні РМ. Отримані результати вказують на те, що обрана техніка проведення рекрутуючого маневру є ефективною та безпечною, а її використання дає можливість зменшити негативний вплив штучної вентиляції легень. У дослідженні не виявлено статистично вірогідного кореляційного зв’язку між рівнем ПТКВ та значенням динамічного легеневого комплаєнсу. Такі дані доводять необхідність індивідуального підбору пара-метрів вентиляції відповідно до особливостей механічних властивостей кожного окремого пацієнта.
The work is devoted to the study of the influence of individualized protective ventilation support on pulmonary mecha-nics. The study included 47 patients who underwent open abdominal surgery under general anesthesia. All patients had a moderate to high risk of developing postoperative pulmonary complications by the ARISCAT scale. Intraoperatively, the impact of individualized protective ventilation on respiratory mechanics, namely Ppeak, Pplat, Pdrive, dynamic pulmonary compliance was assessed. Individualized protective respiratory support was ventilation with a tidal volume of 7 ml/kg of ideal body weight, with the selection of the optimal level of positive pressure at the end of exhalation (PEEP), focusing on dynamic pulmonary compliance and performing recruiting maneuver, and then in the case of a decrease in dynamic pulmonary compliance by more than 20 %, followed by re-selection of PEEP. The studied parameters were recorded before and after the recruiting maneuver, as well as on the 30th, 60th, 90th, 120th, 150th, 180th minutes after the recruiting maneuver, depending on the duration of the operation. The use of alveolar straightening techniques led to an improvement in pulmonary mechanics, namely, an increase in dynamic pulmonary compliance by 16 % and a decrease in Pdrive by 17 %. The intraoperative level of PEEP averaged 4 [4; 5] cm of water. No cases of hypoxemia or recurrence of recruiting maneuver were reported. The obtained results indicate that chosen technique of recruiting maneuver is effective and safe, and its use allows reducing the negative impact of mechanical ventilation. The study did not find a statistically significant correlation between the level of PEEP and the value of dynamic pulmonary compliance. Such data prove the need for individual selection of ventilation parameters according to the characteristics of the mechanical properties of each patient.
легенева механіка; індивідуалізована протективна вентиляція
respiratory mechanic; individualized protective ventilation
Вступ
Матеріали та методи
Результати та їх обговорення
Висновки
- Kor D.J., Warner D.O., Alsara A., Fernández-Pérez E.R. et al. Derivation and Diagnostic Accuracy of the Surgical Lung Injury Prediction Model. Anesthesiology. 2011. 115. 117-128. doi: 10.1097/ALN.0b013e31821b5839.
- Gropper M.A. Postoperative Respiratory Muscle Dysfunction: Only the Strong Survive. Anesthesiology. 2013. 118. 783-784. doi: 10.1097/ALN.0b013e318288823b.
- Smith P.R., Baig M.A., Brito V., Bader F. et al. Postoperative Pulmonary Complications after Laparotomy. Respiration. 2010. 80. 269-274. doi: 10.1159/000253881.
- Nafiu O.O., Ramachandran S.K., Ackwerh R., Tremper K.K. et al. Factors associated with and consequences of unplanned post-operative intubation in elderly vascular and general surgery patients. European journal of anaesthesiology. 2011. 28. 220-224. doi: 10.1097/EJA.0b013e328342659c.
- Ramachandran S.K., Nafiu O.O., Ghaferi A., Tremper K.K. et al. Independent predictors and outcomes of unanticipated early postoperative tracheal intubation after nonemergent, noncardiac surgery. Anesthesiology. 2011. 115. 44-53. doi: 10.1097/ALN.0b013e31821cf6de.
- Fisher B.W., Majumdar S.R., McAlister F.A. Predicting pulmonary complications after nonthoracic surgery: a systematic review of blinded studies. The American journal of medicine. 2002. 112. 219-225. doi: 10.1016/s0002-9343(01)01082-8.
- Güldner A., Kiss T., Serpa Neto A., Hemmes S.N. et al. Intraoperative protective mechanical ventilation for prevention of postope-rative pulmonary complications: a comprehensive review of the role of tidal volume, positive end-expiratory pressure, and lung recruitment maneuvers. Anesthesiology. 2015. 123. 692-713. doi: 10.1097/ALN.0000000000000754.
- Serpa Neto A., Hemmes S.N., de Abreu M.G., Pelosi P. et al. PROVE Network investigators. Protocol for a systematic review and individual patient data meta-analysis of benefit of so-called lung-protective ventilation settings in patients under general anesthesia for surgery. Systematic Reviews. 2014. 3. 2. doi: 10.1186/2046-4053-3-2.
- Ferrando C., Soro M., Unzueta C., Suarez-Sipmann F. et al. Individualized PeRioperative Open-lung VEntilation (iPROVE) Network. Individualised perioperative open-lung approach versus standard protective ventilation in abdominal surgery (iPROVE): a randomised controlled trial. The Lancet Respiratory Medicine. 2018. 6. 193-203. doi: 10.1016/S2213-2600(18)30024-9.
- Serpa Neto A., Cardoso S.O., Manetta J.A., Pereira V.G. et al. Association between use of lung-protective ventilation with lower tidal volumes and clinical outcomes among patients without acute respiratory distress syndrome: a meta-analysis. JAMA. 2012. 308. 1651-1659. doi: 10.1001/jama.2012.13730.
- Neto A.S., Hemmes S.N., Barbas C.S., Beiderlinden M. et al. PROVE Network Investigators. Association between driving pressure and development of postoperative pulmonary complications in patients undergoing mechanical ventilation for general anaesthesia: a meta-analysis of individual patient data. The Lancet Respiratory Medicine. 2016. 4. 272-280. doi: 10.1016/S2213-2600(16)00057-6.
- Young C.C., Harris E.M., Vacchiano C., Bodnar S. et al. Lung-protective ventilation for the surgical patient: international expert panel-based consensus recommendations. British Journal of Anaesthesia. 2019. 123. 898-913. doi: 10.1016/j.bja.2019.08.017.
- Miskovic A., Lumb A.B. Postoperative pulmonary complications. British Journal of Anaesthesia. 2017. 118. 317-334. doi: 10.1093/bja/aex002.
- URL: https://medicalc.ru/devine (дата звернення: 07.02.2021).
- Aoyama H., Yamada Y., Fan E. The future of driving pressure: a primary goal for mechanical ventilation? Journal of Intensive Care. 2018. 6. 64. doi: 10.1186/s40560-018-0334-4.
- Wirth S., Baur M., Spaeth J., Guttmann J. et al. Intraope-rative positive end-expiratory pressure evaluation using the intratidal compliance-volume profile. British Journal of Anaesthesia. 2015. 114. 483-490. doi: 10.1093/bja/aeu385.
- Liu J., Meng Z., Lv R., Zhang Y. et al. Effect of intraoperative lung-protective mechanical ventilation on pulmonary oxygenation function and postoperative pulmonary complications after laparoscopic radical gastrectomy. Brazilian Journal of Medical Biological Research. 2019. 52. e8523. doi: 10.1590/1414-431x20198523.
- DESIGNATION-investigators, Bulte CSE. Driving Pressure During General Anesthesia for Open Abdominal Surgery (DESIGNATION): study protocol of a randomized clinical trial. Trials. 2020. 21. 198. https://doi.org/10.1186/s13063-020-4075-z
- Park M., Ahn H.J., Kim J.A., Yang M. et al. Dri-ving Pressure during Thoracic Surgery: A Randomized Clinical Trial. Anesthesiology. 2019. 130. 385-393. doi: 10.1097/ALN.0000000000002600.

/74.jpg)
/75.jpg)
/76.jpg)