Журнал «Медицина неотложных состояний» Том 17, №5, 2021
Вернуться к номеру
Особливості моніторингу біспектрального індексу у дітей раннього віку з гідроцефалією
Авторы: Павлиш О.С., Снісарь В.І.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
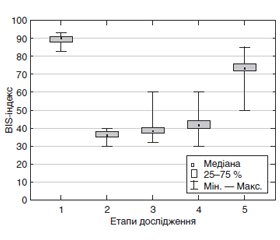
Актуальність. Щорічно мільйони дітей з неврологічними захворюваннями піддаються загальній анестезії. Умови, при яких здійснюються операції у таких дітей, залежать від низки взаємопов’язаних факторів, що виникають в умовах неврологічного дефіциту та є нерідко причиною анестезіологічних ускладнень. Певний інтерес викликає можливість використання моніторингу біспектрального індексу у педіатричних пацієнтів з неврологічними порушеннями, а саме в дітей з гідроцефалією на фоні вентрикуломегалії. Мета: оцінка динаміки показників BIS-моніторингу (від англ. Bispectral index — біспектральний індекс) у дітей раннього віку з гідроцефалією при проведенні вентрикулоперитонеального шунтування. Матеріали та методи. У дослідження було включено 109 дітей. Дітям з набутою формою гідроцефалії (n = 59) проводилося вентрикулоперитонеальне шунтування, а у дітей без неврологічних (n = 50) порушень здійснювалися реконструктивні операції. Дослідження проводилось у 5 етапів: вихідний, індукція в анестезію, інтубація трахеї, травматичний етап операції, пробудження. Результати. Аналіз електроенцефалографічного дослідження у хворих дітей з гідроцефалією показав однорідність перебудов біоелектричного патерну, які відображали широке і стійке залучення в патологічний процес різних мозкових систем із дисфункцією мезенцефально-діенцефальних, зокрема гіпоталамічних утворень, в поєднанні з порушенням корково-підкорково-стовбурових взаємовідносин. При аналізі початкових показників біспектрального індексу в дітей з гідроцефалією були виявлені значно менші значення порівняно з неврологічно здоровими дітьми (89,25 ± 2,52 та 94,80 ± 1,55 відповідно). Аналіз змін інтраопераційного BIS-індексу показав, що в групі пацієнтів із гідроцефалією з використанням пропофолу під час індукції при досягненні першої хірургічної стадії анестезії за клінічними показниками значення BIS значно зменшувалися до 36,00 ± 2,74, що на 30 % менше порівняно з дітьми без неврологічних порушень та на 29 % при використанні севофлюрану. В групах, де використовувався пропофол, була виявлена вірогідна різниця показників BIS між дітьми з гідроцефалією та неврологічно здоровими дітьми під час усіх етапів операції. Це вказувало на те, що патерн інтраопераційного сну в дітей з гідроцефалією знаходиться на аномально низьких рівнях. Висновки. Гіпоперфузія мозкової речовини разом з порушеннями корково-підкоркових взаємовідносин впливають на значення BIS-індексу. Використання пропофолу в дітей з гідроцефалією може призводити до розвитку церебральної ішемії зі зниженням електричної активності головного мозку.
Background. Millions of children with neurological diseases are subjected to general anesthesia every year. The conditions under which surgeries are done in these patients depend on a number of interrelated factors that arise in conditions of neurological deficiency and are often the cause of anesthetic complications. The possibility of using the monitoring of bispectral index in pediatric patients with neurological disorders is of particular interest, specifically in those with hydrocephalus against the background of ventriculomegaly. The purpose was to evaluate of the dynamics of bispectral index monitoring in young children with hydrocephalus during ventriculoperitoneal shunting. Materials and methods. The study included 109 children: 59 with acquired form of hydrocephalus who underwent ventriculoperitoneal shunting and 50 without neurological disorders who underwent reconstructive surgery. The study had 5 stages: initial, induction into anesthesia, tracheal intubation, traumatic stage of the operation, awakening. Results. Electroencephalographic analysis in children with hydrocephalus showed the homogeneity of the rearrangements of the bioelectric pattern, which reflected the wide and stable involvement in the pathological process of various cerebral systems with dysfunction of mesencephalic-diencephalic formations, including hypothalamic ones, in combination with impaired cortical-subcortical-brainstem interrelations. When analyzing the baseline bispectral index in patients with hydrocephalus, significantly lower values were found compared to neurologically healthy children (89.25 ± 2.52 and 94.80 ± 1.55, respectively). Analysis of changes in the intraoperative bispectral index showed that in the group with hydrocephalus using propofol, during induction upon reaching the first surgical stage of anesthesia according to clinical indications, the bispectral index significantly decreased to 36.00 ± 2.74, which is 30 % less than in children without neurological disorders and 29 % less when using sevoflurane. The groups where propofol was used showed a significant difference in bispectral index between patients with hydrocephalus and neurologically healthy children at all stages of the operation. This indicated that the intraoperative sleep pattern in individuals with hydrocephalus is at abnormal low levels. Conclusions. Hypoperfusion of the medulla, together with impaired cortical-subcortical relationships, affect the value of the bispectral index. The use of propofol in children with hydrocephalus can lead to the development of cerebral ischemia with a decrease in the electrical activity of the brain.
гідроцефалія; діти; BIS; анестезія
hydrocephalus; children; bispectral index; anesthesia
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Dewan M.C., Rattani A., Mekary R., Glancz L.G., Yunusa I., Baticulon R.E. et al. Global hydrocephalus epidemiology and incidence: systematic review and meta-analysis. J. Neurosurg. 2018. 1. 1-15. doi: 10.3171/2017.10.JNS17439.
- Limbrick D. Jr., Baird L.C., Klimo P. Jr., Riva-Cambrin J., Flannery A.M. Pediatric hydrocephalus: systematic literature review and evidence-based guidelines. Part 4: Cerebrospinal fluid shunt or endoscopic third ventriculostomy for the treatment of hydrocephalus in children. J. Neurosurg. Pediatr. 2014. 14(1). 30-4. doi: 10.3171/2014.7.PEDS14324.
- Stein E.J. Advances in awareness monitoring technologies. Curr. Opin. Anaesthesiol. 2016. 29(6). 711-716. doi: 10.1097/ACO.0000000000000387.
- Park S.W., Lee H., Ahn H. Bispectral Index Versus Standard Monitoring in Sedation for Endoscopic Procedures: A Systematic Review and Meta-Analysis. Dig. Dis. Sci. 2016. 61(3). 814-24. doi: 10.1007/s10620-015-3945-9.
- Cortínez L.I., Anderson B.J. Modeling the pharmacokinetics and pharmacodynamics of sevoflurane using compartment models in children and adults. Paediatr. Anaesth. 2018. 28(10). 834-840. doi: 10.1111/pan.13465.
- Constant I., Sabourdin N. The EEG signal: a window on the cortical brain activity. 2012. 22(6). 539-52. doi: 10.1111/j.1460-9592.2012.03883.x.
- Gunter A., Ruskin J.K. Intraoperative neurophysiologic monitoring: utility and anesthetic implications. Curr. Opin. Anaesthesiol. 2016. 29(5). 539-543. doi: 10.1097 / ACO.0000000000000374.
- Kennedy R.R., Hendrickx J.F., Feldman J.M. There are no dragons: Low-flow anaesthesia with sevoflurane is safe. Аnaesth Intensive Care. 2019. 47(3). 223-225. doi: 10.1177/0310057X19843304.
- Kaminska А., Eisermann М., Plouin P. Child EEG (and maturation). Handb. Clin. Neurol. 2019. 160. 125-142. doi: 10.1016/B978-0-444-64032-1.00008-4.
- Chen S., Luo J., Reis C., Manaenko A., Zhang J. Hydrocephalus after Subarachnoid Hemorrhage: Pathophysiology, Diagnosis, and Treatment. Biomed. Res. Int. 2017. 2017. 8584753. doi: 10.1155/2017/8584753.
- Sullivan A.С., Egbuta С., Park S.R., Lukovits K., Cavanaugh D., Mason K.P. The Use of Bispectral Index Monitoring Does Not Change Intraoperative Exposure to Volatile Anesthetics in Children. J. Clin. Med. 2020. 9(8). 2437. doi: 10.3390/jcm9082437.
- Hesse S., Kreuzer M., Hight D., Gaskell A., Devari P., Singh D., Taylor N.B., Whalin M.K., Lee S., Sleigh J.W., García P.S. Association of electroencephalogram trajectories during emergence from anaesthesia with delirium in the postanaesthesia care unit: an early sign of postoperative complications. Br. J. Anaesth. 2019. 122(5). 622-634. doi: 10.1016/j.bja.2018.09.016.
- Gruenewald M., Harju J., Preckel B., Molnár Z., Yli-Hankala A., Rosskopf F., Koers L., Orban A., Bein B.; Study Group AoA. Comparison of adequacy of anaesthesia monitoring with standard clinical practice monitoring during routine general anaesthesia: An international, multicentre, single-blinded randomised controlled trial. Eur. J. Anaesthesiol. 2021. 38(1). 73-81. doi: 10.1097/EJA.0000000000001357.
- Siddharthan Y.P.S., Bata А., Anetakis K., Crammond D.J., Balzer J.R., Snyderman K., Gardner P., Thirumala P.D. Role of Intraoperative Neurophysiologic Monitoring in Internal Carotid Artery Injury During Endoscopic Endonasal Skull Base Surgery. World Neurosurg. 2021. 148. e43-e57. Epub 2020 Dec 7. doi: 10.1016/j.wneu.2020.11.154.
- Lalou A.D., Czosnyka M., Donnelly J., Pickard J.D., Nabbanja E., Keong N.C., Garnett M., Czosnyka Z.H. Cerebral autoregulation, cerebrospinal fluid outflow resistance, and outcome following cerebrospinal fluid diversion in normal pressure hydrocephalus. J. Neurosurg. 2018. 130(1). 154-162. doi: 10.3171/2017.7.JNS17216.

/91.jpg)
/92.jpg)
/93.jpg)