Резюме
Мета — оптимізація діагностики та оцінки хронічної хвороби нирок (ХХН) у хворих на гіпертонічну хворобу (ГХ) шляхом вивчення ролі адипокінів (лептину, оментину, вісфатину, резистину) у хворих з гіпертонічною хворобою у поєднанні з хронічною хворобою нирок. Матеріали та методи. У дослідження було включено 100 хворих на гіпертонічну хворобу ІІ та ІІІ ступеня 2-ї стадії, із них у 51 пацієнта було діагностовано хронічну хворобу нирок. Групу контролю становили 20 практично здорових осіб. Результати. Наше дослідження показало, що рівні лептину, оментину, резистину та вісфатину були значно вищі у пацієнтів з ГХ у поєднанні з ХХН, на відміну від пацієнтів з ГХ без ХХН та групи контролю. За результатами дисперсійного аналізу Краскела — Уолліса, у хворих на ГХ у поєднанні з ХХН адипокіни вірогідно корелювали із систолічним артеріальним тиском (АТ), діастолічним АТ, ступенем ГХ, індексом маси тіла, ліпопротеїнами низької щільності, тиреоглобуліном, швидкістю клубочкової фільтрації, креатиніном, кінцево-діастолічним розміром, індексом відносної товщини стінок, масою міокарда лівого шлуночка, індексом маси міокарда лівого шлуночка, наявністю діастолічної дисфункції, типом діастолічної функції. Висновки. У хворих на ГХ у поєднанні з ХХН відмічається вірогідне підвищення показників рівнів адипокінів (лептину, оментину, резистину, вісфатину) в крові порівняно з хворими на ГХ без ХХН (р < 0,05) та практично здоровими особами (р < 0,05). Отримані дані свідчать про те, що адипокіни (лептин, оментин, резистин, вісфатин) відіграють суттєву патогенетичну роль у хворих з гіпертонічною хворобою у поєднанні з хронічною хворобою нирок.
Цель — оптимизация диагностики и оценки хронической болезни почек (ХБП) у больных гипертонической болезнью (ГБ) путем изучения роли адипокинов (лептина, оментина, висфатина, резистина) у больных с гипертонической болезнью в сочетании с хронической болезнью почек. Материалы и методы. В исследование было включено 100 больных гипертонической болезнью II и III степени 2-й стадии, у 51 пациента была диагностирована хроническая болезнь почек. Группу контроля составили 20 практически здоровых лиц. Результаты. Наше исследование показало, что уровни лептина, оментина, резистина и висфатина были значительно выше у пациентов с ГБ в сочетании с ХБП, в отличие от пациентов с ГБ без ХБП и группы контроля. По результатам дисперсионного анализа Краскела — Уоллиса, у больных ГБ в сочетании с ХБП адипокины достоверно коррелировали с систолическим артериальным давлением (АД), диастолическим АД, степенью ГБ, индексом массы тела, липопротеинами низкой плотности, тиреоглобулином, скоростью клубочковой фильтрации, креатинином, конечно-диастолическим размером, индексом относительной толщины стенок, массой миокарда левого желудочка, индексом массы миокарда левого желудочка, наличием диастолической дисфункции, типом диастолической функции. Выводы. У больных с ГБ в сочетании с ХБП отмечается достоверное повышение показателей уровней адипокинов (лептина, оментина, резистина, висфатина) в крови по сравнению с больными ГБ без ХБП (р < 0,05) и практически здоровыми лицами (р < 0,05). Полученные данные свидетельствуют о том, что адипокины (лептин, оментин, резистин, висфатин) играют существенную патогенетическую роль у больных с гипертонической болезнью в сочетании с хронической болезнью почек.
The study aimed at optimization of diagnosis and evaluation of chronic kidney disease (CKD) in hypertensive patients by studying the role of adipokines (leptin, omentin, visfatin, resistin) in patients with hypertension combined with chronic kidney disease. Materials and methods. The study enrolled 100 patients with hypertension of II and III degrees of Stage 2, of which 51 patients were diagnosed with chronic kidney disease. The control group consisted of 20 apparently healthy people. Results. Our study showed that leptin, omentin, resistin, and visfatin levels were significantly higher in patients with essential hypertension (EH) combined with CKD, in contrast to patients with EH without CKD and in the control group. The results of the Kraskel-Wallis dispersion analysis demonstrated that in patients with EH combined with CKD, adipokines significantly correlated with systolic blood pressure (BP), diastolic blood pressure, hypertension degree, body mass index, low-density lipoproteins, thyroglobulin, glomerular filtration rate, creatinine, end-diastolic size, relative wall thickness index, left ventricular myocardial mass, left ventricular myocardial mass index, presence of diastolic dysfunction, type of diastolic function. Conclusions. Hypertensive patients with CKD presented with a significant increase in adipokine levels (leptin, omentin, resistin, visfatin) in the blood compared to patients with EH without CKD (p < 0.05) and apparently healthy individuals (p < 0.05). The data obtained indicate that adipokines (leptin, omentin, resistin, visfatin) have a significant pathogenetic role in patients with hypertension combined with chronic kidney disease.
Вступ
Поширеність гіпертонічної хвороби (ГХ) у поєднанні з хронічною хворобою нирок (ХХН) невпинно зростає з кожним роком. Високий артеріальний тиск (АТ) — основний чинник ризику підвищеної захворюваності та смертності від інсульту, ішемічної хвороби серця (ІХС), серцевої недостатності (СН) та хронічної хвороби нирок. Велика кількість досліджень показали, що ХХН та серцево-судинні захворювання (ССЗ) мають взаємопідсилюючу дію.
Основним завданням для лікарів є вчасне виявлення, лікування та попередження прогресування захворювання. Це дозволить зменшити навантаження на систему охорони здоров’я та збільшити тривалість життя пацієнтів, оскільки загальна смертність від ХХН за останні 10 років зросла на 31,7 % [1].
Для розробки нових методів діагностики й ефективного лікування розвитку ниркових уражень у хворих з коморбідною патологією є необхідним більш детальне розуміння клітинних механізмів виникнення та прогресування цих захворювань [2].
Останніми роками активно вивчається патогенетична роль адипокінів у розвитку та прогресуванні ХХН. Адипоцити — це група поліпептидних гормонів, що синтезуються клітинами жирової тканини, які на центральному та периферичному рівнях регулюють функції різних органів і тканин. Одним із найважливіших ефектів адипокінів у даний час вважається їх патогенетична роль у реалізації системного запалення, що сприяє розвитку ниркових захворювань, ССЗ, інсулінорезистентності та цукрового діабету 2-го типу.
Виявилося, що показники лептину підвищені залежно від стадії ХХН в 4–7,5 раза [3, 4]. При цьому підвищення рівня резистину асоційоване зі зниженням рівня гломерулярної фільтрації і посиленням альбумінурії [5, 6], а вісфатину — з протеїнурією та маркерами запалення [7]. Зниження рівня адипонектину вважається незалежним предиктором погіршення функції нирок на початкових стадіях ХХН [8].
У багатьох осіб ХХН перебігає безсимптомно, проте має прогресуючий та необоротний характер. Саме тому необхідно проводити подальші дослідження у вивченні патогенетичної ролі адипокінів у розвитку ХХН.
Мета: оптимізація діагностики та оцінки хронічної хвороби нирок у хворих на гіпертонічну хворобу шляхом вивчення ролі адипокінів (лептину, оментину, вісфатину, резистину) у даної категорії хворих.
Матеріали та методи
У дослідження було включено 100 хворих на гіпертонічну хворобу ІІ та ІІІ ступеня 2-ї стадії, із них у 51 пацієнта діагностовано хронічну хворобу нирок. Групу контролю становили 20 практично здорових осіб. Групи були співставними за тривалістю ГХ, рівнями систолічного АТ, діастолічного АТ, середнього АТ, частоти серцевих скорочень (ЧСС), індексом маси тіла (ІМТ), спадковістю за артеріальною гіпертензією (АГ) (р < 0,05). Серед обстежених хворих переважали жінки — 58 %, чоловіки становили 42 %. Усі хворі отримували стандартне лікування відповідно до протоколів Міністерства охорони здоров’я України.
Діагноз ГХ був встановлений на підставі клініко-інструментального обстеження згідно з рекомендаціями Української асоціації кардіологів і клінічними рекомендаціями Європейської асоціації гіпертензії та Європейської асоціації кардіологів (2018) [9].
Діагноз ХХН встановлювався згідно з класифікацією хронічних хвороб нирок за клінічними практичними рекомендаціями KDIGO 2018 з діагностики та лікування хронічної хвороби нирок [10, 11].
Підтвердження діагнозу проводили за допомогою лабораторних та інструментальних методів обстеження.
Ехокардіографія (ЕхоКГ) проводилася на ультразвуковому апараті «Philips HDI-11» за загальновизнаною методикою в М- і В-режимах. Крім того, проводили допплер-ЕхоКГ дослідження відповідно до рекомендацій Американського ехокардіографічного товариства. Визначали такі показники: кінцево-діастолічний розмір лівого шлуночка (КДР ЛШ), товщину міжшлуночкової перегородки (ТМШП), товщину задньої стінки лівого шлуночка (ТЗСЛШ), масу міокарда лівого шлуночка (ММЛШ), індекс маси міокарда лівого шлуночка (ІММЛШ), фракцію викиду, розмір лівого передсердя.
Кров на аналізи для вимірювання ліпідного спектра крові (загального холестерину (ЗХС), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), тиреоглобуліну (ТГ)) та біохімічних показників, зокрема швидкості клубочкової фільтрації (ШКФ) та креатиніну, брали після 12-годинного голодування.
З метою визначення гормональної активності жирової тканини хворих визначали адипокіни (лептин, оментин, резистин і вісфатин) імуноферментним сендвіч-методом за допомогою імуноферментного аналізу (набір реактивів виробництва «DBG» (Diagnostcs Biochem Canada)).
Метод засновується на двохетапному імуноферментному аналізі за типом «сендвіч». У наборі були використані високоспецифічні моноклональні антитіла: одні моноклональні антитіла специфічні до лептину, іммобілізовані в лунках мікропланшета, а інші моноклональні антитіла специфічні до іншого епітопу лептину, коньюговані з біотином.
Статистичний аналіз отриманих даних проведено за допомогою програми Statistica 6.0 (StatSoft) та програми Microsoft Exсel 2016. Для оцінки даних використали непараметричний дисперсійний аналіз Краскела — Уолліса. Для встановлення взаємозв’язків кількісних ознак вибіркових даних із сукупностей з ненормальним розподілом застосовували кореляційний аналіз з використанням рангового коефіцієнта кореляції Спірмена. Критичний рівень значущості для всіх перевірених статистичних гіпотез приймався як р < 0,05.
Результати та обговорення
За результатами аналізу основних анамнестичних, гемодинамічних та антропометричних параметрів ми встановили, що групи хворих на ГХ у поєднанні з ХХН та на ГХ без захворювання нирок статистично вірогідно не відрізнялись за такими показниками, як спадковість за АГ, тривалість ГХ, рівні систолічного АТ, діастолічного АТ, середнього АТ, ЧСС, ІМТ (р < 0,05).
Аналізуючи рівні показників адипокінів залежно від ступеня артеріальної гіпертонії, було виявлено, що серед хворих на ГХ 3-го ступеня концентрація адипокінів була вища порівняно з хворими на ГХ 2-го ступеня (р < 0,05) в основній групі та групі контролю.
Кореляційний аналіз показав вірогідний позитивний взаємозв’язок показників рівнів адипокінів з тривалістю ГХ як у хворих на ГХ у поєднанні з ХХН, так і у хворих на ГХ без ХХН (р < 0,05).
В обох групах спостереження рівні адипокінів вірогідно позитивно корелювали з такими гемодинамічними параметрами (р < 0,05), як систолічний АТ, діастолічний АТ, середній АТ та ЧСС.
За даними метааналізу H. Tekce було показано, що підвищення рівнів циркулюючих в крові адипокінів асоціюється з підвищеним ризиком розвитку гіпертензії. Також хворі на ГХ мають вірогідно вищу концентрацію адипокінів, ніж група контролю [12]. Наведені результати наукових експериментів та отримані в нашому дослідженні результати підкреслюють тісний взаємозв’язок адипокінів з патогенетичними механізмами регуляції АТ.
Було показано, що ХХН має суттєвий обтяжуючий вплив на процеси структурно-функціональної перебудови серця у хворих на ГХ. Так, для хворих на ГХ у поєднанні з ХХН характерна більша вірогідність розвитку гіпертрофії лівого шлуночка порівняно з хворими на ГХ без ХХН — 84,3 проти 69,4 % відповідно (р < 0,05). При цьому у хворих на ГХ у поєднанні з ХХН спостерігалось вірогідне підвищення показників ТМШП, ТЗСЛШ, індексу відносної товщини стінок (ІВТС) ЛШ, ММЛШ та ІММЛШ порівняно з хворими на ГХ без ХХН (р < 0,05).
Аналіз характеру змін трансмітрального кровотоку показав більш глибокі порушення діастолічної функції ЛШ у хворих на ГХ та супутньою ХХН порівняно з хворими на ГХ без ХХН. Середнє значення співвідношення Е/А було статистично вірогідно нижчим у хворих на ГХ у поєднанні з ХХН порівняно з хворими на ГХ без ХХН (р < 0,05).
Було показано, що поєднання ГХ з ХХН асоціюється зі збільшенням відсоткової частки хворих з СН, дисліпідемією, гіперкреатинемією та зниженням ШКФ порівняно з групою хворих без ХХН (р < 0,05). При цьому відсоткова частка хворих на ІХС в обох групах вірогідно не відрізнялась (р < 0,05).
Незважаючи на виснажливу дію ХХН на організм, смертність дуже часто обумовлена серцево-судинними ускладненнями, а не кінцевою стадією хронічної недостатності нирок [13]. Для хворих з легкою та помірною стадією ХХН смертність більше пов’язана з серцево-судинними ускладненнями, ніж із нирковою недостатністю. Крім того, клінічно доведено, що ризик розвитку серцево-судинних хвороб зростає за наявності ХХН [14].
Зниження функціональної здатності нирок викликає невпорядковану активацію ренін-ангіотензин-альдостеронової системи та симпатичної нервової системи, внаслідок цього порушується гомеостаз для натрію/води/калію (електролітно-водний баланс), виникає анемія, порушення мінерального обміну — усі ці наслідки ХХН можуть збільшити ризик розвитку ССЗ [15].
У хворих на ГХ у поєднанні з ХХН відмічалися особливості ліпідного обміну у вигляді вірогідного збільшення рівнів ЗХ, ТГ, ХС ЛПНЩ та коефіцієнта атерогенності порівняно з хворими без ХХН (р < 0,05).
При дослідженні функції нирок серед груп хворих на ГХ у поєднанні з ХХН та хворих на ГХ без ХХН було виявлено статистично значущі відмінності в рівнях креатиніну, ШКФ та ступенях зниження ШКФ (р < 0,05).
У хворих на ГХ у поєднанні з ХХН відмічався вірогідний негативний взаємозв’язок рівня ШКФ в крові із ЗХС (r = –0,25, p < 0,05), ТГ (r = –0,31, p < 0,05), ХС ЛПВЩ (r = –0,01, p < 0,05), ХС ЛПНЩ (r = –0,05, p < 0,05), ІМТ (r = –0,27, p < 0,05), тривалістю ХХН (r = –0,29, p < 0,05), креатиніном (r = –0,69, p < 0,05), віком пацієнта (r = –0,34, p < 0,05), лептином (r = –0,40, p < 0,05), оментином (r = –0,36, p < 0,05), вісфатином (r = –0,21, p < 0,05) та резистином (r = –0,20, p < 0,05).
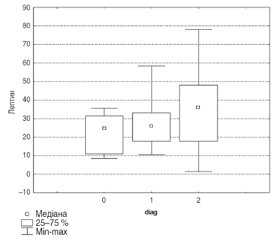
Наше дослідження показало, що рівні лептину, оментину, резистину та вісфатину були значно вищі у пацієнтів з ГХ у поєднанні з ХХН, на відміну від пацієнтів з ГХ без ХХН та групи контролю (р < 0,05). Детальніше ці дані можна розглянути у табл. 2.
За результатами дисперсійного аналізу Краскела — Уолліса, у хворих на ГХ у поєднанні з ХХН адипокіни вірогідно корелювали із систолічним АТ (р < 0,05), діастолічним АТ (р < 0,05), ступенем ГХ (р < 0,01), ІМТ (р < 0,05), ЛПНЩ (р < 0,05), ТГ (р < 0,05), ШКФ (р < 0,05), креатиніном (р < 0,05), КДР (р < 0,05), ІВТС (р < 0,05), ММЛШ (р < 0,05), ІММЛШ (р < 0,05), наявністю діастолічної дисфункції (ДД) (р < 0,05), типом діастолічної функції (р < 0,05).
Показники рівнів адипокінів зростають зі зниженням ШКФ (при ШКФ < 90 мл/хв) у пацієнтів обох груп. Результати нашого дослідження не суперечать даним інших дослідників і підтверджують негативний вплив адипокінів на функціональну здатність нирок.
Зв’язок лептину з функціональною здатністю нирок було показано у пацієнтів з ГХ у поєднанні з ХХН, у яких підвищення показників лептину асоціювалося зі зниженням ШКФ та гіперкреатинемією [16].
Дані нашого дослідження підтверджують цю теорію, оскільки ми встановили, що існує чіткий кореляційний зв’язок між гіперсекрецією лептину та інших адипокінів і зниженням ШКФ та збільшенням рівня креатиніну у пацієнтів з ГХ у поєднанні з ХХН.
Нефродеструктивний механізм дії адипокінів до кінця не вивчений, але припускають, що він пов’язаний з порушенням внутрішньониркової гемодинаміки, інфільтрацією макрофагів у нирках, яка призводить до підвищення кількості цілої низки медіаторів запалення, таких як фактор некрозу пухлини альфа, інтерлейкін-6, С-реактивний білок і фактор, що інгібує міграцію макрофагів [17].
Цікавим, на наш погляд, було дослідити характер взаємозв’язку між лептином, оментином, резистином і вісфатином. Так, у пацієнтів з ГХ лептин мав позитивний кореляційний зв’язок із вісфатином — 0,27, резистином — 0,08 та оментином — 0,23. У пацієнтів з ГХ у поєднанні з ХХН лептин мав позитивний кореляційний зв’язок із вісфатином — 0,26, резистином — 0,32 та оментином — 0,40.
В умовах порушення обміну речовин периваскулярні адипоцити стають дисфункціональними, що призводить до підвищення вироблення адипокінів. У нашій роботі ми досить чітко простежуємо динаміку росту адипокінів у пацієнтів з ГХ у поєднанні з ХХН. Ці дані свідчать про важливу патогенетичну роль адипокінів у розвитку ХХН у хворих з ГХ.
На підставі вказаних взаємозв’язків адипокінів з показниками ліпідного обміну та функціональної здатності нирок можна зробити припущення, що у хворих на ГХ, у яких розвилася ХХН, відмічається компенсаторне збільшення продукції лептину, резистину, вісфатину та оментину.
За коморбідності ГХ та ХХН відмічається збільшення рівнів адипокінів, що може бути компенсаторною реакцією організму на порушення обміну ліпідів. У той же час зі збільшенням тривалості ХХН на фоні ГХ продукція адипокінів виснажується, рівні циркулюючого в крові пептиду знижуються, що погіршує подальші метаболічні порушення у даної категорії пацієнтів.
Висновки
У хворих на ГХ у поєднанні з ХХН відмічається вірогідне підвищення показників рівнів адипокінів (лептину, оментину, резистину, вісфатину) в крові порівняно з хворими на ГХ без ХХН (р < 0,05) та практично здоровими особами (р < 0,05), що свідчить про суттєву патогенетичну роль адипокінів у розвитку ХХН у пацієнтів з ГХ.
У хворих на ГХ у поєднанні з ХХН виявлена позитивна кореляція між показниками рівнів адипокінів (лептину, оментину, резистину, вісфатину) в крові та гемодинамічними параметрами (систолічний АТ, р < 0,05; діастолічний АТ, р < 0,05; середній АТ, р < 0,05) та показниками ремоделювання ЛШ (КДР, р < 0,05; ММЛШ, р < 0,05; ІММЛШ, р < 0,05).
У хворих на ГХ у поєднанні з ХХН найвищі показники рівнів адипокінів (лептину, оментину, резистину, вісфатину) в крові виявляються у пацієнтів із тривалістю гіпертензії більше 10 років (р < 0,05), за ІІІ ступеня ГХ (р < 0,05), за наявності градієнта тиску ЛШ (р < 0,05) та ДД ЛШ (р < 0,05).
У хворих на ГХ у поєднанні з ХХН зі зниженням ШКФ ≤ 90 мл/хв вірогідно зростають показники рівнів адипокінів, а за ШКФ ≤ 60 мл/хв показники рівнів адипокінів стабілізуються. Підвищення показників рівнів адипокінів (лептину, оментину, резистину, вісфатину) свідчить про їх участь у патогенезі порушення функціональної здатності нирок у хворих на ГХ у поєднанні з ХХН. Наявність зв’язків між підвищенням рівнів лептину, оментину, вісфатину та резистину вказує на те, що ці показники є взаємопотенціюючими чинниками у розвитку хронічної хвороби нирок у пацієнтів з гіпертонічною хворобою.
Перспективи подальших досліджень полягають у подальшому вивченні змін показників рівнів адипокінів (лептину, оментину, резистину, вісфатину) та їх ролі у процесі розвитку та прогресування ХХН.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Фінансування роботи відбувалося за власні кошти авторів.
Отримано/Received 02.07.2021
Рецензовано/Revised 12.07.2021
Прийнято до друку/Accepted 21.07.2021

/20.jpg)
/21.jpg)
/21_2.jpg)