Вступ
Минуло 1,5 року з моменту, коли в грудні 2019 року в китайському місті Ухань (провінція Хубей) зафіксували спалах пневмонії, що була викликана досі невідомим збудником. Згодом стало відомо, що вірус передається від людини до людини [10]. Спектр досліджень, присвячених вивченню нового захворювання, змінювався від вивчення збудника [15], шляхів передачі [16], способів лікування [19] до детального вивчення впливу на організм хазяїна [18] і довгострокової реакції організму на вторгнення SARS-CoV-2 [20]. Одним з найактуальніших питань на сьогодні залишається вивчення наявності імунного захисту від нового коронавірусу як у провакцинованих, так і в перехворілих людей.
Відомо, що після більшості інфекцій зберігається гуморальна імунна відповідь, яка дає інформацію про те, що інфекція була, і повинна забезпечити захист при повторному контакті зі збудником. І хоча низка даних вказує на стійку гуморальну імунну відповідь у людей, інфікованих SARS-CoV-2 [5, 6], водночас реєструються випадки повторного інфікування [7, 8].
Поки залишається невизначеним, чи зберігаються після хвороби антитіла — нейтралізуючі або такі, що мають інші функції для боротьби з вірусом [3, 13], як довго зберігається імунна відповідь після перенесеного захворювання, чи є взаємозв’язок між виробленням антитіл і наявністю клінічних проявів хвороби.
Метою нашого дослідження було визначити особливості імунологічної відповіді у перехворілих, а також особливості поведінки моніторингових показників при різних клінічних варіантах захворювання, щоб мати можливість транслювати професійному медичному ринку власні дослідницькі напрацювання.
Низка досліджень показують, що в людей, у яких виробилися антитіла, націлені на рецептор-звязуючий домен (RBD) вірусу вище від певного порогу, були ознаки захисного імунітету [3]. Також, як зазначає старший науковий співробітник Галіт Альтер, професор медицини HMS і Інституту Рагон при MGH, Массачусетському технологічному інституті та Гарварді [3, 4], має значення не просто наявність або відсутність антитіл, а, скоріше, кількість і тип антитіл, які можуть відігравати визначальну роль у розвитку захисної імунної відповіді. Дослідження, проведені серед медпрацівників Великої Британії [13], показали, що рівень позитивних антитіл до нуклеокапсиду IgG SARS-CoV-2 серед медичного персоналу знизився на 31,3 % протягом 3-місячного періоду спостереження.
На відміну від пацієнтів з легким або безсимптомним перебігом інфекції, у тих, хто хворів тяжко, сероконверсія спостерігається більш яскраво і в коротші терміни. У низки пацієнтів наявність антитіл вдається виявити вже до кінця першого тижня хвороби, однак при субклінічному/легкому перебігу інфекції їх утворення може займати кілька тижнів [9]. Деяким людям може знадобитися ще більше часу для вироблення антитіл, а в деяких інфікованих антитіла можуть зовсім не вироблятися [1, 12]. Дослідження, проведене в Ваньчжоу (Китай), також показує, що в безсимптомних осіб імунна відповідь на інфекцію SARS-CoV-2 значно слабша [11].
Імовірно, наявність антитіл до SARS-CoV-2, що викликає COVID-19, може забезпечити захист від повторного зараження вірусом. Але навіть за цих умов ми не знаємо, який захист можуть забезпечити антитіла і як довго цей захист може тривати. Зустрічаються повідомлення про випадки повторного зараження [1].
Матеріали та методи
Об’єктом дослідження в рамках реалізації нашого проєкту були медичні працівники, які перенесли коронавірусну інфекцію протягом останніх 9 місяців, підтверджену тестом полімеразної ланцюгової реакції (ПЛР).
Суб’єкт дослідження — оцінка наявності імунної відповіді після хвороби, а саме наявності імуноглобулінів класу М, націлених на білок S, та імуноглобулінів класу G, націлених як на білок N, так і на білок S.
Наукова новизна. Імунологічна відповідь оцінювалася протягом одного місяця (квітень 2021) у співробітників, які перехворіли в різні терміни (із серпня 2020 по квітень 2021 року), за допомогою тестів, націлених на визначення антитіл до різних мішеней, з визначенням імуноглобулінів обох класів М і G, як у тих, хто мав ПЛР-підтвердження, так і в тих, хто мав тільки клінічні прояви без ПЛР-підтвердження. Також простежено взаємозв’язок вироблення антитіл певних класів з різними мішенями з наявністю певних клінічних проявів.
Методологія
Співробітники, які брали участь в проєкті, дали інформовану згоду на участь (додається) і обробку персональних даних. Збір даних включав: дату фіксації початку захворювання (позитивний ПЛР-тест); дату одужання (негативний ПЛР-тест і/або закінчення клінічних проявів); опис клінічних проявів захворювання, дати й результати тестування на визначення антитіл класу М, націлених на мішень S (шипоподібний білок), антитіл класу G, націлених на мішень N (нуклеокапсидний білок), антитіл класу G, націлених на мішень S.
Методи дослідження
Для проведення ПЛР-тестування виконувалось визначення РНК за методом RT-ПЛР-якісний, що націлений на визначення генів N і RdRp, E, аналізатор CFX96, Bio-Rad.
Для визначення імуноглобулінів класу М — мішень S, класу G — мішень N використовувалася тест-система ABBOTT, аналізатор Architect i2000sr, метод імунохемілюмінесцентного аналізу, напівкількісний.
Для визначення імуноглобулінів класу G — мішень S — тест-система Becman Culter, аналізатор DXI800, метод імунохемілюмінесцентного аналізу, напівкількісний.
Статистичний аналіз
Використано методи описової статистики з визначенням розподілів клінічних характеристик у відсотках (%) і розрахунком середньої арифметичної (M) і стандартного відхилення (SD) для кількісних параметрів. Вірогідність різниці за частотою виявлення позитивних тестів оцінювали за критерієм хі-квадрат. ROC-аналіз використовували для визначення прогностично значимої тривалості значень часових періодів (оптимальний пороговий рівень) від дня встановлення діагнозу, протягом якого виявляється висока частота позитивних тестів Ig. Аналіз тривалості часових періодів, протягом яких зберігається імунна відповідь, проведено за методикою Каплана — Маєра.
Загальна характеристика досліджуваної групи
Усього було проаналізовано результати досліджень 60 співробітників медичної лабораторії «ДІЛА», які перехворіли на коронавірусну хворобу в період із червня 2020 року по березень 2021 року.
Усі учасники дослідження пройшли одномоментне тестування на визначення антитіл протягом квітня 2021 року. На час проходження тестування на антитіла від моменту встановлення діагнозу (позитивного ПЛР-тесту) в середньому минуло 111,7 ± 63,8 дня (від 21 до 307 днів).
За статевим складом: із 60 пацієнтів — 58 (96,7 %) жінок і 2 (3,3 %) чоловіки. Середній вік пацієнтів становив 36,5 ± 10,9 року (від 20 до 65 років).
Тривалість активного періоду захворювання, що визначалася за часом між першим позитивним ПЛР-тестом і другим негативним ПЛР-тестом, становила в середньому 14,8 ± 7,1 дня (від 5 до 43 днів).
Результати
У цілому позитивну імунну відповідь мали 44 (73,3 %) протестовані, а 16 (26,7 %) не мали на момент обстеження жодного позитивного тесту. Це могло бути обумовлено більш тривалим періодом після захворювання в окремих пацієнтів.
На момент обстеження 44 пацієнти (73,3 %) мали імунну відповідь хоча б за одним тестом. У тому числі:
— IgG — мішень S були виявлені в 40 (66,7 %) обстежених;
— IgG — мішень N виявлені у 25 (41,7 %) обстежених;
— IgM — мішень S виявлені в 15 (25 %) обстежених.
При цьому 22 (36,7%) обстежені мали антитіла класу IgG до обох білків коронавірусу — N (нуклеокапсидного) і S (спайкового).
Зіставлення результатів тестування за окремими імуноглобулінами подано в табл. 2–4.
/37_2.jpg)
У цілому збігаючись за оцінками, результати для IgG нейтралізуючих — мішень S та IgM — мішень S становлять 31 (51,7 %). У тому числі збіг негативних результатів тесту виявлено у 18 (30,0 %) і збіг позитивних результатів тесту — у 13 (21,67 %). Клінічний інтерес становлять дискордантні результати тестування. Серед 20 (33,33 %) пацієнтів, які мали негативний тест (< 1) на IgG нейтралізуючі — мішень S, у 18 (30 %) осіб була негативна оцінка за IgM — мішень S, а дискордантні результати виявлено тільки у 2 (3,33 %) випадках. Серед 40 (66,67 %) пацієнтів, які мали позитивний тест (≥ 1) для IgG нейтралізуючих — мішень S, у 2/3 випадків, а саме у 27 (45 %) осіб, встановлено дискордантність оцінок — негативний результат за IgM — мішень S. Дана різниця за дискордантними оцінками в групах негативних і позитивних результатів для IgG нейтралізуючих — мішень S є статистично значимою, і такі результати суттєво частіше виявляються в групі з позитивним результатом за IgG нейтралізуючими — мішень S (р < 0,001 — тест χ2 Мак-Немара з поправкою Єйтса). Слід зауважити, що в цій групі пацієнтів позитивні результати для IgG нейтралізуючих — мішень S, що мали значення понад 1, є досить варіабельними — від 1,06 до 75,4, тому за отриманими результатами не можна зробити висновок про суттєву залежність частоти дискордантних оцінок від рівня показника IgG нейтралізуючих — мішень S.
/38.jpg)
Конкордантність результатів за позитивним результатом свідчить, що в 9 (15 %) осіб визначалися антитіла обох класів одночасно (IgМ — мішень S, IgG — мішень N). Конкордантність результатів за негативним результатом зустрічалась суттєво частіше — у 29 (48,33 %) пацієнтів (p = 0,002 — тест χ2 Мак-Немара). Загальна конкордантність результатів становить 38 (63,3 %).
Дискордантні результати виявлені у 22 (36,67 %) випадках, зокрема негативний за IgМ — мішень S і позитивний за IgG — мішень N були в 16 (26,67 %) осіб, і навпаки, позитивний за IgМ — мішень S і негативний за IgG — мішень N були в 6 (10 %) пацієнтів.
Щодо IgG нейтралізуючих — мішень S і IgG — мішень N спостерігається висока частота збігу результатів — 39 (65,0 %). У тому числі за обома негативними тестами збігається 17 (28,3 %) результатів і за обома позитивними — 22 (36,7 %). Переважна більшість дискордантних результатів для IgG виявляється при позитивному результаті за IgG нейтралізуючими — мішень S і негативному результаті за IgG — мішень N — 18 (30,0 %). 35 % дискордантних результатів свідчить про те, що для отримання повноцінного бачення наявності чи відсутності імунної відповіді внаслідок коронавірусної хвороби важливе визначення антитіл, спрямованих як на мішень S, так і на мішень N.
Програма дослідження передбачала вивчення залежності імунної відповіді від окремих факторів, таких як вік пацієнтів, і тривалості спостереження після захворювання.
Не виявлено суттєвої залежності рівнів IgG нейтралізуючих — мішень S від віку пацієнтів (коефіцієнт кореляції r = 0,191, p > 0,05). Простежується тенденція до вищих рівнів IgG — мішень S у пацієнтів старшого віку. Така тенденція має місце, можливо, за рахунок того, що старші пацієнти тяжче переносили захворювання і в результаті мали тенденцію до вищих показників.
Разом з тим виявлено залежність частоти позитивних тестів для IgG (мішень N) та IgM (мішень S) від тривалості періоду після захворювання. Реалізація даної оцінки проведена за допомогою ROC-аналізу, який дозволив визначити оптимальний часовий період для виявлення позитивного тесту для IgG і IgM. Перевищення даного періоду супроводжується зміною пропорції позитивних і негативних результатів зі значним зменшенням частоти позитивних тестів.
Щодо частоти негативних результатів IgM — мішень S у різні періоди спостереження має місце порівняльний розподіл результатів для періоду до і після 119 днів. Основна різниця формується за рахунок суттєвого зменшення позитивних результатів IgM — мішень S у період після 4 місяців спостереження. Оцінка визначення порогового періоду для моделі розподілу результатів для IgM — мішень S є статистично не значимою — AUC (area under ROC curve — площа під ROC-кривою) = 0,623; р = 0,169. Оцінка порогового періоду 133 дні для позитивної імунної відповіді за IgG — мішень N має більш чіткий розподіл пропорцій позитивних і негативних результатів і є статистично не значимою — AUC = 0,769; р < 0,001. До 133 днів після встановлення діагнозу суттєво переважають позитивні тести IgG — мішень N і спостерігається різке зниження їх частоти при збільшенні періоду спостереження. Розподіл за частотою виявлення позитивних результатів IgG та IgМ відносно порогових значень тривалості спостереження після встановлення діагнозу COVID-19 наведено в табл. 5.
/39_2.jpg)
Отримані результати свідчать, що оптимальний період збереження імунної відповіді (високої частоти позитивних тестів) для IgG — мішень N становить до 133 днів з моменту встановлення діагнозу (р = 0,0001), а для IgM — мішень S — 119 днів (р = 0,169).
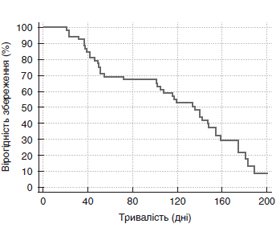
Отримані результати щодо тривалості імунної відповіді за окремими тестами в цілому підтверджені узагальненою оцінкою тривалості збереження імунної відповіді за всіма досліджуваними тестами (метод Каплана — Маєра).
Встановлено, що вірогідність збереження імунної відповіді в термін до 200 днів становить тільки 8,8 %. Медіана періоду збереження імунної відповіді (вірогідність збереження відповіді в 50 % пацієнтів) становить 136 (95% довірчий інтервал 102–154) днів.
Наступним етапом дослідження стало вивчення частоти виявлення окремих клінічних проявів захворювання (симптоматики) і зіставлення цих даних з частотою виявлення позитивних тестів для IgG — мішень S, IgG — мішень N, IgM — мішень S. Результати подано в табл. 6.
Суттєво вища частота асоційованості клінічної симптоматики і позитивних тестів характерна для IgG — мішень S — 40 (66,7 %), зниження асоційованості позитивних тестів і клінічних проявів відбувається для IgG — мішень N — 25 (41,7 %), ще нижче — для IgM — мішень S — 15 (25,0 %), р = 0,001. Ця різниця обумовлена зниженням клінічної симптоматики на більш пізніх періодах захворювання. Варіабельність клінічного перебігу захворювання обумовила проведення оцінки вираженості клінічної симптоматики за кількістю симптомів (від відсутності клінічних проявів до 1–2–3 і більше клінічних симптомів різного ступеня вираженості). Слід зауважити, що найбільший відсоток продукції антитіл усіх класів спостерігається в пацієнтів з ознаками ураження легень. Узагальнена оцінка за поєднанням клінічних симптомів наведена в табл. 7.
/40.jpg)
Не виявлено асоціації частоти позитивних результатів за окремими імуноглобулінами й кількості зареєстрованих клінічних симптомів (р = 0,928). Навіть у пацієнтів без клінічної симптоматики антитіла до COVID-19 виявлялись майже з такою ж частотою, як і за наявності клінічних проявів. Проте, на нашу думку, дане питання потребує додаткового вивчення за періодами динамічного спостереження і тривалістю клінічних проявів. Також слід зауважити, що всі групи антитіл виявлялися частіше при поєднанні 3 і більше симптомів. Що ж до визначення нейтралізуючих антитіл IgG з мішенню S, то вони детектувалися частіше в усіх зазначених групах і в групі безсимптомних пацієнтів.
Висновки
1. У 73,33 % перехворілих визначалась імунна відповідь, що зберігалася в середньому 4–4,5 місяця від моменту отримання позитивного ПЛР-тесту.
2. Оптимальний період збереження високої частоти позитивних тестів з моменту встановлення діагнозу становить: для IgG — до 133 днів (р = 0,0001), для IgM — 119 днів (р = 0,169).
3. Усупереч сталому твердженню, що антитіла IgМ виводяться набагато швидше, ніж IgG, наше дослідження показало, що обидва класи антитіл мають близький період збереження високої частоти позитивних тестів і елімінують з невеликою різницею в часі (приблизно в 14 днів).
4. Майже 9 % перехворілих зберігають імунну відповідь понад 6 місяців.
5. У 3 % пацієнтів імунна відповідь зберігається до 9 місяців після захворювання.
6. Не виявлено вікової залежності рівня імунної відповіді. Однак є тенденція до вищих показників IgG нейтралізуючих у пацієнтів старшого віку, що, можливо, пов’язано з більш тяжким перебігом захворювання.
7. Виявлена чітка залежність вираженості клінічних проявів і визначення антитіл IgM та IgG до обох мішеней. Проте слід зауважити, що 21 (35,0 %) безсимптомний пацієнт також мав імунну відповідь.
8. У перехворілих пацієнтів як із клінічною симптоматикою, так і без неї частіше визначалися антитіла до шипоподібного білка SARS-CoV-2, ніж до нуклеокапсидного.
9. У пацієнтів, які мали клінічні прояви, ця різниця значно вище на користь нейтралізуючих антитіл.
10. Для точної діагностики імунної відповіді необхідно використовувати тести, спрямовані на визначення антитіл до обох білків-мішеней SARS-CoV-2, як до шипоподібного, так і до нуклеокапсидного, оскільки дискордантність за різними мішенями становить 35,0 %.
11. Для оцінки імунної відповіді актуальним є використання методів діагностики, спрямованих на визначення не тільки IgG, але й IgМ у комплексі або шляхом визначення сумарнх антитіл, що дасть більш точне уявлення про наявність чи відсутність імунної реакції організму на вторгнення збудника.
Перспективи дослідження: у подальшому планується порівняти дані, отримані в поданому дослідженні, з даними дослідження імунної відповіді у вакцинованих співробітників.
Конфлікт інтересів. Не заявлений.
Додатки:
1. Інформована добровільна згода пацієнта на збір та обробку результатів лабораторних досліджень.
2. Інформована добровільна згода пацієнта на розкриття інформації, що містить лікарську таємницю.
Отримано/Received 03.06.2021
Рецензовано/Revised 18.06.2021
Прийнято до друку/Accepted 25.06.2021
/37.jpg)
/38.jpg)
/39.jpg)

/37_2.jpg)
/38_2.jpg)
/39_2.jpg)
/40.jpg)
/41.jpg)