За даними Всесвітньої організації охорони здоров’я, патологічні стани ротової порожнини (карієс, хвороби пародонта, рак порожнини рота, інфекційно-запальні ураження ротової порожнини, травми щелепно-лицевої ділянки) становлять серйозний тягар для системи охорони здоров’я і впливають на загальний стан організму людини, спричиняючи біль, дискомфорт, порушення якості життя. За оцінками ВООЗ, близько 3,5 мільярда людей страждають від захворювань порожнини рота. Від генералізованого пародонтиту, тяжкого захворювання, що може призвести до передчасної втрати зубів, страждає майже 10 % світового населення [16], а в Європі приблизно 40 % населення щороку звертається за медичною допомогою з легкими та тяжкими формами захворювань пародонта [12].
Хронічний запальний процес в тканинах пародонта не лише впливає на стоматологічне здоров’я, а і призводить до розвитку системної прозапальної реакції організму людини. Патогенні мікроорганізми ротової порожнини через ушкоджений епітелій слизової оболонки, пародонтальних карманів потрапляють до системного кровообігу й на тлі системної прозапальної реакції організму спричиняють дисфункцію ендотелію судин. Численні епідеміологічні дослідження, результати наукових досліджень як вітчизняних, так і закордонних учених показали тісний взаємозв’язок між наявністю пародонтиту та перебігом системних захворювань, таких як ревматоїдний артрит, цукровий діабет, метаболічні (у тому числі ожиріння) та легеневі захворювання, інсульт та серцево-судинні захворювання, захворювання нервової системи та несприятливі наслідки вагітності, запальні захворювання кишечника, цироз печінки та рак підшлункової залози [10, 12].
З огляду на те, що в етіології хвороб пародонта значну роль відіграють інфекційні чинники, питання антибактеріальної терапії є надзвичайно актуальним. Доцільність як локальної, так і системної антибіотикотерапії має бути розглянута з урахуванням ризику розвитку мікробної резистентності, а також негативного впливу на мікробіом людини, особливо з огляду на емпіричний та екстенсивний характер використання антибіотиків при лікуванні або профілактиці інфекцій не тільки порожнини рота, а й організму в цілому.
Мікробіом порожнини рота
Сукупність мікроорганізмів організму людини називається мікробіотою та описує екологічне співтовариство симбіотичних, коменсалів та патогенних мікроорганізмів. Складна органна структура мікробіому через широкий ферментативний спектр має мультифункціональні властивості та взаємодіє з органами та системами людини, впливає на фізіологічні функції, гомеостаз, імунну та метаболічну активність тканин.
Мікробіом ротової порожнини визначається як колективний геном (повний набір ДНК, що включає всі його гени) мікроорганізмів, що мешкають у ротовій порожнині. Ротова порожнина є складним і не-однорідним мікробним середовищем для існування. З одного боку, слина містить поживні речовини для мікробів (але в невисоких концентраціях), а з іншого — в ній містяться речовини антибактеріальної природи (лізоцим, лактопероксидаза та інші). Однак залишки їжі та клітин забезпечують високі концентрації поживних речовин поблизу поверхонь ясен та зубів, створюючи тим самим сприятливі умови для локального мікробного росту. Місцями колонізації мікробів є зуби, ясенна борозна та пародонтальні кармани, ясна, язик, щоки, мигдалини, губи, тверде та м’яке піднебіння. В неоднорідних екологічних системах цих ділянок підтримується ріст відмінних між собою мікробних спільнот [9, 10, 13].
У порожнині рота міститься друга за різноманітністю мікробна спільнота, що заселяє організм людини. За підрахунками, у середньому 774 різні види бактерій (загалом 392 таксони) можуть колонізувати ротову порожнину дорослих, а загальний геном орального мікробіому наближається до 1500 [9, 10, 13]. Майже вісім сотень видів прокаріотів ротової порожнини належать до 185 родів та 12 типів, із яких 54 % офіційно названі, 14 % не мають назв (але культивуються), а 32 % відомі лише як необроблені філотипи. Серед 12 типів представлені: Firmicutes, Fusobacteria, Proteobacteria, Actinobacteria, Bacteroidetes, Chlamydiae, Chloroflexi, Spirochaetes, SR1, Synergistetes, Saccharibacteria (TM7) та Gracilibacteria (GN02). Основні шість типів — Firmicutes, Actinobacteria, Proteobacteria, Fusobacteria, Bacteroidetes та Spirochaetes становлять 96 % усіх бактерій ротової порожнини [9]. За даними інших авторів, кількість типів бактерій є вищою, на додаток до вищеназваних виділяють такі типи бактерій: Euryarchaeota, Tenericutes, OD2 та Cyanobacteria [8].
Основними родами бактерій, що виявлені в здоровій порожнині рота, є грампозитивні коки (Abiotrophia, Peptostreptococcus, Streptococcus, Stomatococcus), грампозитивні палички (Actinomyces, Bifidobacterium, Corynebacterium, Eubacterium, Lactobacillus, Propio-nibacterium, Pseudoramibacter, Rothia), грамнегативні коки (Moraxella, Neisseria, Veillonella) та грамнегативні палички (Campylobacter, Capnocytophaga, Desulfobacter, Desulfovibrio, Eikenella, Fusobacterium, Hemophilus, Leptotrichia, Prevotella, Selemonas, Simonsiella, Treponema, Wolinella). У ротовій порожнині діагностують представників сапрофітних найпростіших (Entamoeba gingivalis Trichomonas tenax) та гриби (Candida, Cladosporium, Aureobasidium, Saccharomycetales, Aspergillus, Fusarium та Cryptococcus), а також археї та віруси [9].
Мікроорганізми, що заселяють порожнину рота, утворюють високорегульовані, структурно та функціонально організовані спільноти, прикріплені до поверхонь як біоплівки. Зубний наліт — це структурно та функціонально організована біоплівка, що складається з сотень видів бактерій, полімерів та позаклітинних продуктів життєдіяльності мікробів та міцно прикріплена до поверхонь ротової порожнини шляхом селективної адгезії через систему розпізнавання на бактеріальних поверхнях. Переважними мікроорганізмами над’ясенного зубного нальоту є грампозитивні факультативно анаеробні бактерії (особливо види Actinomyces sp., Streptococcus sp. та Capnocytophaga sp.) та грамнегативні (Veillonella sp., Prevotella sp., Porphyromonas gingivalis та Tannerella forsythia). Склад під’ясенного нальоту вивчений більш ретельно, оскільки під’ясенні зубні відкладення беруть участь у захворюваннях пародонта, та переважно включає такі види: Streptococcus sp., Prevotella denticola, Porphyromonas endodontalis та Porphyromonas gingivalis [13].
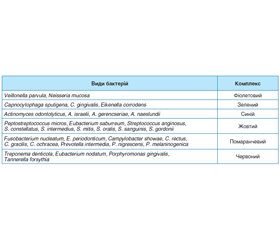
Після дослідження понад 13 000 зразків під’ясенного нальоту від 185 досліджуваних кластерним аналізом були виявлені 32 таксони, які класифікували в шість специфічних груп мікроорганізмів (табл. 1). Ці групи позначені кольорами для полегшення орієнтації. Бактерії фіолетового, жовтого та зеленого комплексу відповідають здоров’ю пародонта; бактерії переважно червоного комплексу, а також помаранчевого комплексу разом з іншими некласифікованими видами є ймовірними збудниками запальних захворювань пародонта [13, 19].
Із метою аналогічного спрощення класифікації таксонів над’ясенного нальоту було досліджено майже 5000 зразків від 187 осіб, що дозволило виділити 40 таксонів, які також класифікували у шість специфічних груп мікроорганізмів (табл. 2).
Між мікроорганізмами ротової порожнини існує симбіотичний зв’язок, причому коменсальні популяції не завдають шкоди макроорганізму й підтримують контроль за патогенними видами, запобігають їх адгезії до слизової оболонки. Порушення балансу ротової екосистеми призводить до дисбіозу, при якому може розвинутися низка захворювань (карієс, пародонтит тощо). Бактерії стають патогенними лише після того, як вони долають бар’єр коменсалів, викликаючи інфекційну патологію [9, 13].
Зміни мікробіому при хворобах пародонта
Пародонтит — це хронічне багатофакторне інфекційно-запальне захворювання тканин пародонта, що пов’язане зі зміною бактеріальної конституції біоплівки (дисбіозом) зубних відкладень та складною взаємодією між мікроорганізмами та імунною системою людини. При пародонтиті частка сапрофітних бактерій ротової порожнини зменшується внаслідок надмірного росту пародонтальних патогенних бактерій ротової біоплівки. Вони в основному є грамнегативними (включаючи Porphyromonas gingivalis, Treponema denticola та Tannerella forsythia) і відповідають за початок високоспецифічної, а іноді й агресивної прозапальної реакції [12]. Висока концентрація прозапальних цитокінів у пародонті безпосередньо спричиняє втрату кісткової тканини альвеолярного відростка [13]. Збудники пародонтиту можуть бути тісно пов’язані з періімплантитом, якому притаманна гетерогенна змішана інфекція. При періімплантиті в пацієнтів виділяють анаероби Eubacterium minutum та Prevotella intermedia [10]. Саме тому в лікуванні пародонтиту та періімплантиту використовується системна антибіотикотерапія для впливу на пародонтопатогени [12].
Серед грамнегативних анаеробних бактерій слід відмітити підвищену частоту сульфатредукуючих бактерій (SRB) у порожнині рота хворих на пародонтит. SRB зустрічаються в ротовій порожнині приблизно в 10 % здорових людей. У пацієнтів із пародонтитом частота їх виявлення значно вища, досягає 86 % і пов’язана зі збільшенням глибини пародонтальних карманів, у яких створюються анаеробні умови. SRB — гетерогенна група мікроорганізмів, які мають здатність дисимілюючого відновлення сульфату до сірководню (H2S), що є високотоксичним агентом (який спричиняє пошкодження клітин аналогічно ціаніду) із негативними ефектами внаслідок інактивації цитохромоксидази, мієлопероксидази та каталази. Цитохромоксидаза — трансмембранний білок мітохондрій, останній фермент у дихальному електронному транспортному ланцюзі, при блокуванні якого кисень не може зв’язуватися з ним, що призводить до неможливості синтезу АТФ і виробництва енергії. Сірководень також має здатність розщеплювати дисульфідні зв’язки в білках, реагувати з ними та зв’язувати іони металів, що впливає на можливість гранулоцитів опсонізувати мікроорганізми та призводить до пригнічення імунної відповіді в пародонтальному кармані [13].
Особливості мікробіому при періодонтиті
Інфекційна природа апікального періодонтиту пов’язана переважно з анаеробними мікроорганізмами. На початкових фазах інфекційного процесу в пульпі переважають факультативні анаеробні бактерії, а через кілька днів або тижнів при некрозі та відсутності кровопостачання пульпи припиняється постачання кисню. Після споживання залишків кисню факультативними бактеріями розвивається анаеробне середовище з низьким окиснювально-відновним потенціалом, яке значною мірою сприяє виживанню та зростанню облігатних анаеробних бактерій. Із плином часу поглиблюються анаеробні умови, особливо в апікальному сегменті кореневого каналу зуба, і в пацієнтів із первинним верхівковим періодонтитом виділяють по кілька видів анаеробних бактерій [17].
При ендодонтичних інфекціях виявлені понад 500 різних видів бактерій дев’яти із 13 типів, що мають пероральних представників, а саме: Bacteroidetes, Firmicutes, Spirochaetes, Fusobacteria, Actinobacteria, Proteobacteria, Synergistetes, Candidatus saccharibacteria (раніше TM7) і SR1.
До анаеробних збудників апікального періодонтиту відносять [17]:
1. Грамнегативні палички:
— Dialister;
— Porphyromonas;
— Tannerella;
— Prevotella;
— Alloprevotella;
— Fusobacterium;
— Campylobacter;
— Fretibacterium;
— Pyramidobacter;
— Selenomonas.
2. Грамнегативні коки:
— Veillonella;
— Megasphaera.
3. Грамнегативні спірохети:
— Treponema.
4. Грампозитивні палички:
— Actinomyces;
— Pseudoramibacter;
— Filifactor;
— Peptostreptococcaceae (Eubacterium);
— Mogibacterium;
— Propionibacterium;
— Eggerthella;
— Olsenella;
— Atopobium;
— Solobacterium.
5. Грампозитивні коки:
— Parvimonas;
— Peptostreptococcus;
— Anaerococcus;
— Streptococcus;
— Gemella.
Патогенні мікроорганізми кореневого каналу різноманітні за видовим складом та мають відмінності в різних пацієнтів. Навіть два інфіковані зуби в однієї людини мають різні мікробні профілі. Це вказує на те, що апікальний періодонтит має неоднорідну етіологію з множинними видовими комбінаціями [17]. Антибактеріальна терапія апікального періодонтиту обов’язково має супроводжуватись ендодонтичним лікуванням [4].
Комплексний підхід у лікуванні хвороб пародонта
Для досягнення оптимальних результатів лікування пародонтиту необхідне застосування інструментальних методів обробки поверхні коренів зубів, хірургічних методів лікування захворювань тканин пародонта в поєднанні з медикаментозною протимікробною терапією, гігієною порожнини рота. У пародонтології використовують протимікробні препарати місцево у вигляді аплікацій, дентальних вкладок та/або системно. Перевагою системного застосування антибактеріальних препаратів (АБП) є висока концентрація діючої речовини в плазмі крові, ясенній, ротовій рідинах, у тканинах пародонта, що забезпечує високу антибактеріальну ефективність щодо пародонтопатогенів. Призначення системної антибактеріальної терапії відіграє особливу роль у лікуванні тяжких та агресивних форм захворювань тканин пародонта для ефективної елімінації під’ясенних патогенів, що залишаються в складнодоступних для інструментальної обробки ділянках пародонта, глибоких (більше ніж 6 мм) пародонтальних карманах, зонах фуркації коренів зубів, у грануляційній тканині пародонтальних карманів після проведеної консервативної пародонтологічної терапії [1].
Щодо критеріїв вибору саме антибактеріального препарату для системної терапії необхідно враховувати його здатність впливати як на грампозитивні, так і на грамнегативні анаеробні мікроорганізми. Установити чутливість мікроорганізмів до АБП шляхом культивування анаеробних мікроорганізмів із виділенням патологічного збудника від хворого та лабораторним визначенням його чутливості до антибіотиків дуже складно [6, 21]. Вибір препарату для системного застосування є емпіричним, але відомо, що анаеробні інфекції є полімікробними та часто супроводжуються надмірним супутнім зростанням аеробних та факультативних мікроорганізмів. Тому обраний варіант терапії повинен перекривати всі названі патогени [5].
Доцільність застосування антибіотиків у стоматології та пародонтології має бути критично оцінена, особливо з урахуванням додаткової довгострокової користі, можливих побічних реакцій, що можуть виникнути в пацієнта [6, 12].
У цьому контексті показання для призначення АБП при лікуванні захворювань порожнини рота та пародонта мають бути чітко окреслені [2].
Показання до застосування АБП у стоматології [2]:
— генералізований пародонтит у стадії загострення з вираженим запально-деструктивним компонентом у вигляді абсцесів, гноєтечі, прогресуючої деструкції кісткової тканини альвеолярного відростка та агресивним перебігом захворювання;
— генералізований пародонтит у підлітків та осіб молодого віку; локалізований пародонтит, швидкопрогресуючий пародонтит;
— генералізований пародонтит у пацієнтів із тяжкою супутньою патологією, коли лікувальні маніпуляції можуть ускладнити перебіг основного захворювання (ревматоїдний артрит, ендокардит, клапанна патологія серця);
— пародонтит, рефрактерний до традиційного пародонтологічного лікування;
— застосування до і після оперативного втручання на тканинах пародонта у хворих із коморбідними станами;
— періімплантит у стадії загострення;
— тяжкий перебіг виразково-некротичного гінгівіту (як прояв системного захворювання);
— тяжкий перебіг гінгівіту (як прояв системного захворювання);
— гострий апікальний абсцес у медично скомпрометованих пацієнтів та хворих зі зниженим імунітетом;
— гострий апікальний абсцес із системною участю (із флуктуацією, підвищенням температури тіла > 38 °C, загальною слабкістю, лімфаденопатією (збільшенням лімфатичних вузлів), тризмом);
— прогресуючі інфекції (швидкий початок — менше ніж через 24 год і тяжкий перебіг інфекції, остеомієліт), при яких може виникнути потреба в консультації щелепно-лицевого хірурга;
— реплантація постійних зубів;
— травма м’яких тканин, що потребує оперативного втручання (наприклад, накладання швів, хірургічної обробки рани).
Питання вибору конкретного препарату серед різноманіття антибактеріальних лікарських засобів є досить складним, щоб антибіотикотерапія була дійсно етіотропною і, як наслідок, ефективною. Для цього необхідне розуміння мікробіологічних особливостей ротової порожнини в нормі та при патології.
Клінічна ефективність основних антибактеріальних засобів, що використовуються в стоматології
До АБП, що активні проти анаеробної інфекції, відносять β-лактамні антибіотики та їх комбінації з інгібіторами β-лактамаз, похідні імідазолу (метронідазол та тинідазол), хлорамфенікол, кліндаміцин, макроліди, тетрацикліни, карбапенеми та фторхінолони. Але реальний вибір АБП не є таким великим, адже все частіше публікуються повідомлення про генетичну здатність анаеробів продукувати ферменти, що спричиняють резистентність до карбапенемів, метронідазолу, хлорамфеніколу, еритроміцину, тетрацикліну [7].
Препаратом, що демонструє активність проти анаеробних мікроорганізмів та з успіхом використовується в клінічній медицині з 1962 року, є метронідазол, похідне імідазолу. Його застосовують і як протипротозойний препарат. Широке використання препарату в медицині взагалі і стоматології зокрема сприяло формуванню резистентності до нього з боку пародонтопатогенів [15]. Інший препарат з групи похідних імідазолу — тинідазол — за своєю протимікробною активністю не поступається метронідазолу. При вивченні чутливості бактерій анаеробного червоно-помаранчевого комплексу патогенів пародонта було встановлено їх стійкість до граничних концентрацій доксицикліну, амоксициліну та кліндаміцину та задовільну чутливість до тинідазолу та метронідазолу при порогових концентраціях 16 мг/л [14].
Тинідазол демонструє адекватну антимікробну активність щодо анаеробних бактерій і найпростіших, подібну або більшу, ніж у метронідазолу, і має фармакокінетичні властивості, що забезпечують його біодоступність у сироватці крові та в тканинах ясен і пародонта на терапевтичних рівнях навіть при пероральному дозуванні один раз на добу, що має перевагу порівняно з метронідазолом. Метронідазол для системного застосування необхідно приймати тричі на добу протягом 7–14 днів, і комплаєнс при такому режимі дозування становить всього 56 % [18]. Тинідазол має 12–14-годинний період напіввиведення з сироватки крові, що приблизно вдвічі більше, ніж у метронідазолу, що дозволяє рідше дозувати препарат. Після прийому одноразової пероральної дози 2 г у 10 дорослих із середньою та тяжкою формою пародонтиту через 24 години були виявлені середні концентрації 13 мг/л тинідазолу у тканинах пародонта, що забезпечує стійкий антимікробний ефект тинідазолу проти анаеробних пародонтопатогенів у під’ясенних ділянках. У роботі з вивчення ефективності системної протимікробної терапії, призначеної як доповнення до нехірургічного пародонтального інструментального втручання в пацієнтів із пародонтитом, показано, що застосування тинідазолу забезпечує значно вищу ефективність порівняно з метронідазолом (73,1 проти 43,5 %) [14].
При тяжкому перебігу пародонтиту, коли має місце високий рівень колонізації як анаеробних, так і факультативних патогенних мікроорганізмів (наприклад, анаеробні червоно-помаранчевого комплексу та факультативні S. constellatus та/або Aggregatibacter actinomycetemcomitans), показане комбіноване застосування тинідазолу з іншим антибіотиком із метою розширення протимікробного спектра системної терапії [18].
Одним із найбільш ефективних варіантів комбінації нітроімідазольного похідного з іншими антибіотиками є поєднання тинідазолу з ципрофлоксацином. Це зумовлене оптимальними властивостями ципро-
флоксацину вибірково впливати на збудників змішаної інфекції без пригнічення більшості грампозитивних бактерій, що сприяє реколонізації пародонтальних карманів факультативною мікрофлорою з низькою патогенністю. Застосування системної комбінованої антибіотикотерапії в лікуванні агресивних форм генералізованого пародонтиту дозволяє розширити спектр протимікробної терапії на патогенну під’ясенну мікрофлору, зменшити дозування та тривалість застосування лікарського засобу за рахунок синергічної дії двох антибактеріальних препаратів [1]. Так, за результатами клінічних досліджень щодо лікування ускладнених інфекцій черевної порожнини, ципрофлоксацин із метронідазолом мали однакову ефективність з іншими лікувальними режимами, такими як іміпенем/циластатин та піперацилін/тазобактам [20]. Але останні два варіанти терапії передбачають виключно інфузійний шлях введення, тому можливість застосування перорального ципрофлоксацину з тинідазолом (який за ефективністю щодо пародонтопатогенів не поступається метронідазолу) в стоматології є перспективною.
Висока клінічна ефективність застосування комбінованої антибактеріальної терапії в комплексному лікуванні генералізованого пародонтиту, вірогідне зменшення гноєтечі, глибини пародонтальних карманів, редукція інфекційно-запальних процесів у тканинах пародонта в подальшому сприяє стабілізації захворювання та дозволяє зменшити ймовірність загострень, що суттєво знижує ризик розвитку резистентності мікроорганізмів до протимікробних лікарських засобів [1].
Перевагою призначення комбінованої терапії ципрофлоксацином та тинідазолом є наявність комплексного препарату, що містить обидві молекули діючих речовин в одній таблетці — Ципролет® А. Препарат призначається по 1 таблетці 2 рази на день. Зазвичай курс лікування при гострих інфекціях становить 5–7 днів, але в разі лікування хронічних рецидивуючих інфекцій курс лікування становить 10–14 днів. Ефективність системної антибактеріальної терапії генералізованого пародонтиту препаратом Ципролет® А була вивчена в пацієнтів із цукровим діабетом. Пацієнти основної групи отримували місцеву протизапальну, антибактеріальну терапію та Ципролет® А для системної антибактеріальної терапії, пацієнти контрольної групи — тільки місцеву терапію. Застосування препарату Ципролет® А забезпечило ослаблення мікробного обсіменіння пародонтальних карманів майже у три рази, зниження загальної мікробної забрудненості порожнини рота на 40 %, відновлення нормального мікробіоценозу порожнини рота. Особливо чітко проявився антибактеріальний ефект щодо ротової трихомонади та грибів роду Candida. Клінічні та лабораторні показники в основній групі були у два рази кращими, ніж у контрольній. Додавання системного антибактеріального препарату Ципролет® А сприяло стимуляції місцевих захисних факторів у порожнині рота, високому протизапальному ефекту, що дозволило прогнозувати збільшення термінів ремісії генералізованого пародонтиту в пацієнтів із цукровим діабетом [3].
Таким чином, призначення системних АБП для лікування захворювань пародонта має відбуватися відповідно до показань та супроводжуватися адекватною місцевою терапією. Вибір препарату для системної антибактеріальної терапії ґрунтується на розумінні полімікробної природи інфекційного процесу в ротовій порожнині з урахуванням чутливості/стійкості мікроорганізмів до АБП. Одним з оптимальних варіантів системної антибактеріальної терапії в стоматології є комбінований препарат ципрофлоксацину та тинідазолу широкого спектра дії з ефективністю проти анаеробних збудників та зручними для пацієнта формою випуску та режимом дозування.
Конфлікт інтересів. Публікацію підготовлено за підтримки компанії Dr. Reddy’s Laboratories Ltd. для надання професійної інформації спеціалістам з охорони здоров’я. Погляди, наведені в матеріалі, відображають думку автора-експерта та можуть не збігатися з іншими доказовими даними медицини. Будь ласка, ознайомтеся з повним текстом інструкцій для медичного застосування лікарських засобів, що розглядаються в даній публікації, перед призна-ченням.
Отримано/Received 01.02.2021
Рецензовано/Revised 18.02.2021
Прийнято до друку/Accepted 26.02.2021
Список литературы
1. Мазур І.П., Супрунович І.М., Слободяник М.В., Ананьєва А.В. Комбінована антибактеріальна терапія в комплексному лікуванні генералізованого пародонтиту. Дентаклуб. 2020. № 5. С. 33-38.
2. Мазур І.П., Юнакова Н.М., Хлебас С.В. Протимікробна терапія в стоматології. Методичні рекомендації. Денталклуб. 2020. № 4. С. 32-37.
3. Сидельникова Л.Ф., Дикова И.Г., Захарова С.М. Обоснование и оценка эффективности системной антибактериальной терапии генерализованного пародонтита у пациентов с сахарным диабетом. Сучасна стоматологія. 2020. № 3. С. 28-30. DOI: 10.33295/1992-576X-2020-3-28.
4. AAE Guidance on the Use of Systemic Antibiotics in Endodontics. Available from: https://www.aae.org/specialty/wp-content/uploads/sites/2/2017/06/aae_systemic-antibiotics.pdf (last accessed 01.12.2020).
5. Brook I. Antimicrobials therapy of anaerobic infections. J. Chemother. 2016. Vol. 28(3). P. 143-50. doi: 10.1179/1973947815Y. 0000000068.
6. Brook I. Spectrum and treatment of anaerobic infections. Journal of Infection and Chemotherapy. 2016. Vol. 22. Іssue 1. P1-13. DOI: https://doi.org/10.1016/j.jiac.2015.10.010.
7. Brook I., Wexler H.M., Goldstein E.J.C. Antianaerobic Antimicrobials: Spectrum and Susceptibility Testing. Clinical Microbiology Reviews. 2013. Vol. 26(3). P. 526-546. DOI: 10.1128/CMR.00086-12.
8. Chen H., Jiang W. Application of high-throughput sequencing in understanding human oral microbiome related with health and disease. Frontiers in Microbiology. 2014. Vol. 5. P. 508. DOI: 10.3389/fmicb.2014.00508.
9. Deo P.N., Deshmukh R. Oral microbiome: Unveiling the fundamentals. J. Oral Maxillofac. Pathol. 2019. Vol. 23(1). P. 122-128. doi: 10.4103/jomfp.JOMFP_304_18.
10. Gao L., Xu T., Huang G., Jiang S., Gu Y., Chen F. Oral microbiomes: more and more importance in oral cavity and whole body. Protein Cell. 2018. Vol. 9(5). P. 488-500. doi: 10.1007/s13238-018-0548-1.
11. Haajee A.D., Socransky S.S., Patel M.R., Song X. Microbial Complexes in Supragingival Plaque. Oral Microbiol. Immunol. 2008. Vol. 23. P. 196-205. https://doi.org/10.1111/j.1600-051X.1998.tb02419.x.
12. Isola G. Antibiotics and Antimicrobials for Treatment of the Oral Microbiota: Myths and Facts in Research and Clinical Practice. Antibiotics. 2020. Vol. 9. P. 95. doi: 10.3390/antibio-tics9020095.
13. Kushkevych I., Coufalová M., Vítězová M., Rittmann S.K.-M.R. Sulfate-Reducing Bacteria of the Oral Cavity and Their Relation with Periodontitis — Recent Advances. J. Clin. Med. 2020. Vol. 9(8). P. 2347. https://doi.org/10.3390/jcm9082347.
14. Lin D.L. In vitro resistance of human periodontal anaerobic bacterial pathogens to tinidazole versus metronidazole. Thesis/Dissertation. 2019. Available from: https://scholarshare.temple.edu/bitstream/handle/20.500.12613/3187/TETDEDXLin-temple-0225M-13678.pdf?sequence=1&isAllowed=y (last accessed 30.11.2020).
15. Löfmark S., Edlund C., Nord C.E. Metronidazole is still the drug of choice for treatment of anaerobic infections. Clin. Infect. Dis. 2010. Vol. 50. Suppl 1. P. S16-23. doi: 10.1086/647939.
16. Oral health. WHO report 25 March 2020. Available from: https://www.who.int/news-room/fact-sheets/detail/oral-health (last accessed 26.11.2020).
17. Orstavik Dag (ed.) Essential Endodontology: Prevention and Treatment of Apical Periodontitis. 3rd edition. Wiley-Blackwell, 2019. 402 p.
18. Rams T.E., Sautter J.D., van Winkelhoff A.J. Comparative In Vitro Resistance of Human Periodontal Bacterial Pathogens to Tinidazole and Four Other Antibiotics. Antibiotics 2020. Vol. 9. P. 68. https://doi.org/10.3390/antibiotics9020068.
19. Socransky S.S., Haajee A.D., Cugini M.A., Smith C., Kent R.L. Microbial Complexes in Subgingival Plaque. J. Clin. Perio-dontol. 1998. Vol. 25. P. 134-144. doi: 10.1111/j.1600-051x.1998.tb02419.x.
20. Stein G.E., Goldstein Ellie J.C. Fluoroquinolones and Ana-erobes. Clinical Infectious Diseases. 2006. Vol. 42, Issue 11. P. 1598-1607. https://doi.org/10.1086/503907.
21. Woerther P.-L., d’Humières C., Lescure X., Barbier F., FihmanV. et al. Is the term “anti-anaerobic” still relevant? International Journal of Infectious Diseases. 2020. Vol. 102. P. 178-180. DOI: https://doi.org/10.1016/j.ijid.2020.10.052.

/43.jpg)
/44.jpg)