Журнал «Медицина неотложных состояний» Том 17, №3, 2021
Вернуться к номеру
Клініко-анамнестична характеристика та фактори ризику у хворих на гостру тромбоемболію легеневої артерії серед мешканців м. Харкова
Авторы: Целуйко В.Й.(1), Яковлева Л.М.(1), Сухова С.М.(2), Кіношенко К.Ю.(1), Радченко О.В.(1), Внукова А.С.(2)
(1) — Харківська медична академія післядипломної освіти, м. Харків, Україна
(2) — КНП «Міська клінічна лікарня № 8» Харківської міської ради, м. Харків, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
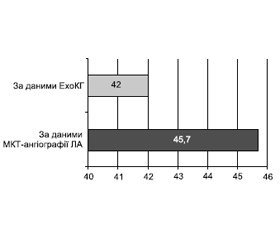
Мета роботи: аналіз особливостей перебігу і провідні чинники розвитку тромбоемболії легеневої артерії (ТЕЛА). Матеріали та методи. За період з 1 листопада 2019 року по грудень 2020 року включно до КНП «Міська клінічна лікарня № 8» Харківської міської ради госпіталізовано 188 хворих на ТЕЛА віком від 46 до 80 років (середній вік становив 62,9 ± 16,7 року). Внутрішньогоспітальна летальність становила 12,2 % (23 пацієнти). Критерієм включення до дослідження була гостра ТЕЛА, встановлена за результатами мультиспіральної комп’ютерної томографічної ангіографії легеневих артерій (МКТ-ангіографія ЛА). Усім хворим проведено загальноклінічне обстеження, оцінено ризик і прогноз за загальноприйнятими шкалами, проведено стандартну трансторакальну ехокардіографію (ЕхоКГ) та ультразвукове допплер-дослідження вен нижніх кінцівок. Результати. Захворювання з однаковою частотою діагностували у чоловіків і жінок, відмінності за віком не було. Серед найбільш значущих і значних факторів ризику розвитку ТЕЛА переважали венозний тромбоз/емболії в анамнезі та активне злоякісне онкологічне захворювання (43 та 35 % відповідно), а з менш значимих — похилий вік, варикозне розширення вен нижніх кінцівок та артеріальна гіпертензія (47,9; 31,4 та 52,1 % відповідно). У переважної більшості (57,4 %) реєстрували поєднання 2 та більше факторів ризику. Ознаки дисфункції правого шлуночка за даними МКТ-ангіографії ЛА та/або ЕхоКГ були наявні у 45,7 % хворих. Високий та помірно високий ризик ранньої смерті на тлі гострої ТЕЛА виявили у значного відсотка (71,8 %) пацієнтів, що потребувало включення тромболітика в стратегію лікування.
Background. The purpose was the analysis of the features of the course and the leading factors in the development of pulmonary embolism. Materials and methods. During the period from November 1, 2019, to December 2020, inclusive, 188 patients with acute pulmonary embolism (PE), aged 46 to 80 years old, were hospitalized at the City Clinical Hospital 8 of the Kharkiv City Council; the average age was 62.9 ± 16.7 years. In-hospital mortality was 12.2 % (23 patients). The criterion for inclusion in the study was acute PE, which was diagnosed based on the results of multislice computed tomographic angiography of the pulmonary arteries (MCT angiography of the pulmonary arteries). All patients underwent a general clinical examination, the risk and prognosis were assessed based on the generally accepted scales, standard transthoracic echocardiography (EchoCG), and Doppler ultrasound examination of the veins of the lower extremities were performed. Results. The disease was diagnosed with the same frequency in men and women; there was no difference in age. Among the most significant and important risk factors for the development of pulmonary embolism are the history of venous thrombosis/embolism and active malignant oncological disease (43 and 35 %, respectively), while the less significant ones were advanced age, varicose veins of the lower extremities and arterial hypertension 47.9, 31.4 and 52.1 %, respectively. The vast majority (57.4 %) had a combination of 2 or more risk factors. Signs of right ventricular dysfunction according to MCT angiography of the pulmonary arteries and/or echocardiography were recorded in 45.7 % of patients. A high and medium-high risk of early death associated with acute PE was found in a significant percentage (71.8 %) of patients, which required the inclusion of a thrombolytic agent in the treatment strategy.
тромбоемболія легеневої артерії; фактори ризику венозного тромбоемболізму; лікування хворих на гостру ТЕЛА
pulmonary embolism; risk factors for venous thromboembolism; treatment of patients with acute pulmonary embolism
Вступ
Матеріали та методи
Результати та обговорення
/79.jpg)
/79_2.jpg)
/80.jpg)
/80_2.jpg)
/81.jpg)
- Діагностика та лікування гострої тромбоемболії легеневої артерії. Робоча група експертів Асоціації кардіологів України, Асоціації з невідкладної кардіології, Асоціації судинних хірургів, Асоціації кардіохірургів, Асоціації пульмонологів, Асоціації анестезіологів-реаніматологів України. Український кардіологічний журнал. 2016. Додаток 2. ISSN 1608-635X.
- Настанови з клінічної ехокардіографії: посібник. В.М. Коваленко, М.М. Долженко, С.В. Поташев. НМАПО ім. П.Л. Шупи-ка МОЗ України, ННЦ «Інститут кардіології імені М.Д. Стражеска». К.: Наукова думка, 2018. 327 с.
- Хвороби системи кровообігу як медико-соціальна і суспільно-політична проблема: аналітично-статистичний посібник. За ред. В.М. Коваленка, В.М. Корнацького; ННЦ «Інститут кардіології імені М.Д. Стражеска». К.: Коломіцин В.Ю., 2014. 119 с.
- 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society: The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology. European Heart Journal. 2020. 41(4). 543-603. doi: 10.1093/eurheartj/ehz405].
- Ageno W., Casella I.B., Han C.K. et al. RE-COVERY DVT/PE: Rationale and design of a prospective observational study of acute venous thromboembolism with a focus on dabigatran etexilate. Thrombosis and Haemostasis. 2017. 117(2). 415-421. doi: 10.1160/TH16-07-0566.
- Agnelli G., Buller H.R., Cohen A. for the AMPLIFY Investigators Oral Apixaban for the Treatment of Acute Venous Thromboembolism. New England Journal of Medicine. 2013. 369. 799-808 doi: 10.1056/NEJMoa1302507.
- American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism. Blood Advances. 2020. 4(19). 4693-4738. doi: 10.1182/bloodadvances.2020001830.
- Bikdeli B., Madhavan M.V., Jimenez D. et al. COVID-19 and Thrombotic or Thromboembolic Disease: Implications for Prevention, Antithrombotic Therapy, and Follow-Up JACC State-of-the-Art Review. Journals of the American College of Cardiology. 2020. 75(23). 2950-2973. doi: 10.1016/j.jacc.2020.04.031.
- Buller H.R., Prins M.H., Lensin A.W. et al. Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. The New England Journal of Medicine. 2012. 366(14). 1287-1297.
- Cohen A.T., Agnelli G., Anderson F.A. et al. Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality., VTE Impact Assessment Group in Europe (VITAE). Thrombosis and Haemostasis. 2007. 98(4). 756-764. doi: 10.1160/TH07-03-0212.
- Donzé J., Le Gal G., Fine M.J. et al. Prospective validation of the Pulmonary Embolism Severity Index. A clinical prognostic model for pulmonary embolism. Journal of Thrombosis and Haemostasis. 2008. 100(5). 943-948. doi: 10.1160/TH08-05-0285.
- Geerts W.H., Bergqvist D., Pineo G.F. et al. Prevention of venous thromboembolism: American College of Chest Physicians Evidence — Based Clinical Practice Guidelines (8th Edition). Chest. 2008. 133(6 Suppl.). 381S-453S. doi: 10.1378/chest.08-0656.
- Greer I.A., Heit J.A., Hutchinson J.L. et al. Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality. VTE Impact Assessment Group in Europe (VITAE). Thrombosis and Haemostasis. 2007. 98(4). 756-764. doi: 10.1160/TH07-03-0212].
- Heit J.A. Epidemiology of venous thromboembolism. Nature Reviews Cardiology. 2015. 12(8). 464-474. doi: 10.1038/nrcardio.2015.8.
- Hofer М. CT Teaching Manual: A Systematic Approach to CT Reading, 4th Edition. MEDIDAK Publishing GmbH, 2013. 367 р.
- Huang W., Goldberg R.J., Anderson F.A., Kiefe C.I., Spencer F.A. Secular trends in occurrence of acute venous thromboembolism: the Worcester VTE study (1985–2009). The American Journal of Medicine. 2014. 127(9). 829-839. doi: 10.1016/j.amjmed.2014.03.041].
- Kitabatake A., Inoue M., Asao M. et al. Noninvasive evaluation of pulmonary hypertension by a pulsed Doppler technique. Circulation. 1983. 68(2). 302-309. PMID: 6861308.
- Lang R.M., Badano L.P., Mor-Avi V. et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal Cardiovascular Imaging. 2015. 16(3). 233-271. doi: 10.1093/ehjci/jev014.
- Lang R., Goldstein S.A., Kronzon I., Khandheria B.K., Mor-Avi V. ASE’s Comprehensive Echocardiography. Elsevier Health Sciences. 2015. 941 р.
- Llitjos J.-F., Leclerc M., Chochois C. et al. High incidence of venous thromboembolic events in anticoagulated severe COVID-19 patients. The Journal of Thrombosis and Haemostasis. 2020. 18(7). 1743-1746. doi: 10.1111/jth.14869.
- Patientregistret 1987–1996. Kvalitet och innehall. Stockholm: Epidemiologiskt Centrum, Socialstyrelsen, 1998.
- Silverstein M.D., Heit J.A., Mohr D.N. et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. Archives of Internal Medicine. 1998. 158(6). 585-593. doi: 10.1001/archinte.158.6.585].
- Stein P.D., Matta F., Hughes M.J. In Hospital Mortality with Deep Venous Thrombosis. The American Journal of Medicine. 2016. 130(5). 596-600. doi: 10.1016/j.amjmed.2016.10.030ііі].