Международный эндокринологический журнал Том 17, №2, 2021
Вернуться к номеру
Імунофенотип лімфоцитів крові у хворих на цукровий діабет 2-го типу з нормальною масою тіла та ожирінням
Авторы: Фурманова О.В., Куликовська А.В., Попова В.В., Зак К.П., Тронько М.Д.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
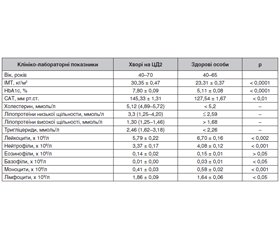
Актуальність. Визначення імунофенотипу лімфоцитів крові є одним із ключових показників функції імунітету у хворої людини. Однак дослідження імунофенотипу лімфоцитів у хворих на цукровий діабет 2-го типу (ЦД2) із найчастішим ускладненням при цьому захворюванні — надмірною масою тіла/ожирінням рідкісні та неоднозначні. Мета дослідження: визначення імунофенотипу лімфоцитів (CD3+ Т-, CD4+ Т-, CD8+ Т-, CD20+- і CD56+-клітин) крові у хворих з уперше виявленим ЦД2 із різним індексом маси тіла (ІМТ). Матеріали та методи. Обстежені 78 хворих з уперше виявленим ЦД2 і 40 нормоглікемічних осіб, які залежно від ІМТ були розділені на 4 підгрупи. Визначення імунофенотипу лімфоцитів крові було виконане проточно-цитометричним методом із використанням лазерного цитофлюориметра FACStar plus і панелі моноклональних антитіл до мембранних антигенів лімфоцитів. Результати. Для всієї групи хворих на ЦД2 характерне невелике, але вірогідне (p < 0,05) підвищення абсолютної кількості CD4+ Т-клітин порівняно з групою нормоглікемічних людей. При поділі обстежуваних хворих залежно від ІМТ на 4 підгрупи: 1) ≤ 25,5 кг/м2; 2) 25,9–29,9 кг/м2; 3) 30,0–34,9 кг/м2; 4) > 35,0 кг/м2 — виявлено, що у хворих першої підгрупи абсолютна кількість CD3+ Т-, CD4+ Т-, CD8+ Т-, CD20+- і CD56+-клітин була близькою до такої в нормоглікемічних осіб. У хворих другої підгрупи відзначалося вірогідне підвищення абсолютного числа CD4+ Т-клітин на 12,5 % (p < 0,05). У хворих третьої підгрупи спостерігали підвищення абсолютного числа CD4+ Т-клітин на 29,2 % (p < 0,001). У хворих четвертої підгрупи з морбідним ожирінням, особливо в жінок, було підвищення абсолютних чисел CD3+ Т- на 12,4 % (p < 0,01), CD4+ Т- — на 47,7 % (p < 0,001) і CD8+ Т-клітин — на 26,2 % (p < 0,001). Подібне підвищення абсолютного числа CD4+ Т-клітин залежно від ІМТ відзначалося також і в нормоглікемічних осіб, але було менш вираженим. Висновки. Для хворих з уперше виявленим ЦД2 характерне підвищення вмісту в периферичній крові субпопуляцій Т-лімфоцитів, особливо CD3+ Т- та CD4+ Т-клітин, найбільш виражене при супутньому ожирінні.
Background. Determination of the blood lymphocyte immunophenotype is one of the key indicators of the immune function in a diseased person. However, the studies of the lymphocyte immunophenotyping in patients with type 2 diabetes (T2D), with the most frequent complication of this disease — overweight/obesity, are rare and controversial. The purpose of study was to determine immunophenotype of blood lymphocytes (CD3+ T, CD4+ T, CD8+ T, CD20+ and CD56+ cells) in patients with newly diagnosed T2D and different body mass index (BMI). Materials and methods. There were examined 78 patients with newly diagnosed T2D and 40 normoglycemic individuals, who were divided into 4 subgroups, depending on the BMI. The blood lymphocyte immunophenotyping was carried out by the flow cytometry using a FACStar Plus laser cytofluorimeter and a panel of monoclonal antibodies to membrane antigens of lymphocytes. Results. The entire group of patients with T2D is characterized by a small but significant (p < 0.05) increase in the absolute number of CD4+ T cells compared to the group of normoglycemic individuals. When dividing the examined patients into 4 subgroups, depending on the BMI: 1) ≤ 25.5 kg/m2, 2) 25.9–29.9 kg/m2, 3) 30.0–34.9 kg/m2, 4) > 35.0 kg/m2, it was found that in subgroup 1, the absolute number of CD3+ T, CD4+ T, CD8+ T, CD20+ and CD56+ cells was close to those in normoglycemic individuals. Patients of subgroup 2 showed a significant increase in the absolute number of CD4+ T cells by 12.5 % (p < 0.05). In subgroup 3, there was an increase in the absolute number of CD4+ T cells by 29.2 % (p < 0.001). Patients of subgroup 4 with morbid obesity, especially women, had an increase in the absolute numbers of CD3+ T cells by 12.4 % (p < 0.01), CD4+ T cells — by 47.7 % (p < 0.001) and CD8+ T cells — by 26.2 % (p < 0.001). A similar increase in the absolute number of CD4+ T cells, depending on BMI, was also noted in normoglycemic individuals, but was less pronounced. Conclusions. Patients with newly diagnosed T2D are characterized by an increased content of T-lymphocyte subpopulations in peripheral blood, especially CD3+T and CD4+T cells, which is most pronounced with a concomitant obesity.
цукровий діабет 2-го типу; ожиріння; імунітет; імунофенотип лімфоцитів
type 2 diabetes; obesity; immunity; lymphocyte immunophenotyping
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Donath M.Y. Multiple benefits of targeting inflammation in the treatment of type 2 diabetes. Diabetologia. 2016. 59(4). 679-82. doi: 10.1007/s00125-016-3873-z.
- Netea M.G., Balkwill F., Chonchol M. et al. A guiding map for inflammation. Nat. Immunol. 2017. 18(8). 826-31. doi: 10.1038/ni.3790.
- Pearson E.R. Type 2 diabetes: a multifaceted disease. Diabetologia. 2019. 62(7). 1107-12. doi: 10.1007/s00125-019-4909-y.
- Ferlita S., Yegiazaryan A., Noori N., Lal G., Nguyen T., To K., Venketaraman V. Type 2 Diabetes Mellitus and Altered Immune System Leading to Susceptibility to Pathogens, Especially Mycobacterium tuberculosis. J. Clin. Med. 2019. 8(12). 2219. doi: 10.3390/jcm8122219.
- Shitole S.G., Biggs M.L., Reiner A.P. et al. Soluble CD14 and CD14 variants, other inflammatory markers, and glucose dysregulation in older adults: The Cardiovascular Health Study. Diabetes Care. 2019. 42(11). 2075-82. doi: 10.2337/dc19-0723.
- Tronko M.D., Zak K.P. Current advances in clinical pathophysiology in the study of the pathogenesis of type 1 and 2 diabetes mellitus in humans. Mìžnarodnij endokrinologìčnij žurnal. 2019. 15(6). 422-34. Doi: 10.22141/2224-0721.15.6.2019.185403 (in Russian).
- Furmanova O.V., Zak K.P., Popova V.V., Tronko M.D. Blood leukocyte composition and neutrophil to lymphocyte ratio in patients with newly diagnosed type 2 diabetes mellitus, depending on the degree of overweight/obesity. Mìžnarodnij endokrinologìčnij žurnal. 2020. 16(7). 24-31. Doi: 10.22141/2224-0721.16.7.2020.219006 (in Russian).
- Pecora F., Persico F., Argentiero A., Neglia C., Esposito S. The Role of Micronutrients in Support of the Immune Response against Viral Infections. Nutrients. 2020. 12(10). 3198. doi: 10.3390/nu12103198.
- Gombart A.F., Pierre A., Maggini S. A Review of Micronutrients and the Immune System-Working in Harmony to Reduce the Risk of Infection. Nutrients. 2020. 12(1). 236. doi: 10.3390/nu12010236.
- O’Shea J.J., Paul W.E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science. 2010. 327(5969). 1098-102. doi: 10.1126/science. 1178334.
- Zak K.Р., Popova V.V. The role of IL-17 in the pathogenesis of type 1 and type 2 diabetes in humans. Mìžnarodnij endokrinologìčnij žurnal. 2018. 14(5). 514-21. Doi: 10.22141/2224-0721.14.5.2018.142690 (in Russian).
- Abdel-Moneim A., Bakery H.Н., Allam G. The potential pathogenic role of IL-17/Th17 cells in both type 1 and type 2 diabetes mellitus. Biomed. Pharmacother. 2018. 101. 287-92. doi: 10.1016/j.biopha.2018.02.103.
- Lee Y.Н., Kim S.R., Han D.H. et al. Senescent T Cells Predict the Development of Hyperglycemia in Humans. Diabetes. 2019. 68(1). 156-62. doi: 10.2337/db17-1218.
- Gupta S.S., Wang J., Chen M. Metabolic Reprogramming in CD8+ T Cells During Acute Viral Infections. Front. Immunol. 2020. 11. 1013. doi: 10.3389/fimmu.2020.01013.
- Prochorec-Sobieszek M. Advances in diagnosis and treatment of large granular lymphocyte syndrome. Curr. Opin. Hematol. 2011. 18(1). 55-62. doi: 10.1097/MOH.0b013e328340dc12. PMID: 20975557.
- Spooren P.F., Vermes І., Soons J.W. Similar alterations of lymphocyte subpopulations in type I and type II diabetes. Neth. J. Med. 1993. 42(5-6). 163-7. PMID: 8377873.
- Chang F.Y., Shaio M.F. Decreased cell-mediated immunity in patients with non-insulin-dependent diabetes mellitus. Diabetes Res. Clin. Pract. 1995. 28(2). 137-46. doi: 10.1016/0168-8227(95)00168-8.
- Dworacka M., Winiarska H., Borowska M., Abramczyk M., Bobkiewicz-Kozlowska T., Dworacki G. Pro-atherogenic alterations in T-lymphocyte subpopulations related to acute hyperglycaemia in type 2 diabetic patients. Circ. J. 2007. 71(6). 962-7. doi: 10.1253/circj.71.962.
- Viisanen T., Ihantola E.L., Näntö-Salonen K. et al. Circulating CXCR5+PD-1+ICOS+ Follicular T Helper Cells Are Increased Close to the Diagnosis of Type 1 Diabetes in Children With Multiple Autoantibodies. Diabetes. 2017. 66(2). 437-447. doi: 10.2337/db16-0714.
- Heninger A.K., Eugster A., Kuehn D., Buettner F., Kuhn M., Lindner A. et al. A divergent population of autoantigen-responsive CD4+ T cells in infants prior to β cell autoimmunity. Sci. Transl. Med. 2017. 9(378). eaaf8848. doi: 10.1126/scitranslmed.aaf8848.
- Endesfelder D., zu Castell W., Ardissone A. et al. Compromised gut microbiota networks in children with anti-islet cell autoimmunity. Diabetes. 2014. 63(6). 2006-14. doi: 10.2337/db13-1676.
- Bouter K.Р., Meyling F.Н., Hoekstra J.В., Masurel N., Erkelens D.W., Diepersloot R.J. Influence of blood glucose levels on peripheral lymphocytes in patients with diabetes mellitus. Diabetes Res. 1992. 19(2). 77-80. PMID: 1286542.
- Tsujimura T., Matsuo Y., Keyaki T., Sakurada K., Imanishi J. Correlations of sleep disturbance with the immune system in type 2 diabetes mellitus. Diabetes Res. Clin. Pract. 2009. 85(3). 286-92. doi: 10.1016/j.diabres.2009.07.001.
- Czech A., Piatkiewicz P., Nowaczyk M., Marek J. Increased levels of proinflammatory cytokines are associated with impaired immune activity of Natural Killer (NK) cells of prediabetic subjects (PS). Diabetologia. 2009. 52(Suppl. 1). A-624.
- Сhe T.Т., Ren Y., Liu S.F. Expression of circulating CD4+CD25+ FOXP3+ regulatory T cells in obese patients. Diabetologia. 2013. 56(Suppl. 1). A-563.
- Saienko Y., Zak K., Popova V., Semionova T. Leukocyte Composition and Immunophenotype of the Blood Lymphocytes in Women With Type 2 Diabetes Mellitus and Obesity. International Journal of Endocrinology (Ukraine). 2016. 5(77). 13-19. doi: 10.22141/2224-0721.5.77.2016.78748.
- Womack J., Tien P.С., Feldman J. et al. Obesity and immune cell counts in women. Metabolism. 2007 Jul. 56(7). 998-1004. doi: 10.1016/j.metabol.2007.03.008. PMID: 17570264. PMCID: PMC1939725.
- Chobot A., Górowska-Kowolik K., Sokołowska M., Jarosz-Chobot P. Obesity and diabetes-Not only a simple link between two epidemics. Diabetes Metab. Res. Rev. 2018. 34(7). e3042. doi: 10.1002/dmrr.3042.
- Harwood H.J. Jr. The adipocyte as an endocrine organ in the regulation of metabolic homeostasis. Neuropharmacology. 2012 Jul. 63(1). 57-75. doi: 10.1016/j.neuropharm. 2011.12.010.
- Scheja L., Heeren J. The endocrine function of adipose tissues in health and cardiometabolic disease. Nat. Rev. Endocrinol. 2019 Sep. 15(9). 507-24. doi: 10.1038/s41574-019-0230-6.
- Boutens L., Stienstra R. Adipose tissue macrophages: going off track during obesity. Diabetologia. 2016 May. 59(5). 879-94. doi: 10.1007/s00125-016-3904-9.
- Fabbrini E., Cella M., McCartney S.А., Fuchs A., Abumrad N.А., Pietka T.А. et al. Association between specific adipose tissue CD4+ T-cell populations and insulin resistance in obese individuals. Gastroenterology. 2013 Aug. 145(2). 366-74.e1-3. doi: 10.1053/j.gastro. 2013.04.010.
- Kim J.Y., Bacha F., Tfayli H., Michaliszyn S.F., Yousuf S., Arslanian S. Adipose tissue insulin resistance in youth on the spectrum from normal weight to obese and from normal glucose tolerance to impaired glucose tolerance to type 2 diabetes. Diabetes Care. 2019 Feb. 42(2). 265-72. doi: 10.2337/dc18-1178.
- Bommer C., Heesemann E., Sagalova V., Manne-Goehler J., Atun R., Bärnighausen T., Vollmer S. The global economic burden of diabetes in adults aged 20-79 years: a cost-of-illness study. Lancet Diabetes Endocrinol. 2017 Jun. 5(6). 423-30. doi: 10.1016/S2213-8587(17)30097-9.
- Leitner D.R., Frühbeck G., Yumuk V., Schindler K., Micic D., Woodward E., Toplak H. Obesity and Type 2 Diabetes: Two Diseases with a Need for Combined Treatment Strategies — EASO Can Lead the Way. Obes. Facts. 2017. 10(5). 483-492. doi: 10.1159/000480525.
- Homan E.А., Reyes M.V., Hickey K.Т., Morrow J.P. Clinical Overview of Obesity and Diabetes Mellitus as Risk Factors for Atrial Fibrillation and Sudden Cardiac Death. Front. Physiol. 2019 Jan 7. 9. 1847. doi: 10.3389/fphys.2018.01847.
- Nolan J.J., Færch K. Estimating insulin sensitivity and beta cell function: perspectives from the modern pandemics of obesity and type 2 diabetes. Diabetologia. 2012 Nov. 55(11). 2863-7. doi: 10.1007/s00125-012-2684-0.
- Global BMI Mortality Collaboration, Di Angelantonio E., Bhupathiraju Sh.N., Wormser D. et al. Body-mass index and all-cause mortality: individual-participant-data meta-analysis of 239 prospective studies in four continents. Lancet. 2016 Aug 20. 388(10046). 776-86. doi: 10.1016/S0140-6736(16)30175-1.
- O’Rourke R.W., Kay T., Scholz M.H., Diggs B., Jobe B.А., Lewinsohn D.M., Bakke A.C. Alterations in T-cell subset frequency in peripheral blood in obesity. Obes Surg. 2005 Nov-Dec. 15(10). 1463-8. doi: 10.1381/096089205774859308.
- Al-Sufyani A.А., Mahassni S.H. Obesity and immune cells in Saudi females. Innate Immun. 2011 Oct. 17(5). 439-50. doi: 10.1177/1753425910372536.
- van der Weerd K., Dik W.A., Schrijver В. et al. Morbidly obese human subjects have increased peripheral blood CD4+ T cells with skewing toward a Treg- and Th2-dominated phenotype. Diabetes. 2012 Feb. 61(2). 401-8. doi: 10.2337/db11-1065.
- International Diabetes Federation (IDF). IDF Diabetes Atlas, 8th edition. Brussels, Belgium: IDF, 2017. 150 p.
- Muntner P., Shimbo D., Carey R.M. et al. Measurement of blood pressure in: A scientific statement from the American Heart Association. Hypertension. 2019. 73(5). e35-e66. https://doi.org/10.1161/HYP. 0000000000000087
- Ehlers M.R. Immune interventions to preserve β cell function in type 1 diabetes. J. Investig. Med. 2016 Jan. 64(1). 7-13. doi: 10.1097/JIM.0000000000000227.
- Nambam B., Bratina N., Schatz D. Immune Intervention for Type 1 Diabetes. Diabetes Technol. Ther. 2018 Feb. 20(S1). S86-S93. doi: 10.1089/dia.2018.2507.
- Wang X., Bao W., Liu J. et al. Inflammatory markers and risk of type 2 diabetes: a systematic review and meta-analysis. Diabetes Care. 2013 Jan. 36(1). 166-75. doi: 10.2337/dc12-0702.
- Nikolajczyk B.S., Jagannathan-Bogdan M., Shin H., Gyurko R. State of the union between metabolism and the immune system in type 2 diabetes. Genes Immun. 2011 Jun. 12(4). 239-50. doi: 10.1038/gene.2011.14.
- Berbudi A., Rahmadika N., Tjahjadi A.І., Ruslami R. Type 2 Diabetes and its Impact on the Immune System. Curr. Diabetes Rev. 2020. 16(5). 442-449. doi: 10.2174/1573399815666191024085838.
- Dalmas E., Venteclef N., Caer C. et al. T cell-derived IL-22 amplifies IL-1β-driven inflammation in human adipose tissue: relevance to obesity and type 2 diabetes. Diabetes. 2014 Jun. 63(6). 1966-77. doi: 10.2337/db13-1511.
- Reaven G.M. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes. 1988. 37(12). 1595-607. doi: 10.2337/diab.37.12.1595. PMID: 3056758.
- Reaven G.M. The metabolic syndrome: is this diagnosis necessary? Am. J. Clin. Nutr. 2006 Jun. 83(6). 1237-47. doi: 10.1093/ajcn/83.6.1237.
- Hotamisligil G.S. Inflammation and metabolic disorders. Nature. 2006 Dec 14. 444(7121). 860-7. doi: 10.1038/nature05485.
- Mehta P., McAuley D.F., Brown M., Sanchez E., Tattersall R.S., Manson J.J. HLH Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020 Mar 28. 395(10229). 1033-4. doi: 10.1016/S0140-6736(20)30628-0.
- McGonagle D., Sharif K., O’Regan A., Bridgewood C. The Role of Cytokines including Interleukin-6 in COVID-19 induced Pneumonia and Macrophage Activation Syndrome-Like Disease. Autoimmun. Rev. 2020. 19(6). 102537. doi: 10.1016/j.autrev.2020.102537.
- Gianchandani R., Esfandiari N.Н., Ang L., Iyengar J., Knotts S., Choksi P., Pop-Busui R. Managing Hyperglycemia in the COVID-19 Inflammatory Storm. Diabetes. 2020 Oct. 69(10). 2048-53. doi: 10.2337/dbi20-0022.
- Komissarenko S.V. Scientists’ pursuit for SARS-COV-2 coronavirus: strategies against pandemic. Ukr. Biochem. J. 2020 Nov-Dec. 92(6). 5-52. doi: https://doi.org/10.15407/ ubj92.06.005
- Ugwueze C.V., Ezeokpo B.С., Nnolim B.І., Agim E.А., Anikpo N.С., Onyekachi K.E. COVID-19 and Diabetes Mellitus: The link and clinical implications. Dubai Diabetes Endocrinol. J. 2020. 26. 69-77. https://doi.org/10.1159/000511354
- Crouse A., Grimes T., Li P., Might M., Ovalle F., Shalev A. Metformin use is associated with reduced mortality in a diverse population with COVID-19 and diabetes. medRxiv [Preprint]. 2020 Jul 31. 2020.07.29.20164020. doi: 10.1101/2020.07.29.20164020. Now published in Frontiers in Endocrinology. doi: 10.3389/fendo.2020.600439.
- Xinyu X., Min S., Ruiling Z. et al. Follicular Regulatory T Cells Are Associated With b-Cell Autoimmunity and the Development of Type 1 Diabetes. Clin. Endocrinol. Metab. 2019 Sept. 104(9). 4199-4213. doi: 10.1210/jc.2019-00093.

/20.jpg)
/21.jpg)
/22.jpg)