Резюме
Актуальність. Рак шлунка (РШ) залишається провідною причиною онкологічної захворюваності та смертності у світі. Згідно з даними Globocan, у 2020 році захворюваність на рак шлунка становила 5,6 % (1 089 103 осіб), смертність — 7,7 % (768 793 осіб). За даними канцер-реєстру України за 2017–2018 роки, рак шлунка за смертністю посідає друге місце після раку легень у чоловіків. До моменту встановлення діагнозу майже у 70 % хворих пухлинний процес місцево-поширеного або генералізованого характеру, що знижує можливість радикального хірургічного лікування. Хірургічне лікування залишається основним методом лікування РШ, але прогноз залишається невтішним навіть після якісно проведеного оперативного лікування через високу частоту рецидивів (20–60 %) та недостатню ефективність ад’ювантної терапії. Мета дослідження: проаналізувати дослідження, де випробовувались різні схеми неоад’ювантного лікування раку шлунка, та надати результати ключових перспективних досліджень, присвячених цій технології лікування. Матеріали та методи. Ми провели огляд літератури, що включав рандомізовані та нерандомізовані клінічні дослідження в період з 2010 по 2020 рік. Пошук проводили за допомогою електронних наукометричних баз PubMed, Embase, Scopus, Web of Science, MedLine, Cochrane Library, а також тез доповідей щорічних конгресів Американського товариства клінічної онкології та Європейського суспільства медичної онкології. Ключовими словами пошуку були: неоад’ювантна хіміотерапія, періопераційна хіміотерапія, новоутворення шлунка, рак шлунка, рандомізоване контрольоване випробування, лікування раку шлунка, дисемінований РШ, D2-лімфодисекція. Критеріями відбору були дослідження, в яких порівнювалися різні режими періопераційної хіміотерапії без додавання хіміопроменевої терапії, таргетної терапії за останні 10 років. Результати. За визначеними ключовими словами було знайдено 30 публікацій. Серед знайдених джерел 10 рандомізованих клінічних досліджень, 8 нерандомізованих клінічних досліджень, 4 метааналізи, 8 літературних оглядів. Висновки. Аналіз наведених даних свідчить про наявність лише 3 рандомізованих контрольованих досліджень, присвячених ефективності та безпечності періопераційної хіміотерапії місцево-поширеного раку шлунка, які відповідали критеріям відбору. У проаналізованих дослідженнях є недоліки дизайну дослідження: відсутні вірогідні дані щодо проведення адекватної лімфодисекції, включення в дослідження не тільки раку шлунка, а й інших локалізацій (шлунково-стравохідної аденокарциноми, раку нижнього відділу стравоходу). Перераховані вище аргументи дозволяють констатувати, що визнання режиму FLOT єдиним ефективним і безпечним режимом неоад’ювантної поліхіміотерапії місцево-поширеного раку шлунка не є ретельно обґрунтованим постулатом, а потребує подальших спланованих клінічних досліджень належної якості.
Background. Gastric cancer remains the leading cause of cancer morbidity and mortality in the world. According to Globocan, in 2020 the incidence of gastric cancer was 5.6 % (1,089,103 people), with mortality of 7.7 % (768,793 people). According to the Cancer Registry of Ukraine for 2017–2018, gastric cancer is the second leading cause of death after lung cancer in men. By the time of diagnosis, almost 70 % of patients have a locally advanced or generalized tumor process, which reduces the possibility of radical surgical treatment. Surgical treatment remains the main method of treatment for gastric cancer, but the prognosis is poor even after high-quality surgical treatment due to the high frequency of recurrences (20–60 %) and insufficient effectiveness of adjuvant therapy. The purpose of the study: to analyze studies that have tested various schemes of neoadjuvant treatment for gastric cancer and to present the results of key promising studies on this treatment technology. Materials and methods. We conducted a literature review that included randomized and nonrandomized clinical trials from 2010 to 2020. The search was conducted using electronic scientometric databases PubMed, Embase, Scopus, Web of Science, MedLine, Cochrane Library, as well as abstracts of the annual congresses of the American Society of Clinical Oncology and the European Society for Medical Oncology. The key words of the search were: neoadjuvant chemotherapy, perioperative chemotherapy, gastric neoplasm, gastric cancer, randomized controlled trial, treatment of gastric cancer, disseminated gastric cancer, D2 dissection. The selection criteria were: studies comparing different regimens of perioperative chemotherapy without the addition of chemoradiation therapy, targeted therapy over the past 10 years. Results. Thirty publications were found for the above-mentioned keywords. Among these sources, there were 10 randomized clinical trials, 8 non-randomized clinical trials, 4 meta-analyzes, 8 literature reviews. Conclusions. Analysis of these data indicates the presence of only 3 randomized controlled trials on the efficacy and safety of perioperative chemotherapy for locally advanced gastric cancer that met the selection criteria. There are shortcomings in the design of the analyzed studies: no reliable data on adequate lymph dissection, inclusion into the study of patients not only with gastric cancer, but also with other cancer sites (gastroesophageal adenocarcinoma, cancer of the lower esophagus). The above arguments suggest that the recognition of the FLOT as the only effective and safe regimen for neoadjuvant polychemotherapy in locally advanced gastric cancer is not a well-founded postulate, but requires further planned clinical trials of appropriate quality.
Вступ
Рак шлунка (РШ) залишається провідною причиною онкологічної захворюваності та смертності у світі. Згідно з даними Globocan, у 2020 році захворюваність на рак шлунка становила 5,6 % (1 089 103 осіб), смертність — 7,7 % (768 793 осіб). За даними канцер-реєстру України за 2017–2018 роки, рак шлунка за смертністю посідає друге місце після раку легень у чоловіків.
Хвороба частіше проявляється в чоловіків віком від 30 до 75 років, проте статистичні дані останніх років свідчать про вірогідне зростання частоти РШ серед жінок. До моменту встановлення діагнозу майже у 70 % хворих пухлинний процес місцево-поширеного або генералізованого характеру, що знижує можливість радикального хірургічного лікування.
Загальна 5-річна виживаність для резектабельного РШ низька і становить від 20 до 30 %. Водночас в Японії виживаність становить 53 %, що пов’язано із застосуванням скринінгових програм та виявленням РШ на ранніх стадіях, а також адекватним лікуванням — операцією з лімфодисекцією в об’ємі D2.
Хірургічне лікування є основним методом лікування РШ, але прогноз залишається невтішним навіть після адекватної операції через високу частоту рецидивів (20–60 %) та недостатню ефективність ад’ювантної терапії.
У низці досліджень порівнювали різницю між хірургічним втручанням, доповненим ад’ювантним лікуванням, та хірургічним втручанням як єдиним методом лікування. На сьогодні існують переконливі дані метааналізу, проведеного групою GASTRIC, які свідчать про те, що хірургічне втручання з ад’ювантним лікуванням має перевагу над хірургічним втручанням: загальна 5-річна виживаність зросла з 49,6 до 55,3 % [1].
Враховуючи те, що у більшості первинних хворих РШ виявляють на пізніх стадіях, останніми роками частіше застосовують комплексний підхід із використанням неоад’ювантного (передопераційного) та ад’ювантного (післяопераційного) лікування. Стратегією неоад’ювантного лікування є зменшення обсягу пухлини, збільшення вірогідності резекції в об’ємі R0, знищення мікрометастазів. Періопераційну хіміотерапію було нещодавно включено до національних рекомендацій з лікування провідних країн світу, особливо після публікації німецького рандомізованого дослідження фази II/III 2019 року — FLOT4 [2].
Мета дослідження: провести порівняльний аналіз досліджень, де випробувались різні схеми неоад’ювантного лікування раку шлунка, та навести результати ключових перспективних досліджень, присвячених цій технології лікування.
Матеріали та методи
Ми провели огляд літератури, що включав рандомізовані та нерандомізовані клінічні дослідження в період з 2010 по 2020 рік. Пошук проводили за допомогою електронних наукометричних баз PubMed, Embase, Scopus, Web of Science, MedLine, Cochrane Library, а також тез доповідей щорічних конгресів Американського товариства клінічної онкології (ASCO) та Європейського суспільства медичної онкології (ESMO). Ключовими словами пошуку були: неоад’ювантна хіміотерапія, періопераційна хіміотерапія, новоутворення шлунка, рак шлунка, рандомізоване контрольоване випробування, лікування раку шлунка, дисемінований РШ, D2-лімфодисекція. Критеріями відбору були дослідження, в яких порівнювалися різні режими періопераційної хіміотерапії без додавання хіміопроменевої терапії, таргетної терапії за останні 10 років.
Результати
За визначеними ключовими словами було знайдено 30 публікацій. Серед знайдених джерел 10 рандомізованих клінічних досліджень, 8 нерандомізованих клінічних досліджень, 4 метааналізи, 8 літературних оглядів. З них критеріям відбору відповідали 3 рандомізованих клінічних дослідження.
Періопераційна хіміотерапія РШ була вперше подана як стандарт лікування відповідно до результатів двох рандомізованих клінічних досліджень. Першим багатоцентровим дослідженням було Medical Research Council Adjuvant Gastric Infusional Chemotherapy (MAGIC), в якому брали участь 503 пацієнти із шлунково-стравохідною аденокарциномою, раком шлунка та раком нижнього відділу стравоходу.
Учасники були рандомізовані на дві групи: у першій групі досліджувався результат використання неоад’ювантної хіміотерапії (НХТ) та операції (n = 250 пацієнтів); у другій групі — результат тільки після операції (n = 253 пацієнти). Використана схема для НХТ — ECF (Epirubicin 50 mg/m2, Cisplatin 60 mg/m2, 5-Fluorouracil 200 mg/m2/d). Використання НХТ та операції призвело до значного поліпшення загальної виживаності (OS) за рік — 36 проти 23 % [3].
Аналогічні результати були отримані у французькому дослідженні ACCORD07/FFCD 9703 [4]. Використана схема для НХТ — CF (Cisplatin 100 mg/m2 та 5-Fluorouracil 800 mg/m2/d, з 1-го по 5-й день). Результати дослідження показали перевагу в загальній виживаності НХТ та операції на 14 % (24 % — операція та 38 % — НХТ з операцією).
Обидва дослідження призвели до зміни підходу лікування РШ та висунули на перший план ідею мультимодального підходу. Використання триплету в першому дослідженні є взаємозамінним використанню дуплету в другому дослідженні, що свідчить про те, що платиновмісний дуплет не поступається антрациклінвмісному триплету за ефективністю, проте, вірогідно, супроводжується меншою частотою побічних ефектів, нижчою токсичністю. Статистичні тести щодо гетерогенності результатів показали, що періопераційні ефекти від хіміотерапії були набагато вищими для пухлин стравохідно-шлункового з’єднання, а не для раку шлунка. Проте в публікації не міститься даних щодо частоти виконання лімфодисекції в об’ємі D2 в усіх дослідницьких центрах, залучених у дослідження.
/8.jpg)
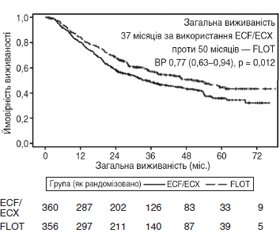
У квітні 2019 року були опубліковані дані німецького дослідження FLOT4. Це відкрите клінічне випробування, що включало 716 пацієнтів з резектабельним місцево-поширеним раком шлунка (T2–4/N будь-які/M0) або з метастазами в регіонарні лімфатичні вузли (T будь-яка/N+/M0). Їх рандомізували на дві групи: ті, що отримували режим FLOT (n = 356), та ті, що отримували режим ECF/ECX (n = 360).
Режим FLOT проводили: 4 курси до операції, 4 — після (Docetaxel 50 mg/m2/Oxaliplatin 85 mg/m2, Leucovorin 200 mg/m2, внутрішньовенно краплинно, 5-Fluorouracil 2600 мг/м2, інфузія 24 години — 1-й день, 1 раз у 14 днів). Режим ECF/ECX складався з 3 курсів перед операцією і 3 — після (Epirubicin 50 mg/m2, Cisplatin 60 mg/m2,
внутрішньовенно краплинно, 5-Fluorouracil 200 mg/m2, внутрішньовенна інфузія, або Capecitabine 1250 mg/m2, перорально, з 1-го по 21-й день).
Первинною кінцевою точкою була загальна виживаність. Використання режиму FLOT призвело до значного поліпшення медіани загальної виживаності — 50 та 37 місяців у групі ECF (рис. 4). За оцінкою дослідників, загальна 5-річна виживаність зросла до 45 % в режимі FLOT з 36 % в режимі ECF/ECX [5].
Медіана безрецидивної виживаності (Progression-free survival, PFS) становила 30 місяців проти 18 місяців відповідно (рис. 5).
Таким чином, автори дослідження позиціонували режим FLOT як новий золотий стандарт лікування раку шлунка для пацієнтів, які отримують періопераційне лікування. Даний режим був включений у рекомендації NCCN та ESMO [6].
Крім того, за даними Salah-Eddin Al-Batran та спів–авт. (2016), режим FLOT асоціювався із значно вищим відсотком пацієнтів, які досягли повної патологічної регресії (pathological response, PR), ніж ECF/ECX (20 із 128 пацієнтів проти 8 із 137 пацієнтів відповідно) [7].
Проте, якщо подивитись на кількість та ступінь побічних ефектів, більше половини пацієнтів, які отримували режим FLOT (52 %), страждали від нейтропенії тяжкого ступеня (3–4-й ст.) на відміну від 39 % у режимі ECF/ECX. Також частіше зустрічались інфекційні ускладнення (18 та 9 %), діарея (10 та 4 %) і полінейропатія (7 та 2 %). Тільки 60 % у групі FLOT розпочали післяопераційний етап лікування, і тільки 46 % хворих отримали повний цикл лікування (4 + 4). Більше того, 5-річна виживаність, навіть при такому інтенсивному режимі лікування, все одно залишилась невисокою — менше 50 % [8].
Обговорення
Отже, за результатами випробувань MAGIC та ACCORD07/FFCD 9703, які продемонстрували перевагу в загальній виживаності (OS) та виживаності без прогресії (PFS) у групі, де було використано неоад’ювантну хіміотерапію та операцію, можна говорити про потенційну перевагу мультимодального підходу до лікування місцево-поширеного раку шлунка. Проте в обидва дослідження входили пацієнти не тільки з раком шлунка, а також з раком стравохідно-шлункового переходу, раком нижнього відділу стравоходу, що ускладнює можливість вірогідного трактування результатів.
Дослідження FFCD 9703 показало, що використання платиновмісного дуплету є рівноцінним використанню триплету, але, можливо, має перевагу в токсичності.
Використання режиму FLOT призвело до значного поліпшення медіани загальної виживаності (50 та 37 місяців у групі ECF) та безрецидивної виживаності (30 та 18 місяців відповідно). За оцінкою дослідників, загальна 5-річна виживаність зросла до 45 % в режимі FLOT з 36 % в режимі ECF/ECX. Слід звернути увагу, що зазначений результат загальної 5-річної виживаності має позитивну тенденцію до зростання порівняно з режимами ECF/ECX (36 %) [7], СF (38 %) [4], проте залишається невисоким (< 50 %) і супроводжується значно більшою токсичністю та гіршим рівнем якості життя пацієнта.
Це означає, що медикаментозне лікування раку шлунка все ще є відкритим питанням і пошуки ефективного режиму продовжуються. Крім того, за якою схемою проводити лікування в післяопераційному періоді, якщо пацієнт не відповів на передопераційні цикли, теж є предметом дискусій. На сьогодні невідомо, яка лікувальна тактика є оптимальною у випадку рецидиву пухлини після лікування режимом FLOT.
Висновки
Аналіз наведених даних свідчить про наявність лише 3 рандомізованих контрольованих досліджень (які є стандартом доказової медицини), присвячених ефективності та безпечності періопераційної хіміотерапії місцево-поширеного раку шлунка. У проаналізованих дослідженнях є недоліки дизайну дослідження: відсутні вірогідні дані щодо проведення адекватної лімфодисекції, включення в дослідження не тільки раку шлунка, а й інших локалізацій (шлунково-стравохідної аденокарциноми, раку нижнього відділу стравоходу). Перераховані вище аргументи дозволяють констатувати, що визнання режиму FLOT єдиним ефективним та безпечним режимом неоад’ювантної поліхіміотерапії місцево-поширеного раку шлунка не є ретельно обґрунтованим постулатом, а потребує подальших ретельно спланованих клінічних досліджень належної якості.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Усі рисунки, використані в огляді, взяті з відкритої презентації ESMO Oncology PRO.
Отримано/Received 22.02.2021
Рецензовано/Revised 04.03.2021
Прийнято до друку/Accepted 12.03.2021
Коментар редакції до статті К.Д. Бахнюк «Періопераційна хіміотерапія при місцево-поширеному операбельному раку шлунка (огляд літератури)»
При рецензуванні огляд отримав низку зауважень від рецензентів, які значною мірою були враховані автором. Проте вважаємо за необхідне навести їх зміст, щоб читачі змогли сформувати свою думку відносно технології лікування, що розглядається, і, можливо, ініціювати дискусію на шпальтах нашого журналу.
Зауваження рецензента
При розгляді й обговоренні статті німецьких авторів (Al-Batran S.E. et al., 2019) в огляді зазначено: «…автори дослідження позиціонували режим FLOT як новий золотий стандарт лікування…» Проте в оригінальній статті слово gold не зустрічається, в обговоренні йдеться про новий стандарт.
Не знаю, чи для раку шлунка наближення до 50% 5-річної виживаності — це мало. Тому я був би за обережніші судження автора огляду.
Назагал мені здалося, що S.E. Al-Batran і спів–автори дослідження досить обережно й стримано говорять про результати. Стосовно цієї публікації позиція автора огляду надто жорстка; для її об’єктивізації я б порадив скористатися оцінками якихось незалежних загальновизнаних експертів у цій галузі (їх достатньо в різноманітних коментарях на цю тему). І взагалі, варто було використати більше думок з секції Discussion статей, які розглядаються.
Крім того, як на мене, чисто цитостатична терапія в цій ділянці вже не дасть покращення. В обговоренні автор огляду може сказати, у якому напрямку можуть іти дослідження, де чекати покращення результатів. Бо наразі особливого оптимізму поки що нема.
Доцент Я.В. Шпарик

/7.jpg)
/8.jpg)
/9.jpg)