Вступ
Однією з проблем сучасної діабетології залишаються профілактика та лікування хронічних ускладнень цукрового діабету. Незважаючи на високу якість препаратів, що застосовують для лікування даної нозології, та створену систему діабетичної допомоги, зокрема дитячому населенню, рівень інвалідизації та ранньої смертності серед хворих даної категорії все одно зростає. Одним із пізніх ускладнень цукрового діабету 1-го типу (ЦД1), що має мультифакторіальну природу, є діабетична міопатія — стан, який характеризується зниженням функції, сили та маси скелетної мускулатури на фоні перебігу цукрового діабету [1, 2]. Розвитку даного стану може передувати динапенія, при якій спостерігається зниження показників м’язової діяльності, таких як сила та загальна рухливість, але без зниження м’язової маси [3]. Дані ускладнення часто залишаються без уваги, хоча складно переоцінити роль м’язової системи, яка становить більше 40 % від загальної маси тіла та виконує не лише локомоторну, а й метаболічну функцію, що забезпечує інсулінозалежне засвоєння значної частини глюкози, яка надходить до організму [4]. З огляду на ключову роль скелетної мускулатури у гомеостазі глюкози низка дослідників пов’язують розвиток інших хронічних ускладнень діабету саме з порушенням функціонування м’язової системи [5].
Незважаючи на досягнення сучасної науки в діагностиці цукрового діабету та його ускладнень, залишаються нез’ясовними питання щодо частоти виникнення та спускових гачків розвитку діабетичної міопатії в дітей. Тому можливість прогнозу розвитку діабетичної міопатії в дітей, хворих на цукровий діабет, має практичний інтерес, адже визначення предикторів дозволяє не тільки своєчасно виявляти дітей з можливим розвитком даного ускладнення, але й планувати заходи з профілактики його виникнення та/або прогресування.
Мета дослідження: визначити частоту, фактори ризику розвитку діабетичної міопатії в дітей, хворих на цукровий діабет 1-го типу, та створити математичну модель прогнозування формування патології.
Матеріали та методи
Групу спостереження становили 136 дітей віком від 11 до 17 років (середній вік — 14,3 ± 0,3 року), хворих на цукровий діабет 1-го типу, серед яких було 78 (57,4 %) хлопчиків і 58 (42,6 %) дівчаток. Усім дітям проведене комплексне клініко-інструментальне та лабораторне обстеження, що включало збір скарг щодо м’язової системи, анамнезу (обтяжена спадковість щодо цукрового діабету, тривалість перебігу захворювання), антропометрію з визначенням індексу маси тіла (ІМТ) та індексу жирової маси (ІЖМ) [6, 7], вимірювання артеріального тиску на верхніх і нижніх кінцівках з подальшим розрахунком кісточково-плечового індексу (КПІ) [8]. Всі діти оглядалися вузькими спеціалістами для виявлення пізніх ускладнень цукрового діабету (діабетична ретинопатія, діабетична нефропатія, діабетична периферична полінейропатія, діабетична автономна нейропатія, діабетична хайропатія, діабетична ліподистрофія). Обов’язковий комплекс обстеження включав оцінку стану м’язової системи (кистьова динамометрія з визначенням індексу кистьової сили, статичної та динамічної витривалості м’язів, проби на рівновагу) [9, 2, 10–12]. Лабораторне дослідження включало визначення аналізу крові, рівня глюкози натще, глікованого гемоглобіну, креатинфосфокінази, лужної фосфатази, холестерину, тригліцеридів, загального білка, печінкових проб (загальний білірубін, АлАТ, АсАТ, тимолова проба, ГГТ, ЛДГ), загального кальцію в сироватці крові. Також враховувалися вік та стать дитини, доза інсуліну, яку застосовує дитина, стан глікемічного контролю.
Діабетичну міопатію діагностували при наявності в дитини зниження функції, сили скелетних м’язів та індексу маси скелетної мускулатури порівняно з нормативними показниками [2]. При порушенні функції та сили скелетних м’язів, але за відсутності зниження індексу маси скелетної мускулатури діагностували діабетичну динапенію [3].
Статистично результати обробляли за допомогою пакета статистичних програм Statistica 13.0 (StatSoftInc. № JPZ8041382130ARCN10-J) та IBM SPSS Statistics.v.23. Аналіз прогностичної значущості окремих ознак як факторів ризику розвитку діабетичної міопатії в дітей, хворих на цукровий діабет, проводили на основі розрахунку показника відносного ризику (RR) в таблицях спряженості 2 х 2 з визначенням 95% довірчих інтервалів (95% ДІ) та критерію хі-квадрат Пірсона (χ2). До найбільш значущих факторів були віднесені інформативні ознаки зі значенням RR більше за 1,0.
Для прогнозування вірогідності розвитку діабетичної міопатії використовувався метод бінарної логістичної регресії. Ймовірність настання події розраховували за формулою:
Z = 1/(1 + еxp(–z)),
де z = a0 + a1*x1+a2*x2+...+an*xn; x1, ..., xn — незалежні змінні, а0, …, аn — коефіцієнти регресії [14].
Якщо розраховане значення Z ≥ 0,5, то даного хворого відносили до групи хворих, які мають ризик розвитку діабетичної міопатії. Якщо ж розраховане значення р було менше за 0,5, то даного хворого відносили до групи осіб, у яких ризик розвитку діабетичної міопатії є мінімальним.
Отримані результати рівняння логістичної регресії зіставляли з даними ультразвукового дослідження скелетної мускулатури та зі значеннями індексу маси скелетної мускулатури (ІСМ) [15]. При наявності морфологічних змін з боку скелетних м’язів за даними ультразвукового дослідження та зниженні ІСМ менше за 76,2 % (точка відсічення розраховувалася за допомогою ROC-аналізу [13]) діагноз «діабетична міопатія» підтверджувався.
Статистичну значущість моделі розраховували за Omnibus Test (універсальний критерій коефіцієнтів моделі) та коефіцієнтом прогностичної категоріальної валідності тесту. Також оцінювалися чутливість і специфічність побудованої моделі [16].
Для визначення якості отриманої моделі прогнозування використовувався ROC-аналіз, а також AUC (Area Under Curve) — числовий показник площі під ROC-кривою. Значення площі від 0,9 до 1 відповідає відмінній якості моделі, 0,8–0,9 — дуже хорошій, 0,7–0,8 — хорошій, 0,6–0,7 — середній, 0,5–0,6 — незадовільній якості [17]. Для оцінки дискримінуючої здатності моделі розраховувався індекс Gini за формулою:
Gini = 2 × (AUC – 0,5) × 100,
де AUC — площа під ROC-кривою; значення індексу Gini > 40 % відповідає допустимій якості методики аналізу; Gini > 60 % — відмінній якості методики аналізу [18].
Для всіх видів аналізу статистично значущими вважали відмінності при р < 0,05.
Результати
Проведене комплексне дослідження показало, що розвиток діабетичної міопатії відзначався у 45 (33,1 %) із 136 дітей, які перебували під спостереженням, зокрема, дане ускладнення було діагностовано в 19 (24,4 %) хлопчиків та 26 (44,8 %) дівчаток.
З огляду на можливу роль багатьох факторів у розвитку діабетичної міопатії, їх тісний зв’язок один з одним для прогнозу розвитку даного ускладнення в дітей, хворих на цукровий діабет, нами було відібрано 29 потенційних предикторів розвитку діабетичної міопатії (скарги з боку м’язової системи, обтяжена спадковість щодо цукрового діабету, вік та стать дитини, тривалість перебігу захворювання, показники ІМТ, ІЖМ, КПІ, пізні ускладнення цукрового діабету — діабетична ретинопатія, діабетична нефропатія, діабетична периферична полінейропатія, діабетична автономна нейропатія, діабетична хайропатія, діабетична ліподистрофія, рівні глюкози натще, глікованого гемоглобіну, креатинфосфокінази, лужної фосфатази, холестерину, тригліцеридів, загального білка, загального білірубіну, АлАТ, АсАТ, показник тимолової проби, ГГТ, ЛДГ, загальний кальцій у сироватці крові, доза інсуліну на 1 кг маси тіла, що застосовує дитина) з метою виявлення немодифікованих і модифікованих факторів ризику розвитку діабетичної міопатії.
Згідно з проведеним аналізом на підставі розрахунку показника RR було відібрано 7 факторів ризику, що можуть впливати на розвиток даного ускладнення в дітей, хворих на цукровий діабет (табл. 1). Інші 22 фактори, відносний ризик яких становив 1,0 та менше, були виключені з подальшого аналізу як малозначущі.
За результатами проведеного зіставлення була побудована модель логістичної регресії для індивідуального прогнозування ймовірності розвитку діабетичної міопатії в дітей, хворих на цукровий діабет 1-го типу. Коефіцієнти ознак, що були включені в модель, наведені в табл. 2.
Згідно з результатами проведеної логістичної регресії, модель прогнозу ймовірності розвитку діабетичної міопатії мала такий вигляд:
Z = 1/(1 + exp(–(–16,257 + 0,753*Х1 – 2,377*Х2 – 0,049*Х3 + 0,453*Х4 + 0,175*Х5 – 2,612*Х6 + + 0,303*Х7))).
Класифікаційна здатність моделі визначалася за даними навчальної вибірки і становила 90,2 % (табл. 3).
Чутливість моделі виявилася рівною 80,0 %, а специфічність — 80,0 %. Результати Omnibus Test підтвердили статистичну значущість даної моделі (χ2 = 64,405; df = 7; р < 0,0001). Коефіцієнт прогностичної категоріальної валідності тесту становив r = 0,835.
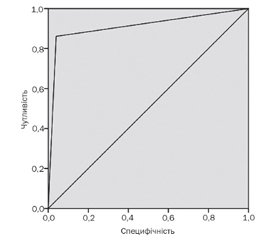
Площа під ROC-кривою, що відбиває наведене рівняння логістичної регресії, дорівнювала 0,911 ± 0,036 з 95% довірчим інтервалом 0,840–0,982, індекс Gini становив 82,2 %, що характеризує відмінну якість проведеної класифікації предикторів і високу значущість виділених факторів у розвитку діабетичної міопатії в дітей, хворих на цукровий діабет 1-го типу (рис. 1).
Для ілюстрації наводимо приклади визначення індивідуального ризику розвитку діабетичної міопатії.
Приклад 1
Хлопчик Д., 13 років, хворіє на цукровий діабет 1-го типу протягом 3 років. Спадковість обтяжена — бабуся по лінії матері має цукровий діабет 2-го типу. Скарг із боку м’язової системи не має. Зріст — 172 см, маса тіла — 58,2 кг. Індекс маси тіла — 19,7 кг/м2. Індекс жирової тканини — 18,4 %, кісточково-плечовий індекс — 1,04 ум.од. Глікемічний контроль — субоптимальний. Рівень глікованого гемоглобіну — 7,7 %. Оглянутий неврологом, патології з боку нервової системи не виявлено. Отримує інсулін в дозі 0,67 Од/кг маси тіла.
При дослідженні стану м’язової системи встановлено помірне зниження статичної та динамічної м’язової витривалості, порушення функції рівноваги при проведенні проб із заплющеними очима.
Розв’язання рівняння логістичної регресії:
Z = 1/(1 + exp(–(–16,257 + 0,753*13 – 2,377*1 – 0,049*3 + 0,453*18,4 + 0,175*7,7 – 2,612*1,04 + 0,303*1))) = 0,04.
Згідно з результатами рівняння логістичної регресії, ймовірність розвитку діабетичної міопатії є мінімальною.
При ультразвуковому дослідженні скелетних м’язів патології не виявлено. В дитини додатково визначений індекс скелетної мускулатури, показник якого становив 84,0 % (норма).
Висновок: динапенія.
Приклад 2
Дівчинка Т., 17 років, хворіє на цукровий діабет 1-го типу протягом 15 років. Спадковість не обтяжена. Скарг з боку м’язової системи не має. Зріст — 161 см, маса тіла — 52 кг. Індекс маси тіла — 20,1 кг/м2. Індекс жирової тканини — 22,6 %, кісточково-гомілковий індекс — 0,99 ум.од. Глікемічний контроль — з високим ризиком для життя. Рівень глікованого гемоглобіну — 9,4 %. Оглянута неврологом, діагностована периферична полінейропатія. Отримує інсулін у дозі 1,15 Од/кг маси тіла.
При дослідженні стану м’язової системи встановлене помірне зниження статичної та динамічної м’язової витривалості, порушення функції рівноваги при проведенні проб як з заплющеними, так і з розплющеними очима.
Розв’язання рівняння логістичної регресії:
Z = 1/(1 + exp(–(–16,257 + 0,753*17 – 2,377*2 – 0,049*16 + 0,453*22,6 + 0,175*9,4 – 2,612*0,99 + 0,303*2))) = 0,99.
Згідно з результатами рівняння логістичної регресії, відзначається висока ймовірність розвитку діабетичної міопатії.
При ультразвуковому дослідженні скелетних м’язів встановлено зменшення товщини скелетних м’язів, підвищення рівня ехогенності м’язової тканини та її деструктурованість за рахунок порушення впорядкованості розташування внутрішньом’язових сполучнотканинних прошарків, відсутність характерної смугастості м’язів. Показник індексу скелетної мускулатури становив 75,3 % (нижче від норми).
Висновок: діабетична міопатія.
Обговорення
Аналіз отриманих даних дозволив встановити, що на розвиток діабетичної міопатії в дітей, хворих на цукровий діабет, впливають як немодифіковані, так і модифіковані фактори ризику. З позиції можливості визначення предикторів прогнозу настання діабетичної міопатії у дітей, хворих на цукровий діабет, обов’язковим є врахування таких немодифікованих факторів, як вік і стать дитини, а також тривалість перебігу цукрового діабету. Згідно з отриманими нами даними встановлено, що ймовірність виникнення діабетичної міопатії є вищою в дітей старше 14 років, особливо в дівчаток, та при збільшенні тривалості перебігу цукрового діабету.
Також для визначення прогнозу розвитку діабетичної міопатії в дітей, хворих на цукровий діабет, важливо враховувати такі модифіковані фактори ризику, як порушення периферичного кровообігу, наявність діабетичної периферичної нейропатії, стан глікемічного контролю та показник індексу жирової маси. Науковими дослідженнями доведено, що погіршення кровопостачання скелетної мускулатури призводять до превалювання в м’язовій тканині процесів катаболізму над анаболізмом, що в поєднанні з порушенням вазодилататорних механізмів внаслідок розвитку ендотеліальної дисфункції, що має місце у хворих на цукровий діабет [19], підвищує втомлюваність скелетних м’язів і призводить до зниження м’язової сили [20]. У нашому дослідженні для оцінки периферичного кровообігу ми застосовували визначення кісточково-плечового індексу, що вважається індикатором захворювань периферичних артерій, зниження якого у хворих на цукровий діабет розглядається як ранній прояв діабетичної периферичної ангіопатії [21, 22]. Критичний рівень КПІ в дітей, хворих на цукровий діабет, що чинив вплив на можливість розвитку діабетичної міопатії, визначений як < 1,0.
Потрібно враховувати також і той факт, що в розвитку діабетичної міопатії певну роль відіграє діабетична периферична нейропатія. Зменшення м’язової маси в цьому випадку відбувається за рахунок втрати мотонейронів і денервації як повільних, так і швидких моторних одиниць [23]. Це, в свою чергу, призводить до компенсаторного перерозподілу моторних одиниць, що залишилися, реінервації м’язів та порушення розташування міофібрил. Наслідком таких процесів є погіршення функції м’язового волокна та втрата його сили [24]. Окрім того, вважається, що навіть мінімальні прояви нервово-м’язової дисфункції внаслідок надлишкового глікозилювання м’язових мембран можуть призвести до функціональних порушень м’язової системи [25].
Одним із провідних факторів ризику розвитку діабетичної міопатії в дітей, хворих на цукровий діабет, згідно з отриманими нами даними, є хронічна гіперглікемія, при якій збільшується кількість кінцевих продуктів глікування. Відомо, що гіперглікемія прискорює зниження м’язової маси, а збільшення концентрації кінцевих продуктів глікування за рахунок їх накопичення у скелетних м’язах сприяє зниженню м’язової сили в пацієнтів з діабетом [26]. Крім того, під впливом гіперглікемії клітини-сателіти м’язової тканини можуть перетворюватися в адипоцити, що призводить до жирової інфільтрації м’язів, збільшення жирової маси та, відповідно, до зменшення м’язової маси і порушення функції скелетної мускулатури [27]. Морфологічними особливостями в цьому випадку є зміна архітектоніки скелетних м’язів, зменшення кількості м’язових волокон і накопичення жирових клітин між міоцитами, що погіршують мікроциркуляцію тканин і викликають гіпоксію клітин, тобто порушення кровопостачання [28].
Таким чином, після встановлення наявності немодифікованих факторів ризику в дитини, хворої на цукровий діабет (жіноча стать, вік старше 14 років, тривалість цукрового діабету понад 1 року), та модифікованих факторів ризику (збільшення індексу жирової маси, незадовільний глікемічний контроль, зниження кісточково-плечового індексу та наявність діабетичної периферичної полінейропатії) пацієнта необхідно віднести до групи ризику щодо розвитку діабетичної міопатії та за допомогою запропонованого рівняння логістичної регресії прогнозувати її формування навіть за відсутності специфічних скарг із боку м’язової системи. Це має певне значення для визначення подальшої тактики ведення хворого, призначення додаткових методів дослідження та проведення лікувально-профілактичних заходів з метою запобігання виникненню та/або прогресуванню даного ускладнення.
Висновки
1. Результати проведеного дослідження показали, що діабетична міопатія є частим ускладненням цукрового діабету в дітей, що розвивається в 33,1 % випадків.
2. Пріоритетне значення у розвитку діабетичної міопатії в дітей, хворих на цукровий діабет 1-го типу, має не тільки стан глікемічного контролю, а й тривалість цукрового діабету, вік пацієнта, його стать, а також наявність діабетичної периферичної полінейропатії, порушення периферичного кровообігу та збільшення індексу жирової маси.
3. Розроблена математична модель прогнозування дозволяє з високою вірогідністю розрахувати ймовірність розвитку діабетичної міопатії в дітей, хворих на цукровий діабет, та може застосовуватись для виявлення пацієнтів із високим ризиком розвитку даного ускладнення для своєчасного проведення діагностичних і лікувально-профілактичних заходів.
Інформація про фінансування. Робота виконана в рамках НДР «Прогнозування виникнення, діагностика та терапія порушень кістково-м’язової системи у дітей, хворих на цукровий діабет», номер держреєстрації 0119U100456.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Отримано/Received 26.01.2021
Рецензовано/Revised 04.02.2021
Прийнято до друку/Accepted 15.02.2021
Список литературы
1. Hernandez-Ochoa E.O., Vanegas C. Diabetic myopathy and mechanisms of disease. Biochemistry & Pharmacology: Open Access. 2015. Vol. 4. № 05. P. e179. doi: 10.4172/2167-0501.1000e179.
2. Дыдышко Ю.В., Шепелькевич А.П. Возможности оценки состояния мышечного компонента в норме и при сахарном диабете. Медицинская панорама. 2015. № 5. С. 45-50.
3. Chulvi-Medrano I., Faigenbaum A.D., Cortell-Tormo J.M. Puede el entrenamiento de fuerza prevenir y controlar la dinapenia pediátrica. Retos. Nuevas Tendencias en Educación Física, Deporte y Recreación. 2018. № 3. P. 298-307. doi.org/10.47197/retos.v0i33.52314.
4. Dimitriadis G.D., Maratou E., Kountouri A., Board M., Lambadiar V. Regulation of Postabsorptive and Postprandial Glucose Metabolism by Insulin-Dependent and Insulin-Independent Mechanisms: An Integrative Approach. Nutrients. 2021. № 13. P. 159. doi.org/10.3390/nu13010159.
5. Coleman S.K., Rebalka I.A., D’Souza D.M., Hawke T.J. Skeletal muscle as a therapeutic target for delaying type 1 diabetic complications. World journal of diabetes. 2015. № 6(17). Р. 1323. doi: 10.4239/wjd.v6.i17.1323.
6. Щербакова А.М. Физическое развитие детей и подростков: методические рекомендации. Витебск: ВГУим. П.М. Машерова, 2017. 56 с.
7. Deurenberg P., Weststrate J.A., Seidell J.C. Body mass index as a measure of body fatness: age- and sex-specific prediction formulas. British Journal of Nutrition. 1991. № 65(02). Р. 105. doi: 10.1079/bjn19910073.
8. Crawford F., Welch K., Andras A., Chappell F.M. Ankle brachial index for the diagnosis of lower limb peripheral arterial disease. Cochrane Database of Systematic Reviews. 2016. Issue 9. № CD010680. doi: 10.1002/14651858.CD010680.pub2.
9. Пронина Н.В. Исследования и количественная оценка функционального состояния скелетных мышц методом динамометрии: методические указания к проведению лабораторной работы. Симферополь: КФМУ, 2016. 100 с.
10. Голубова Т.Н. Оценка функционального состояния и статической выносливости мышц туловища студентов КГМУ. Педагогика, психология и медико-биологические проблемы физического воспитания и спорта. 2007. № 6. С. 79-82.
11. Васильева А.А., Коновалова Т.Г. Оценка силовой выносливости мышц спины и пресса как способ контроля профилактики сколиоза студентов 3 курса 2-й функциональной группы. Студенческий электрон. научн. журн. 2018. № 22(42). URL: https://sibac.info/journal/student/42/122149. (Дата обращения: 01.03.2021).
12. Mарченкова Л.Ф., Опарина, Л.Д., Паршакова Л.А. Физическая культура. Использование координационных упражнений на занятиях со студентами специальной медицинской группы. Новосибирск: НГТУ, 2018. 38 с.
13. Литвин А.А., Калинин А.Л., Тризна Н.М. Использование данных доказательной медицины в клинической практике (сообщение 3. Диагностические исследования). Проблемы здоровья и экологии. 2008. № 4(18). С. 12-19.
14. Леонов В.П. Логистическая регрессия в медицине и биологии [Электронный ресурс]. Биометрика — журнал для медиков и биологов, сторонников доказательной медицины. Режим доступа: www.biometrica.tomsk.ru/logit_1.htm.
15 Janssen I., Heymsfield S.B., Ross R. Low relative skeletal muscle mass (sarcopenia) in older persons is associated with functional impairment and physical disability. J. Am. Geriatr. Soc. 2002. № 50. P. 889-896.
16. Лях Ю.Е., Гурьянов В.Г. Математическое моделирование при решении задач классификации в биомедицине. Український журнал телемедицини та медичної телематики. 2012. Т. 10. № 2. С. 69-76.
17. Сорокин А.С. К вопросу валидации модели логистической регрессии в кредитном скоринге. Вестник евразийской науки. 2014. № 2(21). С. 81. URL: https://cyberleninka.ru/article/n/k-voprosu-validatsii-modeli-logisticheskoy-regressii-v-kreditnom-skoringe.
18. Мэйз Э. Руководство по кредитному скорингу. Минск: Гревцов Паблишер, 2008. 464 с.
19. Shi Y., Vanhoutte P.M. Macro- and microvascular endothelial dysfunction in diabetes: endothelial cell function damage induced by diabetes. Journal of diabetes. 2017. Vol. 9. №. 5. С. 434-449. doi.org/10.1111/1753-0407.12521
20. Kim J.H., Lim S., Choi S.H., Kim K.M., Yoon J.W., Kim K.W. Sarcopenia: An independent predictor of mortality in community-dwelling older Korean men. The Journal of Gerontology: Series A. 2014. Vol 69. № 10. P. 1244-52. https://doi.org/10.1093/gerona/glu050
21. Crawford F., Welch K., Andras A., Chappell F.M. Ankle brachial index for the diagnosis of lower limb peripheral arterial disease. Cochrane Database of Systematic Reviews. 2016. Issue 9. Art. № CD010680. doi: 10.1002/14651858.CD010680.pub2.
22. Сумин А.Н., Безденежных Н.А., Федорова Н.В., Щеглова А.В., Индукаева Е.В., Артамонова Г.В. Значения сердечно-лодыжечного сосудистого и лодыжечно-плечевого индексов у пациентов с нарушениями углеводного обмена (исследование ЭССЕ-РФ в Кемеровской области). Терапевтический архив. 2016. Т. 88. № 12. С. 11-20.
23. Analiza P.S., Pureza D.Y., Landre C.B. Frailty syndrome in elderly patients with type 2 diabetes mellitus. Acta Paul Enferm. 2015. Vol. 28. № 6. P. 503-509. http://dx.doi.org/10.1590/1982-0194201500085.
24. Лесняк О.М. Остеопороз: руководство для врачей. Москва: ГЭОТАР-Медиа, 2016. 464 с.
25. Leenders M., Verdijk L.B., Hoeven L., Adam J.J., van Kranenburg J., Nilwik R. Patients with type 2 diabetes show a greater decline in muscle mass, muscle strength, and functional capacity with aging. J. Am. Med. Dir. Assoc. 2013. Vol. 14. № 8. Р. 585-592. doi: 10.1016/j.jamda.2013.02.006.
26. Онучина Ю.С., Гурьева И.В. Взаимосвязь саркопении и сахарного диабета типа 2. Эндокринология: Новости. Мнения. Обучение. 2018. № 4(25). P. 32-41. doi: 10.24411/2304-9529-2018-14004.
27. Gaskin F.S., Farr S.A., Banks W.A. Ghrelin-induced feeding is dependent on nitric oxide. Peptides. 2003. Vol. 24. P. 913-918. doi.org/10.1016/S0196-9781(03)00160-8.
28. Hernández-Ochoa E.O., Llanos P., Johanna T. Lanner. The underlying mechanisms of diabetic myopathy. Journal of Diabetes Research. 2017. Article ID: 7485738, 3 pages. doi.org/10.1155/2017/7485738
/52_2.jpg)

/51_2.jpg)
/52_4.jpg)