Журнал «Здоровье ребенка» Том 16, №2, 2021
Вернуться к номеру
Значення тимусом та активацією регульованого хемокіну в діагностиці атопічного дерматиту в дітей
Авторы: Дитятковський В.О.(1), Абатуров О.Є.(1), Аліфіренко О.О.(2), Філатова І.А.(3), Таран С.М.(3)
(1) — Дніпровський державний медичний університет, м. Дніпро, Україна
(2) — Алергоцентр МНПП «Клінічна лікарня швидкої медичної допомоги Дніпровської міської ради», дитяче стаціонарне відділення, м. Дніпро, Україна
(3) — Алергоцентр МНПП «Клінічна лікарня швидкої медичної допомоги Дніпровської міської ради», консультативно-діагностичне відділення, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
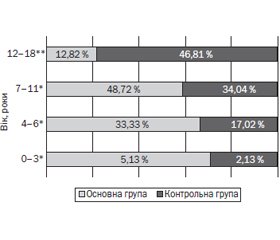
Актуальність. На сьогодні загальний імуноглобулін Е, що протягом декількох десятиліть використовується як базовий біомаркер атопії, у більшості випадків не відображає ступінь тяжкості алергічного запалення шкіри в дітей, хворих на атопічний дерматит (АД). Тому існує потреба в нових сироваткових біомаркерах, які б дозволяли точно діагностувати ступінь тяжкості, контролювати перебіг АД та попередити його трансформацію в фенотипи в поєднанні з іншими атопічними захворюваннями (АЗ). Протягом останніх двох десятиліть активно вивчається новий, асоційований з Т-лімфоцитами-хелперами 2-го типу біомаркер ступеня тяжкості запалення шкіри при атопічному дерматиті — тимусом та активацією регульований хемокін (TARC/CCL17). Мета дослідження: визначити асоціації сироваткового TARC/CCL17 з АД у дітей: віком, ступенем тяжкості та фенотипами АД — ізольованим і в поєднанні з коморбідними АЗ. Матеріали та методи. До основної групи увійшли 39 дітей, хворих на атопічний дерматит, віком 3–6, 7–11 та 12–18 років. Фенотипами основної групи були ізольований АД і поєднаний з коморбідними АЗ — сезонним алергічним ринітом/ринокон’юнктивітом, та/або цілорічним алергічним ринітом, та/або бронхіальною астмою. До контрольної групи увійшли 47 дітей, хворих на патологію травної системи, без клінічних ознак атопії. Ступінь тяжкості АД у дітей основної групи визначався за допомогою індексу SCORing Atopic Dermatitis (SCORAD). В усіх дітей було проведене визначення сироваткових концентрацій TARC. Результати. Визначені вірогідні прямі асоціації TARC/CCL17 зі ступенем тяжкості АД та індексом SCORAD, який є клінічним маркером тяжкості АД. Обернена вірогідна асоціація була визначена між TARC/CCL17 та віком пацієнтів як основної, так і контрольної групи. Також були визначені вірогідні асоціації зі збільшенням віку пацієнтів: з розвитком фенотипу АД, поєднаного з коморбідними АЗ, та чоловічою статтю (обернена вірогідна асоціація між віком та жіночою статтю). Висновки. TARC/CCL17 вірогідно асоційований зі збільшенням ступеня тяжкості в пацієнтів, хворих на АД усіх фенотипів — ізольований та поєднаний із коморбідними АЗ. Зі збільшенням віку рівень TARC/CCL17 знижується, АД має схильність до прогресії у фенотип, поєднаний з іншим АЗ, і захворюваність зростає серед пацієнтів чоловічої статі. Використання TARC/CCL17 у діагностичному процесі атопічного дерматиту в дітей дозволить забезпечити більш персоналізований контроль і попередження трансформації хвороби у фенотипи, поєднані з іншими атопічними захворюваннями.
Background. At present, total immunoglobulin E, which has been used as a basic biomarker of atopy for several decades, in most cases does not reflect the severity of allergic inflammation in the skin in children suffering from atopic dermatitis (AD). Therefore, there is a need for new serum biomarkers that would allow to accurately diagnose the severity degree, control the course of AD and prevent its transformation into phenotypes in combination with other atopic diseases (AtD). In the past two decades, a new biomarker of the inflammation severity degree in the skin within AD — thymus- and activation-regulated chemokine (TARC/CCL17), associated with T-lymphocytes type 2 has been actively studied. The purpose of the study was to determine the associations of serum concentrations of TARC/CCL17 with the AD in children: age, severity, and AD phenotypes — isolated and combined with comorbid AtD. Materials and methods. The basic group comprised 39 children with atopic dermatitis aged 3–6, 7–11, and 12–18 years old. The phenotypes of the basic group were AD isolated and combined with comorbid AtD — seasonal allergic rhinitis/rhinoconjunctivitis, and/or perennial allergic rhinitis, and/or bronchial asthma. The control group comprised 47 children with gastrointestinal pathology without clinical signs of atopy. The severity of AD in children of the basic group was determined using the scoring atopic dermatitis index (SCORAD). Results. Significant direct associations of TARC/CCL17 with the AD severity and the SCORAD index, which is a clinical marker of AD severity, were determined. A reverse association was found between TARC/CCL17 and the age of patients in both the basic and control groups. Also, significant associations were found with the patients’ age increase, with the development of the AD phenotype combined with comorbid AtD and male gender (reverse significant association between age and female gender). Conclusions. TARC/CCL17 is significantly associated with the severity degree increase in patients with AD of all the phenotypes — isolated and combined with comorbid AtD. With the age increase, the level of TARC/CCL17 decreases, AD has a trend to progress into phenotype combined with other AtDs, and the incidence increases among male patients. The use of TARC/CCL17 in the diagnostic process of atopic dermatitis in children will provide more personalized control and prevention of progression of the disease into phenotypes combined with other atopic diseases.
атопічний дерматит; діти; фенотипи; асоціації; тимусом та активацією регульований хемокін
atopic dermatitis; children; phenotypes; associations; thymus- and activation-regulated chemokine
Вступ
Матеріали та методи
Результати та обговорення
/35.jpg)
Висновки
- Bieber T. Atopic dermatitis. Ann Dermatol. 2010 May. 22(2). 125-37. doi: 10.5021/ad.2010.22.2.125. Epub 2010 May 17. PMID: 20548901. PMCID: PMC2883413.
- Kataoka Y. Thymus and activation-regulated chemokine as a clinical biomarker in atopic dermatitis. J. Dermatol. 2014 Mar. 41(3). 221-9. doi: 10.1111/1346-8138.12440.
- Vestergaard C. TARC and CTACK; Two Pivotal Chemokines in Atopic Dermatitis. Forum Nordic Derm-Venear. 2007. Vol. 12. 37(suppl. 14).
- Thijs J., Krastev T., Weidinger S., Buckens C.F., de Bruin-Weller M., Bruijnzeel-Koomen C. et al. Biomarkers for atopic dermatitis: a systematic review and meta-analysis. Curr. Opin. Allergy Clin. Immunol. 2015 Oct. 15(5). 453-60. doi: 10.1097/ACI.0000000000000198.
- Machura E., Rusek-Zychma M., Jachimowicz M., Wrzask M., Mazur B., Kasperska-Zajac A. Serum TARC and CTACK concentrations in children with atopic dermatitis, allergic asthma, and urticaria. Pediatr. Allergy Immunol. 2012 May. 23(3). 278-84. doi: 10.1111/j.1399-3038.2011.01225.x. Epub 2011 Oct 21. PMID: 22017510.
- Fujisawa T., Nagao M., Hiraguchi Y., Katsumata H., Nishimori H., Iguchi K. et al. Serum measurement of thymus and activation-regulated chemokine/CCL17 in children with atopic dermatitis: elevated normal levels in infancy and age-specific analysis in atopic dermatitis. Pediatr. Allergy Immunol. 2009 Nov. 20(7). 633-41. doi: 10.1111/j.1399-3038.2009.00851.x. Epub 2009 Feb 11. PMID: 19236603.
- Umeda M., Origuchi T., Kawashiri S.Y., Koga T., Ichinose K., Furukawa K. et al. Thymus and Activation-regulated Chemokine as a Biomarker for IgG4-related Disease. Sci Rep. 2020 Apr 7. 10(1). 6010. doi: 10.1038/s41598-020-62941-9. PMID: 32265499. PMCID: PMC7138842.
- Nakazato J., Kishida M., Kuroiwa R., Fujiwara J., Shimoda M., Shinomiya N. Serum levels of Th2 chemokines, CCL17, CCL22, and CCL27, were the important markers of severity in infantile atopic dermatitis. Pediatr Allergy Immunol. 2008 Nov. 19(7). 605-13. doi: 10.1111/j.1399-3038.2007.00692.x. Epub 2008 Feb 6. PMID: 18266834.
- Esaki H., Takeuchi S., Furusyo N., Yamamura K., Hayashida S., Tsuji G. et al. Levels of immunoglobulin E specific to the major food allergen and chemokine (C-C motif) ligand (CCL)17/thymus and activation regulated chemokine and CCL22/macrophage-derived chemokine in infantile atopic dermatitis on Ishigaki Island. J. Dermatol. 2016 Nov. 43(11). 1278-1282. doi: 10.1111/1346-8138.13360. Epub 2016 Mar 30. PMID: 27028543.
- Kakinuma T., Nakamura K., Wakugawa M., Mitsui H., Tada Y., Saeki H. et al. Thymus and activation-regulated chemokine in atopic dermatitis: serum thymus and activation-regulated chemokine level is closely related with disease activity. J. Allergy Clin. Immunol. 2001. 107. 535-41.
- Miyahara H., Okazaki N., Nagakura T., Korematsu S., Izumi T. Elevated umbilical cord serum TARC/CCL17 levels predict the development of atopic dermatitis in infancy. Clin. Exp. Allergy. 2011 Feb. 41(2). 186-91. doi: 10.1111/j.1365-2222.2010.03634.x. Epub 2010 Nov 5. PMID: 21054588/
- Uchida H., Kamata M., Nagata M., Fukaya S., Hayashi K., Fukuyasu A. et al. Conjunctivitis in patients with atopic dermatitis treated with dupilumab is associated with higher baseline serum levels of immunoglobulin E and thymus and activation-regulated chemokine but not clinical severity in a real-world setting. J. Am. Acad. Dermatol. 2020 May. 82(5). 1247-1249. doi: 10.1016/j.jaad.2019.12.039. Epub 2019 Dec 26. PMID: 31884090.
- Belgrave D.C., Granell R., Simpson A., Guiver J., Bishop C., Buchan I. et al. Developmental profiles of eczema, wheeze, and rhinitis: two population-based birth cohort studies. PLoS Med. 2014 Oct 21. 11(10). e1001748. doi: 10.1371/journal.pmed.1001748. PMID: 25335105. PMCID: PMC4204810.
- Clark H., Granell R., Curtin J.A., Belgrave D., Simpson A., Murray C. et al. Differential associations of allergic disease genetic variants with developmental profiles of eczema, wheeze and rhinitis. Clin. Exp. Allergy. 2019 Nov. 49(11). 1475-1486. doi: 10.1111/cea.13485. Epub 2019 Oct 15. PMID: 31441980. PMCID: PMC6899469.
- Kryuchko T.O., Bubyr L.M., Nesina I.M., Tkachenko O.Y., Izmailova O.V., Poda O.A. et al. Ways of optimizing the diagnostics of food allergies in children based on the clinical and immunological criteria. Wiad Lek. 2020. 73(10). 2255-2260. PMID: 33310959.

/35_2.jpg)
/36.jpg)